
- •Лекции №35-37 Карбонильные соединения. Альдегиды и кетоны
- •Изомерия и номенклатура предельных альдегидов и кетонов
- •Методы получения альдегидов и кетонов
- •Физические свойства
- •Химические свойства альдегидов и кетонов
- •Реакции нуклеофильного присоединения по карбонильной группе
- •Реакционная способность карбонильных соединений
- •Кето–енольная таутомерия, катализируемая основаниями и кислотами
- •1. Галогенирование.
- •2. Альдольная конденсация
- •Альдольная конденсация кетонов
- •3. Реакции изотопного обмена.
- •4. Рацемизация оптически активных кетонов
- •Реакции восстановления
- •Реакции окисления карбонильных соединений
- •Реакции окислительно-восстановительного диспропорционирования
- •Аминометилирование по Манниху
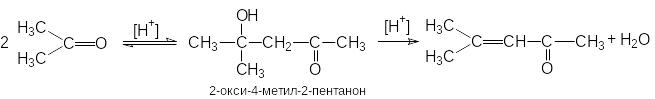
Альдольная конденсация кетонов
Кетоны значительно труднее вступают в реакции альдольной автоконденсации по сравнению с альдегидами. Структурные условия здесь неблагоприятны как с точки зрения скорости, так и сточки зрения равновесия. Однако если реакцию проводить при кислотном катализе, то образующийся продукт конденсации будет быстро дегидратироваться, превращаясь в мезитилоксид. Эта последняя стадия смещает равновесие в сторону полного превращения кетона
3. Реакции изотопного обмена.
Обмен водорода при а-углеродных атомах карбонильных соединениях на дейтерий под действием тяжелой воды может быть представлен стехиометрическим уравнением
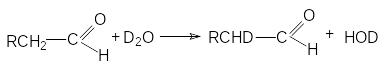
Э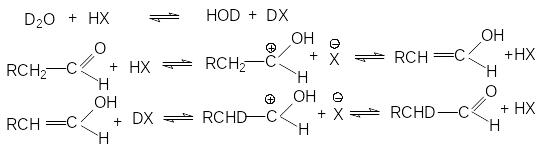 та
реакция катализируется кислотами и
основаниями. Кислотно-каталитическая
реакция предполагает ключевую роль
енольной формы карбонильного соединения
та
реакция катализируется кислотами и
основаниями. Кислотно-каталитическая
реакция предполагает ключевую роль
енольной формы карбонильного соединения
Первичная реакция изотопного обмена может сопровождаться последующим дейтерированием, если при -углеродном атоме остаются незамещенные атомы водорода.
Катализ изотопного обмена основаниями протекает через следующие стадии

4. Рацемизация оптически активных кетонов
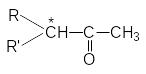
Рацемизация таких оптически активных соединений катализируется кислотами и основаниями. Основно-каталитическая рацемизация может быть легко обоснована образованием карбаниона при отрыве протона основанием от хлорального углеродного атома.

Поскольку оптически активный карбанион имеет плоское строение последующая атака воды при ее протолитическом взаимодействии с -углеродным атомом равновероятна с противоположных сторон и поэтому дает рацемическую смесь.
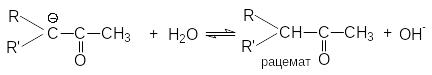
Кислотно-каталитическая рацемизация приводит к образованию енольной формы кетона, в которой хиральность атома углерода утрачивается, поэтому обратная реакция образования кето-формы дает рацемическую смесь.
Реакции восстановления
Промежуточная степень окисления карбонильных соединений обусловливает их способность к реакциям окисления и восстановления. В качестве восстановителей в реакциях восстановления используют молекулярный водород и гидридные комплексы алюминия и бора.
Восстановление карбонильных соединений до спиртов.
 а)
восстановление молекулярным водородом
а)
восстановление молекулярным водородом
В качестве катализаторов этих реакций используют Ni, Pd, Pt,CuCrO2.
б) восстановление гидридными комплексами металлов

Эти методы находят применение в случае дорогостоящих или неустойчивых карбонильных соединений. В этих реакциях ключевой стадией является перенос гидрид-аниона от восстановления к карбонильному углеродному атому

Можно полностью использовать все четыре атома водорода в литийалюминий гидриде:

Преимущество литий алюминий гидрида состоит в том, что он селективно восстанавливает карбонильные группы, не затрагивая >C=C< связи. Он также восстанавливает карбонильные группы карбоновых кислот.
Другой восстановитель NaBH4 более мягкий восстановитель. Он восстанавливает альдегиды и кетоны, но инертен по отношению к карбоновым кислотам и сложным эфирам.
в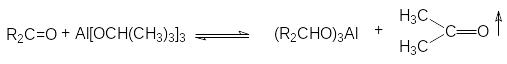 )
восстановление алкоголятами алюминия
– реакция Меервейна-Понндорфа-Верлея-Оппенауэра
)
восстановление алкоголятами алюминия
– реакция Меервейна-Понндорфа-Верлея-Оппенауэра
Смешение равновесия в этой реакции обеспечивается непрерывной отгонкой карбонильного продукта из реакционной массы.
Восстановление карбонильных соединений до углеводородов.
а) восстановление по Клемменсену.
Е сли
карбонильное соединение устойчиво к
действию кислот, то используют этот тип
восстановления
сли
карбонильное соединение устойчиво к
действию кислот, то используют этот тип
восстановления
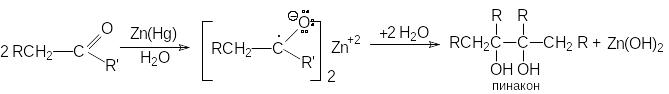
б) ион-радикальная димеризация альдегидов и кетонов.
Если восстановление амальгамированным цинком или магнием осуществлять в нейтральной водной среде, то результатом реакции является образование пинаконов. Первой стадией этой реакции является перенос электрона от металла к карбонильной группе с последующей димеризацией ион-радикалов
в) восстановление по Кижнеру-Вольфу
Этот вид восстановления используется в тех случаях, когда объект восстановления устойчив к основаниям

