
Лекции / Лекция_38(б)
.DOC
2. Методы получения
Реакции окисления
Аренкарбальдегиды получают окислением метиларенов и бензиловых спиртов.
ArCH3 [O];((( ArCHO
О![]() кислители:
CrO3
+ (CH3CO)2O;
CrO2Cl2
кислители:
CrO3
+ (CH3CO)2O;
CrO2Cl2
При окисление других алкиларенов образуются алкиларил- кетоны.
ArCH2R [O];((( ArC(O)R
Окислители: О2 в присутствии катализаторов – солей кобальта и марганца.
Окисление диарилметанов дает диарилкетоны.
ArCH2Ar [O];((( ArC(O)Ar
Окислители: KMnO4; CrO3.
Гидролиз дигалогеналкиларенов
ArCCl2R 2H2O;-2HCl ArC(O)R (R=H, Alk, Ar)
Ацилирование аренов
ArH RC(O ArC(O)R
Формилирование аренов
Для формилирования (введения группы СНО) необходим хлорангидрид муравьиной кислоты, который крайне нестабилен и разлагается на СО и НCl, поэтому используют другие формилирующие реагенты
Реакция Гаттермана-Коха. Формилирование по Гаттерману-Коху осуществляется под действием оксида углерода (II) и хлористого водорода в присутствии катализатора Фриделя-Крафтса - хлорида алюминия, промотированного хлоридом меди (I).
![]()
Роль однохлористой меди в этой реакции неясна: возможно она связывает СО в комплекс, что способствует образованию крайне нестабильного хлористого формила HCOCl из CO и HCl. Таким путем удается ввести альдегидную группу в алкилбензолы, арилгалогениды, полициклические углеводороды, причем формильная группа вводится селективно в пара-положение. Реакция не применима для формилирования фенолов, их эфиров и ариламинов.
Реакция Гаттермана. В качестве формилирующего агента используется смесь безводного HCN и газообразного хлористого водорода в присутствии кислоты Льюиса.
ArH + HCN + HCl [AlCl3];((((( ArCH=NHCl- H2O;-NH4Cl;((((( ArC(O)H
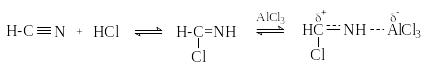 Электрофильным
реагентом является, вероятно, комплекс
катализатора с формимидхлоридом.
Электрофильным
реагентом является, вероятно, комплекс
катализатора с формимидхлоридом.
Образующийся в синтезе гидрохлорид альдимина ArCH=NHCl гидролизуют до альдегида.
Для того, чтобы избежать применения ядовитой синильной кислоты, Р.Адамс модифицировал реакцию, заменив синильную кислоту цианидом цинка (реакция Гаттермана-Адамса). Это позволило из цианида цинка и HCl получать непосредственно в реакционной смеси HCN и безводный хлористый цинк, играющий роль слабой кислоты Льюиса. Этот метод дает хорошие результаты при формилировании фенолов и простых эфиров фенолов.
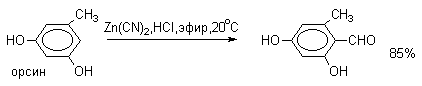
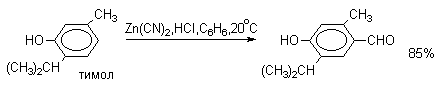
Реакции Гаттермана и Гаттермана-Адамса используют также для формилирования алкилбензолов и конденсированных ароматических углеводородов. Метод не применим для аренов, содержащих дезактивирующие заместители, и ароматических аминов.
Реакция Вильсмейера-Хаака. В качестве формилирующего реагента используют диметилформамид (ДМФА) в присутствии POCl3 как кислоты Льюиса.
ArH + HC(O)N(CH3)2 POCl3;((((( H2O ArC(O)H + NH(CH3)2
Э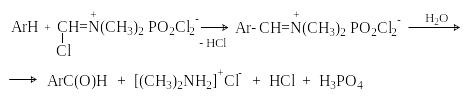 лектрофильным
агентом в реакции Вильсмейера-Хаака
является иминиевая соль, которая
образуется при взаимодействии ДМФА и
хлорокиси фосфора (см. лек.29).
лектрофильным
агентом в реакции Вильсмейера-Хаака
является иминиевая соль, которая
образуется при взаимодействии ДМФА и
хлорокиси фосфора (см. лек.29).
Реакция Вильсмейера-Хаака чрезвычайно проста в экспериментальном отношении и обеспечивает очень высокие выходы ароматических альдегидов, содержащих NR2-,OR- или OH-группы. Она оказывается практически ценной при формилировании конденсированных ароматических углеводородов - антрацена, азулена, пирена и др., а также разнообразных гетероциклических соединений ряда фурана, тиофена, пиррола, индола.
Р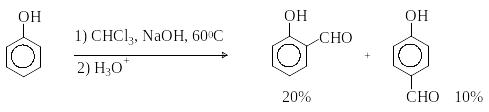 еакция
Реймера-Тимана. Используется для
формилирования фенолов.
еакция
Реймера-Тимана. Используется для
формилирования фенолов.
Подробнее см. лек.№29.
Восстановление хлорангидридов аренкарбоновых кислот (реакция Розенмунда)
ArC(O)Cl + H2 [Pd];(((( ARC(O)H + HCl
3. Химические свойства
Реакции ароматических карбонильных соединений подобны превращениям их алифатических аналогов. Однако необходимо отметить следующие особенности:
карбонильные соединения аренов обладают более низкой реакционной способностью по отношению к нуклеофильным реагентам;
аренкарбальдегиды и диарилкетоны не способны к енолизации;
возможны реакции электрофильного замещения в ароматическом кольце.
а) Бензоиновая конденсация
П ри
нагревании в присутствии цианидов
аренкарбальдегиды образуют -гидроксикетоны
(бензоины).
ри
нагревании в присутствии цианидов
аренкарбальдегиды образуют -гидроксикетоны
(бензоины).
М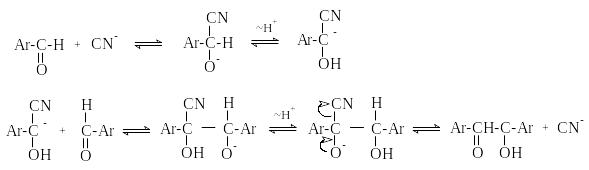 еханизм
реакции:
еханизм
реакции:
Ключевая стадия процесса – образование карбаниона за счет миграции протона от атома углерода к атому кислорода, которая становится возможной благодаря электроноакцепторному действию цианогруппы.
б) Реакция Канницаро
Аренкарбальдегиды, как альдегиды, не содержащие -водородных атомов, вступают в реакцию Канницаро.
2ArC(O)H + NaOH ARCOONa + ARCH2OH
Подробнее см. лек.№31-33.
в) Реакция Перкина
Аренкарбальдегиды конденсируются с ангидридами карбоновых кислот в присутствии оснований (ацетатов и карбонатов щелочных металлов, пиридина). При этом альдегид выполняет роль карбонильной, а ангидрид – метиленовой компоненты.
ArC(O)H + (CH3CO)2O [CH3COONa];(((((((( Ar-CH=CH-COOH + CH3COOH + H2O
М еханизм
реакции:
еханизм
реакции:
г) Автоокисление
А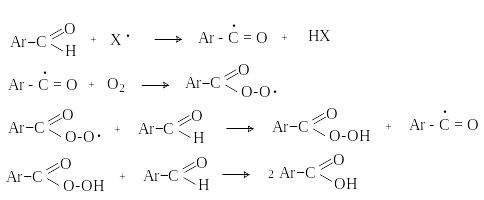 ренкарбальдегиды
очень легко окисляются кислородом
воздуха на свету. Процесс протекает по
свободнорадикальному механизму через
промежуточное образование стабильных
ароильных радикалов.
ренкарбальдегиды
очень легко окисляются кислородом
воздуха на свету. Процесс протекает по
свободнорадикальному механизму через
промежуточное образование стабильных
ароильных радикалов.
д) Хлорирование
А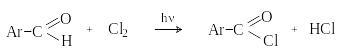 ренкарбальдегиды
легко хлорируются по свободнорадикальному
механизму с образованием хлорангидридов.
ренкарбальдегиды
легко хлорируются по свободнорадикальному
механизму с образованием хлорангидридов.
М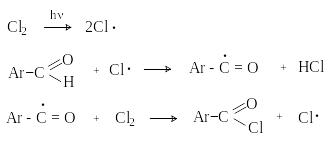 еханизм:
еханизм:
4. Важнейшие представители
Бензальдегид – бесцветная жидкость с запахом горького миндаля. Получают из толуола прямым окислением или хлорированием до бензальхлорида с последующим гидролизом. Как альдегид, не содержащий -водородных атомов, бензальдегид выступает в реакциях конденсации в качестве метиленовой компоненты. При конденсации его с ацетальдегидом образуется коричный альдегид:
а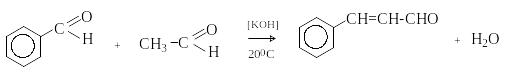
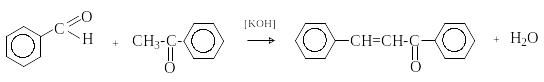 при конденсации с с ацетофеноном –
халкон:
при конденсации с с ацетофеноном –
халкон:
Коричный альдегид обладает свойствами ,-непредельных карбонильных соединений. Используется в парфюмерии и пищевой промышленности.
Б ензофенон
– бесцветное кристаллическое вещество.
В промышленности его получают окислением
дифенилметана. Для бензофенона характерно
образование стабильного анион-радикала
синего цвета при взаимодействии с
металлическим натрием.
ензофенон
– бесцветное кристаллическое вещество.
В промышленности его получают окислением
дифенилметана. Для бензофенона характерно
образование стабильного анион-радикала
синего цвета при взаимодействии с
металлическим натрием.
Такие анион-радикальные соли называют металлкетилами. Их относительная устойчивость связана со стабилизирующим влиянием на свободнорадикальный центр двух бензольных ядер и отрицательно заряженного атома кислорода.
Д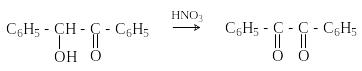 ибензоил
– желтое кристаллическое вещество.
Образуется при окислении бензоина.
ибензоил
– желтое кристаллическое вещество.
Образуется при окислении бензоина.
П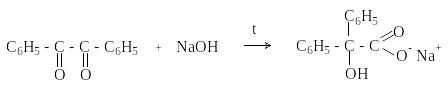 ри
нагревании со спиртовым раствором
щелочи дибензоил претерпевает
перегруппировку с образованием бензиловой
кислоты (бензиловая перегруппировка).
ри
нагревании со спиртовым раствором
щелочи дибензоил претерпевает
перегруппировку с образованием бензиловой
кислоты (бензиловая перегруппировка).
М еханизм:
еханизм:
