
- •Химическая связь и взаимное влияние атомов
- •1. Электронная теория связи. Формулы Льюиса
- •2. Электронное строение и типы гибридизации атома углерода
- •Атомные орбитали
- •sp3-Гибридизация
- •Атом Сsp3 :
- •sp2-Гибридизация
- •sp-Гибридизация
- •Ацетилен
- •Основные характеристики химической связи
- •3. Делокализованная связь. Сопряжение
- •p Сопряжение
- •Резонансные структуры
- •Свойства соединений с делокализованными связями
- •2.Повышенная термодинамическая устойчивость, которая определяется энергией сопряжения (ЭС)
- •4. Циклические сопряженные системы Ароматичность
- •Электронное строение бензола
- •Ароматические гетероциклические соединения
- •Избыточные гетероциклы
- •Электронное строение пиридина
- •Ароматические гетероциклы с несколькими гетероатомами
- •4. Электронные эффекты
- •• Индуктивный эффект (I-эффект ) – это передача влияния заместителя по цепи связей
- •Мезомерный эффект (М-эффект) – это передача влияния заметителя по системе сопряженных связей
- •Направление влияния замеcтителей в сопряженной системе
- •5. Водородная связь
- •Влияние на физические свойства
- •Учебник, 2005г:
Химическая связь и взаимное влияние атомов

1. Электронная теория связи. Формулы Льюиса
... .. . Тетрахлорметан
. .. .Cl..... .....
Cl. C .Cl
Cl..
Метил- |
Метил- |
Метил- |
Катион |
Диазометан |
радикал |
катион |
анион |
метилгидрок- |
|
|
|
|
сония |
|

2. Электронное строение и типы гибридизации атома углерода
С 1s22s22p2 |
C* 1s22s12p3 |
2s |
2p |
2s |
2p |
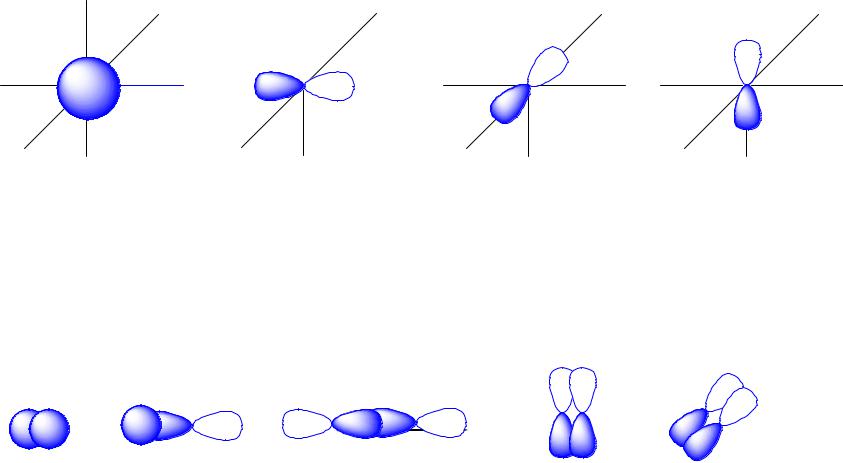
Атомные орбитали
z |
|
|
z |
|
z |
|
z |
|||
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
x |
x |
x |
x |
y |
y |
y |
y |
s-орбиталь |
px-орбиталь |
py-орбиталь |
pz-орбиталь |
Связи
Связи
s +s |
s + px |
px + px |
pz + pz |
py + py |

sp3-Гибридизация
s+px+py+pz 4(sp3)

Атом Сsp3 :
•образует 4 связи
•имеет 4 заместителя
•валентный угол 1090
•форма молекулы - тетраэдр
М е т а н

sp2-Гибридизация
(s + px +py ) + pz |
3(sp2) + pz |
Атом Сsp2 :
•образует 3 и 1 связь
•имеет 3 заместителя
•валентный угол 1200
•форма молекулы тригональная

Этилен СH2=CH2
Формальдегид
H
C O
O
H
Метил-катион H
CH
H
H C C H H 


 H
H
H C O H 



H 
H C H

sp-Гибридизация
(s + px) + py +pz |
2(sp) + py + pz |
Атом Сsp :
•образует 2 - и 2 -связи
•имеет 2 заместителя
•валентный угол 1800
•форма молекулы линейная

Ацетилен
HC≡CH
Аллен CH2=С=СН2








H C C H
|
|
|
|
|
|
H |
|
|
|
||
C |
|
|
H |
||
C |
C |
||||
|
|||||
H |
|
|
|
H |
