
- •1. Ферменты: определение понятия, химическая природа, физико-химические свойства и биологическая роль ферментов.
- •2. Изоферменты. Строение, биологическая роль, диагностическое значение определения, изменение в онтогенезе и при патологии органа, диагностическое значение.
- •5. Ингибирование активности ферментов, виды ингибирования: обратимое, необратимое, конкурентное, неконкурентное
- •6. Регуляция активности ферментов: неспецифическая, специфическая (понятия). Механизмы специфической регуляции активности ферментов
- •9. Энзимопатии: понятие, классификация, молекулярные причины возникновения и механизмы развития, последствия, биохимическая диагностика.
- •10. Энзимодиагностика: классификация ферментов клетки, крови в энзимодиагностике, диагностическое значение, применение в педиатрии
- •11. Биохимические основы энзимотерапии, применение ферментов в энзимотеравии (примеры)
- •12. Цикл Кребса - схема реакций, ферменты, коферменты, энергетический баланс одного оборота. Тканевые особенности в детском возрасте, Регуляция.
- •14. Механизмы сопряжения и разобщения дыхания и фосфорилирования, эндогенные и экзогенные разобщители.
- •15. Микросомальное биологическое окисление (система транспорта электронов, цитохромы р-450, в-5). Биологическое значение, регуляция, особенности активности ферментов в детском возрасте
- •21. Нормогликемия, пути превращения углеводов в клетках организма и ключевая роль глюкозо-б-фосфата.
- •23. Аэробный путь окисления глюкозы, тканевые особенности, энергетический баланс. Эффект Пастера, регуляция.
- •24. Катаболизм глюкозы по пентозофосфатному пути, биологическая роль. Регуляция значение пентозофосфатного пути в обеспечении метаболических процессов в организме человека
- •25. Гипогликемия: биохимические причины возникновения, механизмы восстановления нормогликемии, биохимические особенности детского возраста
- •26. Гипергликемия: биохимические причины возникновения, механизмы восстановления нормогликемии, биохимические особенности детского возраста
- •27. Контринсулярные гормоны (глюкагон, адреналин, кортизол): химическая природа, молекулярные механизмы участия в углеводном обмене.
- •29. Сахарный диабет инсулинзависимый (ИЗСД, I тип): биохимическая диагностика, механизмы развития метаболических нарушений (гипергликемия, холестеринемия, кетонемия, ацидоз, гликозилирование белков), биохимические особенности детского возраста
- •36. Липолиз триглицеридов в белой и бурой жировой ткани
- •37. Механизмы β - окисления жирных кислот. Регуляция
- •38. Пути обмена АцКоА. Кетоновые тела: биологическая роль, кетонемия, кетонурия, причины и механизмы развития, последствия, биохимические особенности детского возраста.
- •39. Обмен холестерина в организме человека. Регуляция синтеза холестерина
- •40. Атеросклероз: биохимические причины, факторы риска, лабораторная диагностика риска развития атеросклероза: обмена и развития его нарушений, гендерные особенности.
- •41. Роль белка в питании: состав и классификация пищевых белков, заменимые и незаменимые аминокислоты. Принципы нормирования белка в питании детей и взрослых. Азотистый баланс организма человека.
- •45. Причины токсичности аммиака и пути обезвреживания аммиака (образование глн, цикл мочевины, регуляция).
- •47. Регуляторные системы организма. Определение понятия – гормоны, принципы классификации гормонов.
- •48. Уровни и принципы организации нейро – эндокринной системы. Концепции обратной связи.
- •49. Рецепция и механизмы действия стероидных гормонов.
- •50. Рецепция и механизмы действия пептидных гормонов
- •55. Белки плазмы крови: классификация, диагностическое значение электрофореграмм.
- •57. Альбумины сыворотки крови: физико-химических свойства, функции, обмен
- •60. Гемоглобин: виды, строение, функции, обмен в норме. Метгемоглобинредуктазная система.
- •61. Биохимические функции почек, особенности метаболических процессов в почках.
- •63. Состав первичной и конечной мочи, физико – химические показатели в норме.
- •64. Химический состав мочи в норме и при патологии. Клиренс: понятие, виды.
- •65. Ренин-ангиотензин-альдостероновая система (РААС) в поддержании гомеостаза натрия. Механизм действия альдостерона на молекулярном уровне в почке и слюнных железах
- •66. Антидиуретический гормон и регуляция водного баланса организма.
- •67. Биохимические гомеостатические функции печени, биохимические особенности в детском возрасте.
- •68. Функциональные пробы и нагрузки характеризующие состояние углеводного, липидного, белкового обмена и детоксицирующей функции печени у детей. И взрослых.
- •70. Белки соединительной ткани коллаген и эластин: особенности аминокислотного состава и структурной организации молекул. Витамин С в синтезе коллагена.
- •74.Витамин Д – этапы образования активных форм, их метаболические функции, механизм действия. Роль печени, почек в обмене витамина Д, патохимические причины развития рахита, показатели кальций-фосфорного обмена при рахите на разных стадиях болезни.
- •75.Паратиреоидный гормон (ПГ) и кальцитонин (КГ) – химическая природа, стимулы секреции, механизмы действия в регуляции обмена кальция и ремоделирования костной ткани, проявления гипо- и гипертиреоза
- •76.Биохимические процессы в остеобластах и остеокластах в ремоделировании костной ткани.
- •77.Белковые и минеральные компоненты костной ткани
- •78.Биохимия нервной ткани: особенности химического состава, метаболических процессов, синтез нейромедиаторов.
- •80.Миокард: особенности метаболических процессов, метаболические нарушения при гипоксии, клиническая биохимическая энзимодиагностика при инфаркте миокарда
- •81.Биохимия лактации: физико – химические свойства, химический состав грудного молока, характеристика ферментов молока. Изменение химического состава в процессе лактации: виды женского молока
- •82.Биохимия лактации: биохимические механизмы образования органических компонентов молока в лактирующей железе, белок лактальбумин, роль гормонов (пролактин, окситоцин, плацентарного лактоген, эстрогены, СТГ, Т3, Т4, кортизол, инсулин)
- •83.Витамины: химическая природа, классификация по растворимости в воде и биохимическим механизмам действия. Провитамины и механизмы их активации (на примере провитаминов Д и А). Эндогенные и экзогенные причины гипо- , гипер- и авитаминозов
- •84.Витамины-коферменты РР, В2 участие в метаболических процессах, биохимические механизмы проявления гиповитаминозов
- •Симптомы гиповитаминоза
- •Симптомы гиповитаминоза
- •86.Витамины-коферменты В12, фолиевая кислота участие в метаболических процессах, биохимические проявления гиповитаминозов
- •87.Витамин С: участие в метаболических процессах, биохимические механизмы проявления гиповитаминозов
- •89.Буферные системы плазмы крови: гидрокарбонатная, фосфатная, белковая Гемоглобиновая буферная система эритроцитов, связь с гидрокарбонатной системой плазмы и эритроцита. Механизмы участия карбоангидразы в регуляции КОС.
- •90.Кислотно-основный гомеостаз: биологическое значение постоянства внутренней среды организма., механизмы поддержания КОС, особенности в детском возрасте.
- •91.Нарушения КОС - классификация по механизмам? Биохимические пути компенсации.
|
Непрямой |
Прямой |
Уробилин |
Прямой |
Уробилин |
|
билирубин |
билирубин |
билирубин |
||
|
|
|
|||
|
|
|
|
|
|
Гемолитическая |
↑↑↑ |
N |
↑ |
0 |
↑ |
|
|
|
|
|
|
Печеночная |
↑ |
↑ |
↓ |
↑ |
↓ |
|
|
|
|
|
|
Обтурационная |
↑ |
↑ |
↓,0 |
↑ |
↓,0 |
|
|
|
|
|
|
70. Белки соединительной ткани коллаген и эластин: особенности аминокислотного состава и структурной организации молекул. Витамин С в синтезе коллагена.
1. КОЛЛАГЕН
Коллаген — фибриллярный белок, основной структурный компонент межклеточного матрикса. Коллаген обладает огромной прочностью (Коллаген прочнее стальной проволоки того же сечения, он может выдерживать нагрузку в 10000 раз большую собственного веса) и практически не растяжим. Это самый распространенный белок организма, на него приходиться от 25 до 33% общего количества белка в организме, т.е. 6% массы тела. Около 50% всех коллагеновых белков содержится в тканях скелета, около 40% — в коже и 10% — в строме внутренних органов.
Строение коллагена
Под коллагеном понимают два вещества: тропоколлаген и проколлаген.
Молекула тропоколлагена состоит из 3 α-цепей. Известно около 30 видов α-цепей, отличающихся между собой аминокислотным составом. Большинство α-цепей содержит около 1000АК. В тропоколлагене содержится 33% глицина, 25% пролина и 4- оксипролина, 11% аланина, есть гидроксилизин, мало гистидина, метионина и тирозина, нет цистеина и триптофана.
Первичная структура α-цепей состоит из повторяющейся аминокислотной последовательности: Глицин-X-Y. В X положении чаще всего находиться пролин, а в Y – 4-оксипролин или 5-оксилизин.
Пространственная структура α-цепи представлена левозакрученной спиралью в витке которой находиться 3 АК.
3 α-цепи скручиваются друг с другом в правозакрученную суперспираль тропоколлагена. Она стабилизируется водородными связями, радикалы АК направлены наружу.
Молекула проколлагена устроена также как и тропоколлагена, но на ее концах находятся С- и N-пропептиды, образующие глобулы. N-концевой пропептид состоит из 100АК, С-концевой пропептид – из 250АК. С- и N-Протеопептиды содержат цистеин, который через дисульфидные мостики образует глобулярную структуру.
Виды коллагена
Коллаген — полиморфный белок, в настоящее время известно 19 типов коллагена, которые отличаются друг от друга по первичной структуре пептидных цепей, функциям и локализации в организме. 95% всего коллагена в организме человека составляют коллагены I, II и III типов.
228
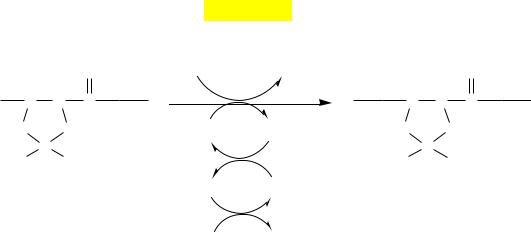
Гены коллагена называются по типам коллагена и записываются арабскими цифрами, например СОL1 — ген коллагена 1 типа, COL2 — ген коллагена II типа и т.д. К этому символу приписываются буква А (обозначает α-цепь) и арабская цифра (обозначает вид α-цепи). Например, COL1A1 и COL1A2 кодируют, соответственно, α1, и α2-цепи коллагена I типа.
Этапы синтеза и созревания коллагена
Синтез и созревание коллагена — сложный многоэтапный процесс, начинающийся в клетке, а завершающийся в межклеточном матриксе:
1.На полисомах ЭПР синтезируются полипептидные препро-α-цепи коллагена. Они содержит начиная с N-конца: 1). гидрофобный «сигнальный» пептид, содержащий около 100 АК; 2). N-концевой пропептид, содержащий около 100 АК, в том числе цистеин; 3). α-цепь коллагена 4). С-концевой пропептид, содержащий около 250 АК, в том числе цистеин. Концевые С- и N-пропептиды формируют глобулярные домены и необходимы для правильного формирования тройной спирали. «Сигнальный» пептид, обеспечивает поступление синтезируемой на рибосоме препро-α-цепи в полость ЭПР.
2.В полости ЭПР при отщеплении сигнального пептида препро-α-цепи коллагена превращаются в про-α-цепи.
3.Поступающие в полости ЭПР про-α-цепи коллагена подвергаются модификации.
а). Цистеины N-пропептидов образуют внутрицепочечные дисульфидные мостики, формируя на N-конце глобулярную структуру;
б). Пролины и лизины в Y-положении (гли-х-у) про-α-цепей гидроксилируются
пролил-4-гидроксилазой и лизил-5-гидроксилазой в 4-гидроксипролины
(Hyp) и 5-гидроксилизины (Hyl). Некоторые пролины в Х-положениях гидроксилируются в 3-гидроксипролины пролил-3-гидроксилазой. Оксигеназы (гидроксилазы), содержат Fe2+, находятся на мембране ЭПР. Для реакции необходимы а-КГ, О2 и витамин С:
|
|
|
ï ðî ëè ë-4-ãè äðî êñè ëàçà |
|
|
|
|
|
||
|
|
O |
à-ÊÃ + Î |
2 |
сукцин ат + СО |
2 |
|
|
|
O |
|
|
|
|
|
|
|
||||
N |
H |
C |
|
|
|
|
N |
H |
|
C |
C |
|
|
|
|
C |
|
||||
H C |
CH |
|
|
2+ |
3+ |
|
H C |
CH |
|
|
2 |
|
Fe |
|
2 |
||||||
2 |
|
Fe |
|
|
2 |
|
|
|||
|
C |
|
|
|
|
|
|
C |
|
|
H |
H |
|
|
|
|
|
H |
|
OH |
|
ï ðî ëèë |
|
àñêî ðáàò |
дегидро аско рбат |
4-î êñèï ðî ëèë |
||||||
|
|
|
|
|
|
|
||||
|
|
|
2G-SH |
G-S-S-G |
|
|
|
|
|
|
Гидроксилирование пролина необходимо для стабилизации тройной спирали коллагена, ОН-группы гидроксипролина участвуют в образовании водородных связей.
229
Гидроксилирование лизина необходимо для последующего образования ковалентных связей между молекулами коллагена при сборке коллагеновых фибрилл.
в). Гидроксилизин про-α-цепей при участии гликозилтрансфераз гликозилируется галактозой или галактозилглюкозой. В молекуле коллагена сухожилий (тип I) количество углеводов равно 6, а в моллекуле коллагена капсулы хрусталика (тип TV) — 110. Роль этих углеводных групп неясна.
4). В просвете ЭПР после отделения от рибосом про-α-цепей, 3 из них с помощью С- концевых пропептидов соединяются между собой дисульфидными мостиками (цистеины С-пропептидов образуют внутри- и межцепочечные дисульфидные мостики) и скручиваются с образованием тройной спирали проколлагена. Тройная спираль проколлагена стабилизируется водородными связями. После этого гидроксилирование и гликозилирование про-α-цепей прекращается.
5). Из ЭПР молекулы проколлагена перемещаются в аппарат Гольджи, включаются в секреторные пузырьки и секретируются в межклеточное пространство.
6). В межклеточном матриксе от некоторых проколлагенов (I, II, III, V, XI типов) проколлагенпептидазы отщепляют концевые С- и N-пропептиды, в результате чего образуется тропоколлагены. У проколлагенов IV, VIII, X типов концевые пропептиды не отщепляются.
Химический состав межклеточного матрикса
В состав межклеточного матрикса входят: 1). Коллагеновые и эластиновые волокна. Они придают ткани механическую прочность, препятствуя ее растяжению; 2). аморфное вещество в виде ГАГ и протеогликанов. Оно удерживает воду и минеральные вещества, препятствует сдавливанию ткани; 3). неколлагеновые структурные белки - фибронектин, ламинин, тенасцин, остеонектин и др. Кроме того, в межклеточном матриксе может присутствовать минеральный компонент - в костях и зубах: гидроксиапатит, фосфаты кальция, магния и т.д. Он придает механическую прочность костям, зубам, создает запас в организме кальция, магния, натрия, фосфора.
Функция межклеточного матрикса
Межклеточный матрикс выполняет в организме разнообразные функции:
образует каркас органов и тканей;
является универсальным «биологическим» клеем;
участвует в регуляции водно-солевого обмена;
образует высокоспециализированные структуры (кости, зубы, хрящи, сухожилия, базальные мембраны).
окружая клетки, влияет на их прикрепление, развитие, пролиферацию, организацию и метаболизм.
Эластин — основной белок эластических волокон, которые в больших количествах содержатся в межклеточном веществе кожи, стенок кровеносных сосудов, связках, лёгких. Эти ткани могут растягиваться в несколько раз по сравнению с исходной длиной, сохраняя при этом высокую прочность на разрыв.
230
Строение эластина
Эластин — гликопротеин с молекулярной массой 70 кДа.
Первичная структура эластина образована полипептидной цепью из 800 АК, в которой преобладают глицин, валин, аланин, содержится много пролина и лизина, немного гидроксипролина, отсутствует гидроксилизин.
Большое количество гидрофобных радикалов препятствует созданию регулярной вторичной и третичной структуры эластина, поэтому он приобретает различные конформации.
В межклеточном пространстве молекулы эластина образуют волокна и слои, в которых отдельные пептидные цепи связаны множеством жёстких поперечных сшивок в разветвлённую сеть. Сшивки между остатками лизина двух, трёх или четырёх пептидных цепей, образуют специфические структуры, которые называются десмозинами (десмозин или изодесмозин).
|
|
|
|
H |
H |
|
|
O |
|
|
|
|
|
|
|
|
N |
C |
|
|
C |
|
|
|
|
|
|
|
|
|
(CH |
) |
3 |
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
NH |
|
|
|
|
|
|
|
|
|
|
|
NH |
|
H |
H |
|
|
|
H |
H |
2 |
|
|||
CH |
C |
2 |
C |
2 |
|
|
|
C |
2 |
C |
CH |
|
|
|
|
|
|
|
|
||||||
CO |
|
|
|
|
|
|
|
|
|
|
|
CO |
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
(CH |
) |
4 |
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
O |
|
|
|
|
|
|
|
|
N |
CH |
|
|
C |
|
|
|
|
|
|
|
|
Äåñì |
î çèí |
|
|
|
|
|||
Десмозины образуются следующим образом: вначале 3 остатка лизина окисляются до альдегидов, а затем происходит их соединение с четвёртым остатком лизина с образованием замещённого пиридинового кольца.
Окисление остатков лизина в альдегиды осуществляется лизилоксидазой (РР, В6, Cu2+).
Кроме десмозинов, в образовании поперечных сшивок может участвовать лизиннорлейцин, который образуется двумя остатками лизина.
Наличие ковалентных сшивок между пептидными цепочками с неупорядоченной, случайной конформацией позволяет всей сети волокон эластина растягиваться и сжиматься в разных направлениях, придавая соответствующим тканям свойство эластичности.
Синтез эластина
Эластин синтезируется фибробластами в виде растворимого мономера - «тропоэластина». В межклеточном пространстве после образования поперечных сшивок эластин приобретает свою конечную внеклеточную форму, которая характеризуется нерастворимостью, высокой стабильностью и очень низкой скоростью обмена.
Нарушения структуры эластина и их последствия
Снижение активности лизилоксидазы, вызванное дефицитом меди, пиридоксина или дефицит лизилоксидазы, связанный с генетическим дефектом, приводит к снижению или прекращению образования десмозинов. В результате поперечных сшивок нет или их
231
недостаточное количество. При этом, у эластических тканей снижается предел прочности на разрыв, появляются такие нарушения, как истончённость, вялость и растяжимость. Клинически эти нарушения могут проявляться кардиоваскулярными изменениями (аневризмы и разрывы аорты, дефекты клапанов сердца), частыми пневмониями и эмфиземой лёгких.
Катаболизм эластина
Катаболизм эластина происходит при участии эластазы нейтрофилов. Это очень активная протеаза, которая выделяется во внеклеточное пространство нейтрофилами и разрушает эластин и другие структурные белки. Особое значение это имеет в лёгких, поскольку лёгочная ткань не регенерирует. Разрушение эластина в альвеолярных стенках ведёт к потере эластичных свойств, разрушению альвеол и развитию эмфиземы лёгких.
В норме эластазу нейтрофилов и другие протеазы ингибирует α1-антитрипсин. Основное количество α1-антитрипсина синтезируется печенью и находится в крови. В лёгких α1-антитрипсин синтезируется альвеолярными макрофагами, что и обеспечивает защиту альвеол от действия эластазы. При дефиците α1-антитрипсина, который может
быть следствием различных мутаций, повышается риск развития эмфиземы лёгких.
71. Межклеточное вещество соединительной ткани. Надмолекулярные (супрамолекулярные) структуры:
протеогликановые комплексы, состав, строение.
МЕЖКЛЕТОЧНЫЙ МАТРИКС
Межклеточный матрикс — это надмолекулярный комплекс, образованный сложной сетью связанных между собой макромолекул.
В организме межклеточный матрикс формирует такие высокоспециализированные структуры, как хрящ, сухожилия, базальные мембраны, а также (при вторичном отложении фосфата кальция) кости и зубы. Эти структуры различаются между собой как по молекулярному составу, так и по способам организации основных компонентов (белков и полисахаридов) в различных формах межклеточного матрикса.
Химический состав межклеточного матрикса
В состав межклеточного матрикса входят: 1). Коллагеновые и эластиновые волокна. Они придают ткани механическую прочность, препятствуя ее растяжению; 2). аморфное вещество в виде ГАГ и протеогликанов. Оно удерживает воду и минеральные вещества, препятствует сдавливанию ткани; 3). неколлагеновые структурные белки - фибронектин, ламинин, тенасцин, остеонектин и др. Кроме того, в межклеточном матриксе может присутствовать минеральный компонент - в костях и зубах: гидроксиапатит, фосфаты кальция, магния и т.д. Он придает механическую прочность костям, зубам, создает запас в организме кальция, магния, натрия, фосфора.
Функция межклеточного матрикса
232
Межклеточный матрикс выполняет в организме разнообразные функции:
образует каркас органов и тканей;
является универсальным «биологическим» клеем;
участвует в регуляции водно-солевого обмена;
образует высокоспециализированные структуры (кости, зубы, хрящи, сухожилия, базальные мембраны).
окружая клетки, влияет на их прикрепление, развитие, пролиферацию, организацию и метаболизм.
Строение и виды протеогликанов
В межклеточном матриксе присутствуют разные протеогликаны. Среди них есть очень крупные — например агрекан и версикан, и малые протеогликаны - декорин, бигликан, фибромодулин, люмикан, перлекан.
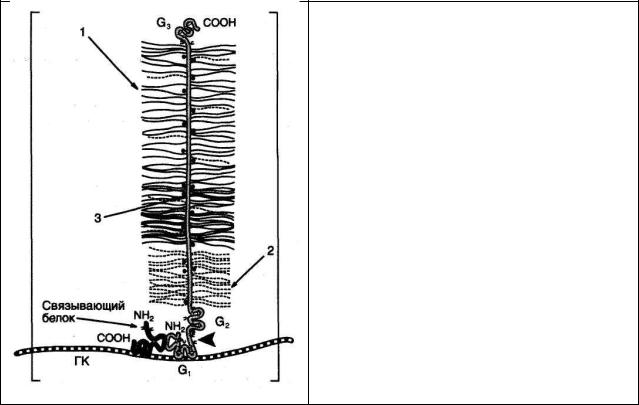
Агрекан составляет 10% по весу исходной ткани и 25% сухого веса хрящевого матрикса. Это очень большая молекула, в которой к одной полипептидной цепи присоединены до 100 цепей хондроитинсульфатов и около 30 цепей кератансульфатов. По форме молекула агрекана напоминает бутылочный «ёршик».
В хрящевой ткани молекулы агрекана собираются в агрегаты с гиалуроновой кислотой и небольшим связывающим белком.
Строение агрекана
ГК — гиалуроновая кислота;
1 — хондроитинсульфат;
2 — кератансульфат;
3 — сердцевинный белок, молекулярная масса 220 кДа, имеющий три глобулярных домена: G1, G2, G3, выполняющих разные функции. G1, обеспечивает связывание агрекана с гиалуроновой кислотой и низкомолекулярным связывающим белком. G3 обеспечивает присоединение агрекана к другим молекулам межклеточного матрикса, участвует в межклеточных взаимодействиях.
Между доменами G2 и G3 присоединяются кератансульфаты и хондроитинсульфаты.
Конечный агрегат с молекулярной массой более 200х106 Да состоит из 1 гиалуроновой кислоты и 100 молекул агрекана и 100 молекул связывающего белка.
Агрекан и связывающий белок продуцируются хондроцитами, хондроциты также осуществляют координацию сборки этих агрегатов.
233
Созревание функционально активного тройного комплекса составляет около 24 ч.
72. Кальций/фосфорный обмен. Баланс и метаболические функции ионов кальция, фосфата в биологических
процессах в организме.
Функции кальция в организме:
1.Неорганический компонент костей и зубов (гидроксиаппатит);
2.Внутриклеточный посредник ряда гормонов (инозитолтрифосфатная система);
3.Участвует в генерации потенциалов действия в нервах и мышцах;
4.Участвует в свертывании крови;
5.Запускает мышечное сокращение, фагоцитоз, секрецию гормонов, нейромедиаторов и т.д.;
6.Участвует в митозе, апоптозе и некробиозе;
7.Увеличивает проницаемость мембраны клеток для ионов калия, влияет на натриевую проводимость клеток, на работу ионных насосов;
8.Кофермент некоторых ферментов;
Функции фосфата в организме:
1.Неорганический компонент костей и зубов (гидроксиаппатит);
2.Входит в состав липидов (фосфолипиды, сфинголипиды);
3.Входит в состав нуклеотидов (ДНК, РНК, АТФ, ГТФ, ФМН, НАД, НАДФ и т.д.);
4.Обеспечивает энергетический обмен т.к. образует макроэргические связи (АТФ, креатинфосфат);
5.Входит в состав белков (фосфопротеины);
6.Входит в состав углеводов (глюкозо-6ф, фруктозо-6ф и т.д.);
7.Регулирует активность ферментов (реакции фосфорилирования / дефосфорилирования ферментов, входит в состав инозитолтрифосфата – компонента инозитолтрифосфатной системы);
8.Участвует в катаболизме веществ (реакция фосфоролиза);
9.Регулирует КОС т.к. образует фосфатный буфер. Нейтрализует и выводит протоны с мочой.
Увзрослого человека содержится в среднем 1000г кальция:
1.Кости и зубы содержат 99% кальция. В костях 99% кальция находится в виде малорастворимого гидроксиапатита [Са10(РО4)6(ОН)2Н2О], а 1% - в виде растворимых фосфатов;
2.Внеклеточная жидкость 1%. Кальций плазмы крови представлен в виде: а). свободных ионов Са2+ (около 50%); б). ионов Са2+ соединённых с белками, главным образом, с альбумином (45%); в) недиссоциирующих комплексов кальция с цитратом, сульфатом, фосфатом и карбонатом (5%). В плазме крови концентрация общего кальция составляет 2, 2—2,75 ммоль/л, а ионизированного - 1,0-1,15 ммоль/л;
3.Внутриклеточная жидкость содержит кальция в 10000-100000 раз меньше чем внеклеточной жидкости.
Во взрослом организме содержится в около 1кг фосфора:
1. Кости и зубы содержат 85% фосфора;
234
2.Внеклеточная жидкость – 1% фосфора. В сыворотке крови концентрация неорганического фосфора – 0,81-1,55 ммоль/л, фосфора фосфолипидов 1,5-2г/л;
3.Внутриклеточная жидкость – 14% фосфора.
Обмен кальция и фосфатов в организме
С пищей в сутки должно поступать кальция - 0,7-0,8г, магния - 0,22-0,26г, фосфора – 0,7-0,8г. Кальций всасывается плохо на 30-50%, фосфор хорошо – на 90%.
Помимо ЖКТ, кальций, магний и фосфор поступают в плазму крови из костной ткани, в процессе ее резорбции. Обмен между плазмой крови и костной тканью по кальцию составляет 0,25-0,5г/сут, по фосфору – 0,15-0,3г/сут.
Выводится кальций, магний и фосфор из организма через почки с мочой, через ЖКТ с калом и через кожу с потом.
Регуляция обмена
Основными регуляторами обмена кальция, и фосфора являются паратгормон, кальцитриол и кальцитонин.
Паратгормон
Паратгормон (ПТГ) — полипептид, из 84 АК (около 9,5 кД), синтезируется в паращитовидных железах.
Секрецию паратгормона стимулирует низкая концентрация Са2+, Mg2+ и |
высокая |
концентрация фосфатов, ингибирует витамин Д3. |
|
Скорость распада гормона уменьшается при низкой концентрации Са2+ и увеличивается, если концентрация Са2+ высока.
Паратгормон действует на кости и почки. Он стимулирует секрецию остеобластами
инсулиноподобного фактора роста 1 и цитокинов, которые повышают метаболическую активность остеокластов. В остеокластах ускоряется образование щелочной фосфатазы и коллагеназы, которые вызывают распад костного матрикса, в результате чего происходит мобилизация Са2+ и фосфатов из кости во внеклеточную жидкость.
Впочках паратгормон стимулирует реабсорбцию Са2+, Mg2+ в дистальных извитых канальцах
иуменьшает реабсорбцию фосфатов.
Паратгормон индуцирует синтез кальцитриола (1,25(OH)2D3).
В результате паратгормон в плазме крови повышает концентрацию Са2+ и Mg2+, и снижает концентрацию фосфатов.
Гиперпаратиреоз
При первичном гиперпаратиреозе (1:1000) нарушается механизм подавления секреции паратгормона в ответ на гиперкальциемию. Причинами могут быть опухоль (80%), диффузная гиперплазия или рак (менее 2%) паращитовидной железы.
Гиперпаратиреоз вызывает:
1.разрушение костей, при мобилизации из них кальция и фосфатов. Увеличивается риск переломов позвоночника, бедренных костей и костей предплечья;
2.гиперкальциемию, при усилении реабсорбции кальция в почках. Гиперкальциемия приводить к снижению нервно-мышечной возбудимости и мышечной гипотонии. У
235
больных появляются общая и мышечная слабость, быстрая утомляемость и боли в отдельных группах мышц;
3.образования в почках камней при увеличение концентрации фосфата и Са2+ в почечных канальцах;
4.гиперфосфатурию и гипофосфатемию, при снижении реабсорбции фосфатов в
почках; Вторичный гиперпаратиреоз возникает при хронической почечной недостаточности и
дефиците витамина D3.
При почечной недостаточности угнетается образование кальцитриола, что нарушает всасывание кальция в кишечнике и приводит к гипокальциемии. Гиперпаратиреоз возникает в ответ на гипокальциемию, но паратгормон не способен нормализовать уровень кальция в плазме крови. Иногда возникает гиперфостатемия. В следствие повышения мобилизации кальция из костной ткани развивается остеопороз.
Гипопаратиреоз
Гипопаратиреоз обусловлен недостаточностью паращитовидных желёз и сопровождается гипокальциемией. Гипокальциемия вызывает повышение нервно-мышечной проводимости, приступы тонических судорог, судороги дыхательных мышц и диафрагмы, ларингоспазм.
Кальцитриол
1.В коже под влиянием УФ-излучения из 7-дегидрохолестерола образуется большая часть холекальциферола (витамина Д3). Небольшое количество витамина Д3 поступает с пищей. Холекальциферол связывается со специфическим витамин Д-связывающим белком (транскальциферином), поступает в кровь и переносится в печень.
2.В печени 25-гидроксилаза гидроксилирует холекальциферол в кальцидиол (25гидроксихолекальциферол, 25(OH)Д3). D-связывающий белок транспортирует кальцидиол в почки.
3.В почках митохондриальная 1α-гидроксилаза гидроксилирует кальцидиол в кальцитриол (1,25(OH)2Д3), активную форму витамина Д3. Индуцирует 1α-гидроксилазу паратгормон.
Синтез кальцитриола стимулирует паратгормон, низкая концентрация фосфатов и Са2+ (через паратгормон) в крови.
Синтез кальцитриола ингибирует гиперкальциемия, она активирует 24α-гидроксилазу, которая превращает кальцидиол в неактивный метаболит 24,25(OH)2Д3, при этом соответственно активный кальцитриол не образуется.
Кальцитриол воздействует на тонкий кишечник, почки и кости.
Кальцитриол:
1.в клетках кишечника индуцирует синтез Са2+-переносящих белков, которые обеспечивают всасывание Са2+, Mg2+ и фосфатов;
2.в дистальных канальцах почек стимулирует реабсорбцию Са2+, Mg2+ и фосфатов;
3.при низком уровне Са2+ увеличивает количество и активность остеокластов, что стимулирует остеолиз;
4.при низком уровне паратгормона, стимулирует остеогенез.
В результате кальцитриол повышает в плазме крови концентрацию Са2+, Mg2+ и фосфатов.
При дефиците кальцитриола нарушается образование аморфного фосфата кальция и кристаллов гидроксиапатитов в костной ткани, что приводит к развитию рахита и остеомаляции.
236
