
- •1. Ферменты: определение понятия, химическая природа, физико-химические свойства и биологическая роль ферментов.
- •2. Изоферменты. Строение, биологическая роль, диагностическое значение определения, изменение в онтогенезе и при патологии органа, диагностическое значение.
- •5. Ингибирование активности ферментов, виды ингибирования: обратимое, необратимое, конкурентное, неконкурентное
- •6. Регуляция активности ферментов: неспецифическая, специфическая (понятия). Механизмы специфической регуляции активности ферментов
- •9. Энзимопатии: понятие, классификация, молекулярные причины возникновения и механизмы развития, последствия, биохимическая диагностика.
- •10. Энзимодиагностика: классификация ферментов клетки, крови в энзимодиагностике, диагностическое значение, применение в педиатрии
- •11. Биохимические основы энзимотерапии, применение ферментов в энзимотеравии (примеры)
- •12. Цикл Кребса - схема реакций, ферменты, коферменты, энергетический баланс одного оборота. Тканевые особенности в детском возрасте, Регуляция.
- •14. Механизмы сопряжения и разобщения дыхания и фосфорилирования, эндогенные и экзогенные разобщители.
- •15. Микросомальное биологическое окисление (система транспорта электронов, цитохромы р-450, в-5). Биологическое значение, регуляция, особенности активности ферментов в детском возрасте
- •21. Нормогликемия, пути превращения углеводов в клетках организма и ключевая роль глюкозо-б-фосфата.
- •23. Аэробный путь окисления глюкозы, тканевые особенности, энергетический баланс. Эффект Пастера, регуляция.
- •24. Катаболизм глюкозы по пентозофосфатному пути, биологическая роль. Регуляция значение пентозофосфатного пути в обеспечении метаболических процессов в организме человека
- •25. Гипогликемия: биохимические причины возникновения, механизмы восстановления нормогликемии, биохимические особенности детского возраста
- •26. Гипергликемия: биохимические причины возникновения, механизмы восстановления нормогликемии, биохимические особенности детского возраста
- •27. Контринсулярные гормоны (глюкагон, адреналин, кортизол): химическая природа, молекулярные механизмы участия в углеводном обмене.
- •29. Сахарный диабет инсулинзависимый (ИЗСД, I тип): биохимическая диагностика, механизмы развития метаболических нарушений (гипергликемия, холестеринемия, кетонемия, ацидоз, гликозилирование белков), биохимические особенности детского возраста
- •36. Липолиз триглицеридов в белой и бурой жировой ткани
- •37. Механизмы β - окисления жирных кислот. Регуляция
- •38. Пути обмена АцКоА. Кетоновые тела: биологическая роль, кетонемия, кетонурия, причины и механизмы развития, последствия, биохимические особенности детского возраста.
- •39. Обмен холестерина в организме человека. Регуляция синтеза холестерина
- •40. Атеросклероз: биохимические причины, факторы риска, лабораторная диагностика риска развития атеросклероза: обмена и развития его нарушений, гендерные особенности.
- •41. Роль белка в питании: состав и классификация пищевых белков, заменимые и незаменимые аминокислоты. Принципы нормирования белка в питании детей и взрослых. Азотистый баланс организма человека.
- •45. Причины токсичности аммиака и пути обезвреживания аммиака (образование глн, цикл мочевины, регуляция).
- •47. Регуляторные системы организма. Определение понятия – гормоны, принципы классификации гормонов.
- •48. Уровни и принципы организации нейро – эндокринной системы. Концепции обратной связи.
- •49. Рецепция и механизмы действия стероидных гормонов.
- •50. Рецепция и механизмы действия пептидных гормонов
- •55. Белки плазмы крови: классификация, диагностическое значение электрофореграмм.
- •57. Альбумины сыворотки крови: физико-химических свойства, функции, обмен
- •60. Гемоглобин: виды, строение, функции, обмен в норме. Метгемоглобинредуктазная система.
- •61. Биохимические функции почек, особенности метаболических процессов в почках.
- •63. Состав первичной и конечной мочи, физико – химические показатели в норме.
- •64. Химический состав мочи в норме и при патологии. Клиренс: понятие, виды.
- •65. Ренин-ангиотензин-альдостероновая система (РААС) в поддержании гомеостаза натрия. Механизм действия альдостерона на молекулярном уровне в почке и слюнных железах
- •66. Антидиуретический гормон и регуляция водного баланса организма.
- •67. Биохимические гомеостатические функции печени, биохимические особенности в детском возрасте.
- •68. Функциональные пробы и нагрузки характеризующие состояние углеводного, липидного, белкового обмена и детоксицирующей функции печени у детей. И взрослых.
- •70. Белки соединительной ткани коллаген и эластин: особенности аминокислотного состава и структурной организации молекул. Витамин С в синтезе коллагена.
- •74.Витамин Д – этапы образования активных форм, их метаболические функции, механизм действия. Роль печени, почек в обмене витамина Д, патохимические причины развития рахита, показатели кальций-фосфорного обмена при рахите на разных стадиях болезни.
- •75.Паратиреоидный гормон (ПГ) и кальцитонин (КГ) – химическая природа, стимулы секреции, механизмы действия в регуляции обмена кальция и ремоделирования костной ткани, проявления гипо- и гипертиреоза
- •76.Биохимические процессы в остеобластах и остеокластах в ремоделировании костной ткани.
- •77.Белковые и минеральные компоненты костной ткани
- •78.Биохимия нервной ткани: особенности химического состава, метаболических процессов, синтез нейромедиаторов.
- •80.Миокард: особенности метаболических процессов, метаболические нарушения при гипоксии, клиническая биохимическая энзимодиагностика при инфаркте миокарда
- •81.Биохимия лактации: физико – химические свойства, химический состав грудного молока, характеристика ферментов молока. Изменение химического состава в процессе лактации: виды женского молока
- •82.Биохимия лактации: биохимические механизмы образования органических компонентов молока в лактирующей железе, белок лактальбумин, роль гормонов (пролактин, окситоцин, плацентарного лактоген, эстрогены, СТГ, Т3, Т4, кортизол, инсулин)
- •83.Витамины: химическая природа, классификация по растворимости в воде и биохимическим механизмам действия. Провитамины и механизмы их активации (на примере провитаминов Д и А). Эндогенные и экзогенные причины гипо- , гипер- и авитаминозов
- •84.Витамины-коферменты РР, В2 участие в метаболических процессах, биохимические механизмы проявления гиповитаминозов
- •Симптомы гиповитаминоза
- •Симптомы гиповитаминоза
- •86.Витамины-коферменты В12, фолиевая кислота участие в метаболических процессах, биохимические проявления гиповитаминозов
- •87.Витамин С: участие в метаболических процессах, биохимические механизмы проявления гиповитаминозов
- •89.Буферные системы плазмы крови: гидрокарбонатная, фосфатная, белковая Гемоглобиновая буферная система эритроцитов, связь с гидрокарбонатной системой плазмы и эритроцита. Механизмы участия карбоангидразы в регуляции КОС.
- •90.Кислотно-основный гомеостаз: биологическое значение постоянства внутренней среды организма., механизмы поддержания КОС, особенности в детском возрасте.
- •91.Нарушения КОС - классификация по механизмам? Биохимические пути компенсации.
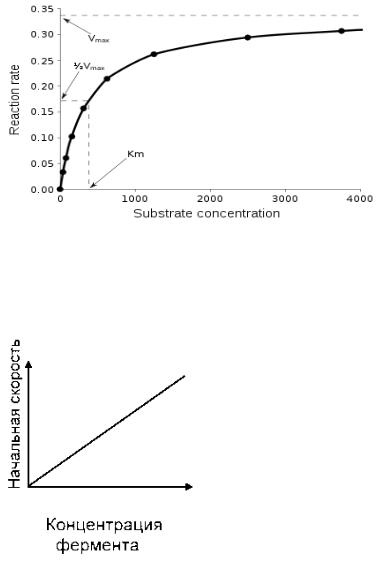
Скорость повышается до полного насыщения фермента субстратом. Далее скорость не увеичивается.
Концентрации энзима:
5. Ингибирование активности ферментов, виды ингибирования: обратимое, необратимое, конкурентное, неконкурентное
Ингибирование активности ферментов – снижение каталитической активности в присутствии определенных веществ – ингибиторов.
Виды ингибирования:
1)Обратимое:
a)Конкурентное
b)Неконкурентное
2)Необратимое
Обратимое ингибирование:
Обратимые ингибиторы связываются с ферментом слабыми нековалентными связями и могут легко отделяться от него.
5
Конкурентное: ингибитор связывается с активным центром фермента и препятствует образованию фермент-субстратного комплекса. Пример: малоновая кислота ингибирует сукцинатдегидрогеназную реакцию, являясь структурным аналогом сукцината. Конкурентные ингибиторы используют как лекарственные средства.
Неконкурентное: ингибитор взаимодействует с ферментом в участке, отличном от активного центра. Образует неактивный комплекс, связываясь с ферментом или фермент-субстратным комплексом.
Необратимое ингибирование:
Образование ковалентных стабильных связей между молекулой ингибитора и фермента. Чаще всего изменяется активный центр фермента. Примеры: ионы тяжелых металлов. Имеются специфичные и неспецифичные ингибиторы. Используются как лекарственные вещества.
6. Регуляция активности ферментов: неспецифическая, специфическая (понятия). Механизмы специфической регуляции активности ферментов
Регуляция активности ферментов:
Неспецифическая:
a)Изменением доступности субстрата и коферментов.
b)Изменением количества молекул субстрата.
c)Изменением каталитической активности ферментов.
i)Аллостерическая регуляция: регуляция происходит количеством не только молекул субстрата, но и эффекторов. Эффекторы – клеточные метаболиты, чаще всего, того пути, регуляцию которого они осуществляют.
ii)Регуляция с помощью белок-белковых взаимодействий: регуляция путем присоединения регуляторных белков (пример: аденилатциклазная система); изменение каталитической активности ферментов вследствие ассоциации и диссоциации протомеров фермента (присоединение остатка фосфорной кислоты с АТФ на белок).
iii)Регуляция путем фосфорилирования/дефосфорилирования молекулы фермента (к ОН-группе).
6
iv)Регуляция частичным (ограниченным) протеолизом: отщепление части молекулы неактивного предшественника.
Специфическая:
a)Обратимое ингибирование: Обратимые ингибиторы связываются с ферментом слабыми нековалентными связями и могут легко отделяться от него.
i)Конкурентное: ингибитор связывается с активным центром фермента и препятствует образованию фермент-субстратного комплекса. Пример: малоновая кислота ингибирует сукцинатдегидрогеназную реакцию, являясь структурным аналогом сукцината. Конкурентные ингибиторы используют как лекарственные средства.
ii)Неконкурентное: ингибитор взаимодействует с ферментом в участке, отличном от активного центра. Образует неактивный комплекс, связываясь с ферментом или фермент-субстратным комплексом.
b)Необратимое ингибирование: Образование ковалентных стабильных связей между молекулой ингибитора и фермента. Чаще всего изменяется активный центр фермента. Примеры: ионы тяжелых металлов. Имеются специфичные и неспецифичные ингибиторы. Используются как лекарственные вещества.
7.Роль гормонов и вторичных мессенджеров (цАМФ, цГМФ,
Са2+, ДГ, ИТФ, ПГ) в регуляции активности ферментов.
Гормоны – сигнальные молекулы беспроводного системного действия, влияющие на активность и количество ферментов в клетке через каскадные системы (аденилатциклазную, гуанилатциклазную,инозитолтри-фосфатную, RAS и т.д.).
Мессенджеры – низкомолекулярные вещества, переносящие сигналы гормонов внутри клетки (Са2+, цАМФ, цГМФ, ДАГ, ИТФ).
Роль мессенджеров в регуляции активности ферментов: цАМФ участвует в мобилизации энергетических запасов (распад углеводов в печени или триглицеридов в жировых клетках), в задержке воды почками, в нормализации кальциевого обмена, в увеличении силы и частоты сердечных сокращений, в образовании стероидных гормонов, в расслаблении гладких
7
мышц и так далее. цГМФ активирует ПК G, ФДЭ, Са2+-АТФазы, закрывает Са2+- каналы и снижает уровень Са2+ в цитоплазме.
Роль гормонов в регуляции активности ферментов: Гормоны влияют на активность и количество ферментов в клетке через каскадные системы, состоящие из:
1)Рецепторов
2)Регуляторных белков
3)Вторичных посредников
4)Ферментов
Может быть нужно будет зарисовать одну из гормональных систем.
8.Классификация и номенклатура ферментов: систематические
ирабочие названия, коферменты (по классами специфичности –
типу реакции)
Классификация ферментов:
1) Оксидоредуктазы.
Катализируют окислительно-восстановительные реакции. В реакцию вступают 2 вещества и 2 образуются, одно окисляется, другое восстанавливается: Sвост + S’окисл ↔ S’вост + Sокисл
a.дегидрогеназы (отщепляют Н от субстратов)
b.оксидазы (переносят Н с субстрата на кислород),
c.оксигеназы (включают кислород в молекулу субстрата)
d.гидроксипероксидазы (разрушают перекиси водорода и органические перекиси).
Систематическое название: донор: акцептор – оксидоредуктаза
Тривиальное название: донордегидрогеназа.
Шифр: КФ 1.1.1.1
Пример: Пируват + НАДН2 ↔ лактат + НАД+
Систематическое название: Лактат: НАД+ оксидоредуктаза Тривиальное название: ЛДГ. Шифр: КФ 1.1.1.1
2) Трансферазы
8
Принимают участие в переносе атомных групп, молекулярных остатков от одного соединения к другому. В реакцию вступают 2 вещества и 2
образуются: S-G + S’ ↔ S + S’-G.
a.фосфотрансферазы (киназы)
b.аминотрансферазы
c.гликозилтрансферазы
d.метилтрансферазы
e.ацилтрансферазы.
Систематическое название: откуда: куда - в какое положение–что– трансфераза или донор: акцептор–транспортируемая группа–
трансфераза
Тривиальное название: кудакиназа
Шифр: 2.1.1.1
Пример: АТФ + D-гексоза ↔ АДФ + D- гексоза-6ф
Систематическое название: АТФ: D-гексоза-6-фосфотрансфераза
Тривиальное название: гексокиназа
3) Гидролазы.
Расщепляют ковалентную связь с присоединением молекулы воды. В реакцию вступают 2 вещества и 2 образуются: S-G + Н2О ↔ S-ОН + G-Н.
a.гликозидазы – гидролиз гликозидов (лактоза – лактаза, мальтоза
– мальтаза, сахароза – сахараза)
b.пептидазы – гидролиз пептидных связей
c.эстеразы – разрыв связи в сложных эфирах.
Систематическое название субстрат–что отщепляется–гидролаза или
субстрат–гидролаза
Тривиальное название: субстрат-что отщепляетсяаза
Шифр: 3.1.1.1
Пример: Глюкозо-6ф + Н2О → глюкоза + Н3РО4
Систематическое название: Глюкозо-6ф-фосфогидролаза Тривиальное название: Глюкозо-6ф-фосфотаза
4) Лиазы
9
Отщепление групп от субстратов по негидролитическому механизму с образованием двойных связей (или наоборот, присоединение по двойной связи). Реакции обратимы, за исключением отщепления СО2. В реакцию вступает 1 вещество и 2 образуются (или наоборот): -SХ-SY- ↔ XY + -S=S-
Систематическое название: субстрат: что отщепляется–лиаза
Тривиальное название: продуктаза
Шифр: 4.1.1.1
Пример: L-малат ↔ фумарат + Н2О
Систематическое название: L-малат: гидро–лиаза
Тривиальное название: фумараза
5) Изомеразы
Взаимопревращения оптических, геометрических, позиционных изомеров. В реакцию вступает 1 вещество и 1 образуется.
a.Рацемазы
b.Эпимеразы
c.Таутамеразы
d.цис,- трансизомеразы
e.мутазы (при внутримолекулярном переносе группы)
f.цикло-, оксоизомеразы.
Систематическое название субстрат–вид изомеризации–изомераза или
субстрат–продукт–изомераза
Шифр: 5.1.1.1
Пример: гл-6ф ↔ фр-6ф
Систематическое название: гл-6ф–фр-6ф–изомераза
6) Лигазы (синтетазы)
Соединение 2 молекул с использованием энергии макроэргических соединений (АТФ и др). В реакцию вступают 3 вещества, образуется 3 вещества.
Систематическое название: субстрат: субстрат–лигаза (источник
энергии)
Тривиальное название: субстратсубстратлаза
10
Шифр: 6.1.1.1
Пример: АТФ + ПВК + СО2 → АДФ + Фн + ЩУК Систематическое название: ПВК: СО2–лигаза (АТФ → АДФ + Фн)
Тривиальное название: пируваткарбокилаза
Коферменты:
Выступает в роли акцептора и донора химических группировок.
Локализуется в каталитическом участке активного центра.
Простестическая группа – кофермент связан с белковой частью молекулы ковалентными связями. Связь прочная. Есть некоторые коферменты, связанные нековалентными связями, но являющиеся очень прочными.
Связь нековалентная - временное взаимодействие на время химической реакции, может рассматриваться в качестве второго субстрата.
Ккоферментам относятся:
гемы,
нуклеотиды,
коэнзим Q,
ФАФС,
SAM,
Глутатион
производные водорастворимых витаминов:
Витамины |
Коферменты |
|
РР (никотиновая |
НАД+, НАДФ+ |
|
кислота) |
|
|
В2 |
(рибофлавин) |
ФАД, ФМН |
В6 |
(пиридоксаль) |
Пиридоксальфосфат |
В1 |
(тиамин) |
Тиаминпирофосфат |
В12 |
Кобаламины |
|
11
