
Биохимические методы исследования в медицине
.pdfФГБОУ ВО УГМУ Минздрава РФ
кафедра биохимии
БИОХИМИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ
В МЕДИЦИНЕ
Учебно – методическое пособие к лабораторно - практическтм занятиям
для студентов специальностей высшего образования – специалитет
31.05.02 Педиатрия |
2 курс, 3-4 семестры |
Составлено доц. Каминской Л.А.
Утверждено на заседании кафедры 30.08. 2016
Протокол №1
ВВЕДЕНИЕ
Для целей клинической диагностики и развития научных биохимических и медицинских исследований чрезвычайно важно исследование
1

биологических жидкостей и тканей организма в норме и патологии для определения ●качественного химического состава,
●количественного химического состава, ● направления метаболических процессов. ●присутствия и активности ферментов
Возникновение патологических состояний в организме может сопровождаться ●изменением концентрации веществ,
● отсутствием одного из обычныхвеществ, ●появлением необычного компонента.
Объекты исследований
биологические жидкости |
патологические жидкости |
кровь, моча, пот, слюна, |
отечная, плевральная , |
ликвор, пищеварительные соки |
внутрисуставная |
ткани, |
органы |
клетки
органеллы |
мембраны |
Направления исследований
органические вещества |
минеральные вещества |
низкомолекулярные |
элементный состав |
высокомолекулярные |
катионы, анионы |
2

Исследования in vivo проводят с помощью введенных в организм датчиков (ионоселективных электродов), меченых атомов; in vitro- различными физикохимическими, аналитическими, ферментативными методами.
Состав биологических жидкостей, тканей сложен, в большинстве случаев необходимо проводить разделение веществ перед их идентификацией и количественным определением. Для количественных определений в настоящее время применяют различные автоматические анализаторы.
ОБОРУДОВАНИЕ И МЕТОДЫ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ
1.Гомогенизация тканей и клеток
Гомогенизацию тканей осуществляют для разрушении тканевых структур или мембран, чтобы затем определять их качественный и количественный состав, наличие и свойства ферментов.
Взвешенный кусочек ткани (навеску), отмытую от крови, быстро измельчают ножницами, скальпелем, пропускают через сетчатый пресс или растирают с кварцевым песком в ступке, но чаще используют стеклянный гомогенизатор Поттера. Он представляет собой узкую колбу, в которую вводят измельченную ткань, растворитель и стеклянный пестик, который подключен к ротору. Скорость вращения ротора зависит от вида ткани (800 -2000 об/мин.) (рис.1). Другой способ разрушения клеточной структуры – многократное замораживание/ размораживание, обработка ультразвуком и др.
А |
Б |
Рис. 1. А. Схематическое изображение гомогенизатора, Б. Общий вид гомогенизатора.
2. Центрифугирование в биохимических исследованиях
3

Центрифугирование — это разделение грубодисперсных систем, состоящих из жидких и твердых компонентов с разными плотностями в специальных аппаратах центрифугах. Принцип действия центрифуги основан на создании большой центробежной силы, под влиянием которой скорость разделения компонентов смеси, помещенной в центрифугу, увеличивается во много раз по сравнению со скоростью разделения их под действием силы тяжести
Метод центрифугирования широко применяется в биологии, медицине и технике, нередко заменяет более длительные процессы фильтрования, отстаивания и отжимания. В клинических и санитарно-гигиенических лабораториях центрифугирование используют для отделения эритроцитов от плазмы крови, сгустков крови от сыворотки, плотных частиц от жидкой части мочи и т. д. Для этой цели применяют или ручные центрифуги (или центрифуги с электроприводом, скорость вращения которых можно регулировать) . Центрифужные пробирка помещают в гнезда ротора (рис 2). Скорость вращения зависит от поставленной задачи. Например, при центрифугировании крови эритроциты выделяются (оседают) при 3500 - 4000 оборотов/мин. При этих скоростях можно использовать стеклянные центрифужные пробирки. Ультрацентрифуги, скорость вращения роторов которых превышает 20 000 - 40 000 об/мин, применяют обычно в экспериментальной практике для разделения органелл клеток, отделения коллоидных частиц, макромолекул полимеров. В этих случаях используют пластиковые пробирки (полипропилен, фторопласт). Осадок можно отделить, удаляя надосадочную жидкость. Низкомолекулярные соединения остаются в надосадочной эидкости (супернатанте) и могут быть в ней определены.
Частицы одинаковой массы, но различной формы осаждаются при разных скоростях.
При одинаковой плотности крупные частицы оседают намного быстрее, чем мелкие.
Рис 2. Лабораторные центрифуги
4
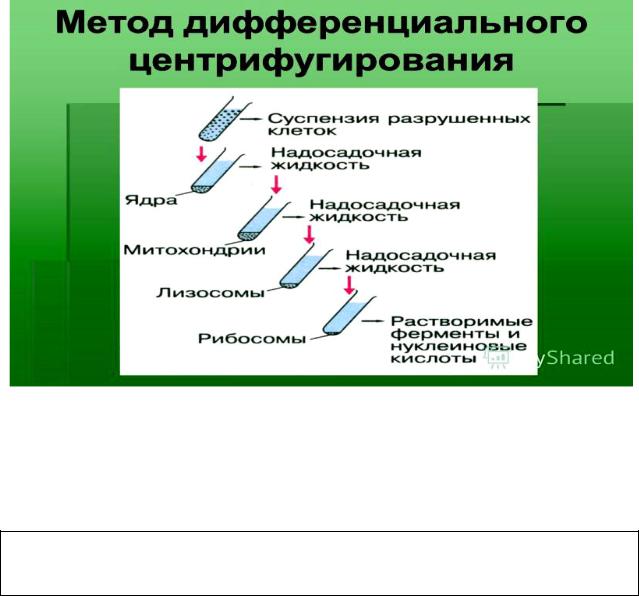
В медико-биологических исследованиях широкое применяется
дифференциальное центрифугирование. Этот метод основан на различиях в скорости седиментации (осаждении) частиц, отличающихся друг от друга размерами и плотностью. Гомогенат ткани центрифугируют в несколько этапов. На каждом отделяют надосадочную жидкость, которую вновь центрифугируют при большем числе оборотов.
Рис. 3. Последовательнось этапов при выделении субклеточных структур
(https://docviewer.yandex.ru/)
На каждом этапе на дно пробирки осаждается определённая фракция. Дифференциальное центрифугирование является самым распространённым методом выделения клеточных органелл из гомогенатов тканей .
Основные компоненты клетки осаждаются в следующей последовательности: сначала целые клетки и их фрагменты - затем ядра – хлоропласты – митохондрии – лизосомы – микросомы - рибосомы (рис. 3).
Подлинность фракции проверяют по наличию органеллоспецифичных ферментов данной субклеточной структуры, чистоту – по отсутствию органеллоспецифичных ферментов других субклеточных структур.
3.Хроматография в клинических и научных медицинских исследованиях
Метод хроматографии является наиболее распространенным для разделения смеси веществ. Все биологические жидкости (плазма или сыворотка крови, слюна, моча, слеза, пот), экстракты и гомогенаты тканей
5
являются многокомпонентными смесями, содержащими множество органических веществ и ионов металлов.
Краткие исторические сведения. Русский ученый - ботаник М.С.Цвет в
1903 г. впервые применил метод для анализа хлорофилловых пигментов листьев и обнаружил одновременное присутствие не только зеленых, но желтых и оранжевых хлорофилловых пигментов. В процессе опыта он пропускал экстракт листьев через стеклянную колонку, заполненную адсорбентом карбонатом кальция (мелом).
Но только спустя 27 лет в 1930 г. опыт был повторен, и метод применили для разделения каротина на изомеры.
Принцип метода. В процессе хроматографирования так называемая подвижная фаза (элюент), содержащая анализируемую пробу, перемещается через неподвижную фазу. Обычно неподвижная фаза (сорбент) представляет собой вещество с развитой поверхностью, а подвижная – поток газа или жидкости, фильтрующейся через слой сорбента. При этом происходит многократное повторение актов сорбции – десорбции, что является характерной особенностью хроматографического процесса и обусловливает эффективность хроматографического разделения.
3.1 Классификация видов хроматографии
1.По агрегатному состоянию применяемых фаз
2.По механизмам разделения
3.По применяемой технике
I.По агрегатному состоянию применяемых фаз
газовая |
жидкостная |
газо-жидкостная газо-адсорбционная
жидкостно – жидкостная
жидкостно – адсорбционная
жидкостно – гелевая
Первое слово в этой классификации характеризует агрегатное состояние подвижной фазы.
II. По механизмам разделения
6

Под механизмом разделения подразумевают характер взаимодействия между сорбентом и сорбатом.
1. Адсорбционная хроматография – разделение основано на том, что разделяемые вещества различно адсорбируются твердым адсорбентом.
2.Распределительная хроматография – разделение основано на различии в растворимости разделяемых веществ в неподвижной фазе (газовая хроматография) и на различии в растворимости разделяемых веществ в подвижной и неподвижной жидких фазах.
3.Ионообменная хроматография – разделение основано на различии в способности разделяемых веществ к ионному обмену;
4.Проникающая хроматография – разделение основано на различии в размерах или формах молекул разделяемых веществ, например, при применении молекулярных сит (цеолитов).
5.Осадочная хроматография – разделение основано на образовании различных по растворимости осадков разделяемых веществ с сорбентом.
Все перечисленные виды встречаются при протекании физико-химических и биохимических процессов in vivo. Например, проникновение и распределение катионов различных металлов (остеотропных элементов) в костную ткань или эмаль зуба (тип 1). Избирательное проникновение различных веществ через тканевые барьеры, представленные гиалуроновой кислотой (тип 4).
III.По применяемой технике
1)Колоночная хроматография – разделение веществ проводится в специальных колонках;
2)Плоскостная хроматография:
бумажная |
тонкослойная |
разделение веществ |
разделение веществ |
на специальной бумаге |
в тонком слое сорбента |
В бумажной хроматографии применяют распределительный и ионообменный механизмы. В колоночной и тонкослойной хроматографии можно использовать любой из приведенных механизмов разделения.
Наибольшее распространение получили методы тонкослойной, колоночной и газо-жидкостной хроматографии.
7

1)колоночная хроматография – разделение веществ проводится в специальных колонках;
2)плоскостная хроматография:
а– бумажная – разделение веществ проводится на специальной бумаге; б – тонкослойная – разделение веществ проводится в тонком слое сорбента.
Вколоночной и тонкослойной хроматографии можно использовать любой из приведенных выше механизмов разделения, в бумажной хроматографии чаще всего применяют распределительный и ионообменный механизмы.
Применимость метода. Бумажную и тонкослойную хроматорафию применяют в медицине, фармации , судебно – медицинской экспертизе для разделения смесей моносахаридов, триглицеридов., высших карбоновых кислот, аминокислот, стероидных гормонов, обнаружения и подтверждении подлинности лекарственных препаратов . В каждом случае подбирают состав подвижной фазы и носитель.
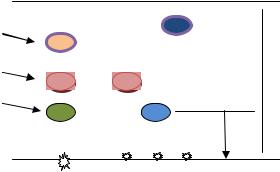
Методика проведения исследования. На пластинку (бумагу) на линию
старта наносят капли исследуемого раствора и «свидетели» - те вещества, которые подлежат определению в смеси. Пластинку помещают в хроматографическую «ванну) (рис.4 ). Может быть восходящая (растворитель движется снизу вверх) и нисходящая (сверху –вниз) хроматография. Вслед за растворителем движутся вещества, составляющие смесь, и постепенно происходит их разделение (рис. 5). Многие вещества бесцветные, для их обнаружения применяют различные проявители или используют их способность к люминесценции в ультрафиолете.
Рис 4. Хроматографическая |
Рис.5 Пластинка после проведения |
|
пластинка в |
«ванне». |
хроматографии |
|
|
8 |
Сравнивают на пластинке место расположения пятен «свидетеля» и пятен веществ из смеси. совпадение «длины пробега» является доказательством идентичности. Для количественной оценки подвижности вещества определяют коэффициент подвижности Rf – отношение пути l, пройденного веществвом, к пути L, пройденном растворителем (рис 6). Вещества 1 и 2, содержащиеся в в образце, совпадают по коэффициенту подвижности с двумя свидетелями. Вещество 3 по данным этой хроматограмы не идентифицировано. При соблюдении стандартных условий проведения исследования ( пластинка, состав растворителяэлюента, температура) величину Rf можно узнать в справочнике (табл 1)..
линия финиша
3
2 |
L |
1
l линия старта
образец свидетели
Рис.6. Определение величины Rf = l / L
Таблица1. Значения Rf аминокислот (при температуре 20°С) (Растворитель бутанол-уксусная кислота:вода /4:1:5/)
Аминокислота |
Rf |
|
Rf |
Аминокислота |
|
||
|
|
|
|
Цистин |
0,04 |
Гистидин |
0,16 |
Цистеин |
0,05 |
Алании |
0,36 |
Аспарагиновая кислота 0,24 |
Тирозин |
0,45 |
|
Глутаминовая кислота |
0,28 |
Валин |
0,50 |
Серии |
0,22 |
Метионин |
0,50 |
Лизин |
0,14 |
Лейцин |
0,69 |
Глицин |
0,25 |
Фенилаланин |
0,66 |
Треонин |
0,29 |
Изолейцин |
0,68 |
Гистидин |
0,16 |
Аргинин |
0,18 |
Алании |
0,36 |
Валин |
0,50 |
Тирозин |
0,45 |
|
|
Для количественного определения используют несколько приемов, но современный – метод денситометрии. т.е. измерение плотности
9

(поглощения) света веществом в сравнении с известным стандартом. Используют оптический денситометр в комплекте с компьютером, принтером и программами обработки хроматограмм в видимой и УФ областях спектра (рис.7).
Рис.7 Оптический денситометр
Колоночная хроматография
Колонка заполняется сорбентом, сверху на столбик сорбента помещают исследуемый раствор, содержащий несколько веществ. Затем сверху начинают пропускать растворитель –элюент. У веществ различная способность адсорбироваться на носителе, постепенно происходит их разделение в толще столбика-наполнителя. Растворитель продолжают пропускать, и зоны веществ вымываются друг за другом в посудуприемник, которую меняют при продвижении новой зоны к концу колонки (рис.8 ) Сорбентом может быть целлюлоза. крахмал, мел, оксид алюминия и др.
Рис.8 . Колоночная хроматография
10
