
- •1. Ферменты: определение понятия, химическая природа, физико-химические свойства и биологическая роль ферментов.
- •2. Изоферменты. Строение, биологическая роль, диагностическое значение определения, изменение в онтогенезе и при патологии органа, диагностическое значение.
- •5. Ингибирование активности ферментов, виды ингибирования: обратимое, необратимое, конкурентное, неконкурентное
- •6. Регуляция активности ферментов: неспецифическая, специфическая (понятия). Механизмы специфической регуляции активности ферментов
- •9. Энзимопатии: понятие, классификация, молекулярные причины возникновения и механизмы развития, последствия, биохимическая диагностика.
- •10. Энзимодиагностика: классификация ферментов клетки, крови в энзимодиагностике, диагностическое значение, применение в педиатрии
- •11. Биохимические основы энзимотерапии, применение ферментов в энзимотеравии (примеры)
- •12. Цикл Кребса - схема реакций, ферменты, коферменты, энергетический баланс одного оборота. Тканевые особенности в детском возрасте, Регуляция.
- •14. Механизмы сопряжения и разобщения дыхания и фосфорилирования, эндогенные и экзогенные разобщители.
- •15. Микросомальное биологическое окисление (система транспорта электронов, цитохромы р-450, в-5). Биологическое значение, регуляция, особенности активности ферментов в детском возрасте
- •21. Нормогликемия, пути превращения углеводов в клетках организма и ключевая роль глюкозо-б-фосфата.
- •23. Аэробный путь окисления глюкозы, тканевые особенности, энергетический баланс. Эффект Пастера, регуляция.
- •24. Катаболизм глюкозы по пентозофосфатному пути, биологическая роль. Регуляция значение пентозофосфатного пути в обеспечении метаболических процессов в организме человека
- •25. Гипогликемия: биохимические причины возникновения, механизмы восстановления нормогликемии, биохимические особенности детского возраста
- •26. Гипергликемия: биохимические причины возникновения, механизмы восстановления нормогликемии, биохимические особенности детского возраста
- •27. Контринсулярные гормоны (глюкагон, адреналин, кортизол): химическая природа, молекулярные механизмы участия в углеводном обмене.
- •29. Сахарный диабет инсулинзависимый (ИЗСД, I тип): биохимическая диагностика, механизмы развития метаболических нарушений (гипергликемия, холестеринемия, кетонемия, ацидоз, гликозилирование белков), биохимические особенности детского возраста
- •36. Липолиз триглицеридов в белой и бурой жировой ткани
- •37. Механизмы β - окисления жирных кислот. Регуляция
- •38. Пути обмена АцКоА. Кетоновые тела: биологическая роль, кетонемия, кетонурия, причины и механизмы развития, последствия, биохимические особенности детского возраста.
- •39. Обмен холестерина в организме человека. Регуляция синтеза холестерина
- •40. Атеросклероз: биохимические причины, факторы риска, лабораторная диагностика риска развития атеросклероза: обмена и развития его нарушений, гендерные особенности.
- •41. Роль белка в питании: состав и классификация пищевых белков, заменимые и незаменимые аминокислоты. Принципы нормирования белка в питании детей и взрослых. Азотистый баланс организма человека.
- •45. Причины токсичности аммиака и пути обезвреживания аммиака (образование глн, цикл мочевины, регуляция).
- •47. Регуляторные системы организма. Определение понятия – гормоны, принципы классификации гормонов.
- •48. Уровни и принципы организации нейро – эндокринной системы. Концепции обратной связи.
- •49. Рецепция и механизмы действия стероидных гормонов.
- •50. Рецепция и механизмы действия пептидных гормонов
- •55. Белки плазмы крови: классификация, диагностическое значение электрофореграмм.
- •57. Альбумины сыворотки крови: физико-химических свойства, функции, обмен
- •60. Гемоглобин: виды, строение, функции, обмен в норме. Метгемоглобинредуктазная система.
- •61. Биохимические функции почек, особенности метаболических процессов в почках.
- •63. Состав первичной и конечной мочи, физико – химические показатели в норме.
- •64. Химический состав мочи в норме и при патологии. Клиренс: понятие, виды.
- •65. Ренин-ангиотензин-альдостероновая система (РААС) в поддержании гомеостаза натрия. Механизм действия альдостерона на молекулярном уровне в почке и слюнных железах
- •66. Антидиуретический гормон и регуляция водного баланса организма.
- •67. Биохимические гомеостатические функции печени, биохимические особенности в детском возрасте.
- •68. Функциональные пробы и нагрузки характеризующие состояние углеводного, липидного, белкового обмена и детоксицирующей функции печени у детей. И взрослых.
- •70. Белки соединительной ткани коллаген и эластин: особенности аминокислотного состава и структурной организации молекул. Витамин С в синтезе коллагена.
- •74.Витамин Д – этапы образования активных форм, их метаболические функции, механизм действия. Роль печени, почек в обмене витамина Д, патохимические причины развития рахита, показатели кальций-фосфорного обмена при рахите на разных стадиях болезни.
- •75.Паратиреоидный гормон (ПГ) и кальцитонин (КГ) – химическая природа, стимулы секреции, механизмы действия в регуляции обмена кальция и ремоделирования костной ткани, проявления гипо- и гипертиреоза
- •76.Биохимические процессы в остеобластах и остеокластах в ремоделировании костной ткани.
- •77.Белковые и минеральные компоненты костной ткани
- •78.Биохимия нервной ткани: особенности химического состава, метаболических процессов, синтез нейромедиаторов.
- •80.Миокард: особенности метаболических процессов, метаболические нарушения при гипоксии, клиническая биохимическая энзимодиагностика при инфаркте миокарда
- •81.Биохимия лактации: физико – химические свойства, химический состав грудного молока, характеристика ферментов молока. Изменение химического состава в процессе лактации: виды женского молока
- •82.Биохимия лактации: биохимические механизмы образования органических компонентов молока в лактирующей железе, белок лактальбумин, роль гормонов (пролактин, окситоцин, плацентарного лактоген, эстрогены, СТГ, Т3, Т4, кортизол, инсулин)
- •83.Витамины: химическая природа, классификация по растворимости в воде и биохимическим механизмам действия. Провитамины и механизмы их активации (на примере провитаминов Д и А). Эндогенные и экзогенные причины гипо- , гипер- и авитаминозов
- •84.Витамины-коферменты РР, В2 участие в метаболических процессах, биохимические механизмы проявления гиповитаминозов
- •Симптомы гиповитаминоза
- •Симптомы гиповитаминоза
- •86.Витамины-коферменты В12, фолиевая кислота участие в метаболических процессах, биохимические проявления гиповитаминозов
- •87.Витамин С: участие в метаболических процессах, биохимические механизмы проявления гиповитаминозов
- •89.Буферные системы плазмы крови: гидрокарбонатная, фосфатная, белковая Гемоглобиновая буферная система эритроцитов, связь с гидрокарбонатной системой плазмы и эритроцита. Механизмы участия карбоангидразы в регуляции КОС.
- •90.Кислотно-основный гомеостаз: биологическое значение постоянства внутренней среды организма., механизмы поддержания КОС, особенности в детском возрасте.
- •91.Нарушения КОС - классификация по механизмам? Биохимические пути компенсации.
через ЩУК, используются в глюконеогенезе (ала, асн, асп, гли, глу, глн, про, сер, цис, арг, гис, вал, мет, тре).
Кетогенные аминокислоты – АК, которые в процессе катаболизма превращаются в ацетоацетат (Лиз, Лей) или ацетил-КоА (Лей) и могут использоваться в синтезе кетоновых тел.
Смешанные (глико-кетогенными) аминокислоты – АК, при катаболизме которых образуются метаболит цитратного цикла и ацетоацетат (Три, Фен, Тир) или ацетил-КоА (Иле). Эти АК используются для синтеза глюкозы и кетоновых тел.
45. Причины токсичности аммиака и пути обезвреживания аммиака (образование глн, цикл мочевины, регуляция).
ОБМЕН АММИАКА
Аммиак в организме образуется:
при дезаминировании АК во всех тканях (много);
при дезаминировании биогенных аминов и нуклеотидов во всех тканях (мало);
при дезаминировании АМФ в интенсивно работающей мышце;
при гниении белков в кишечнике.
Концентрация аммиака
Концентрация аммиака в сыворотке крови в норме 11—35 мкмоль/л. В крови и цитозоле клеток при физиологических значениях рН аммиак переходит в ион аммония — NH4+, количество неионизированного NH3 невелико (~ 1%).
Токсичность аммиака
Аммиак — токсичное соединение. Даже небольшое повышение его концентрации оказывает неблагоприятное действие на организм, и, прежде всего на ЦНС.
Механизм токсического действия аммиака:
1.Аммиак легко проникает через мембраны в клетки и в митохондриях сдвигает реакцию, катализируемую глу-ДГ, в сторону образования глу:
α-Кетоглутарат + НАДH2 + NH3 → глу + НАД+.
138
Уменьшение концентрации α-кетоглутарата вызывает:
угнетение реакции трансаминирования АК и снижение синтеза из них нейромедиаторов (ацетилхолина, дофамина и др.);
снижения скорости ЦТК и развитие энергодефицита.
Недостаточность α-кетоглутарата ускоряет реакции синтеза ЩУК из ПВК, сопровождающейся интенсивным потреблением СО2 (особенно характерны для клеток головного мозга).
2.Повышение концентрации аммиака в крови сдвигает рН в щелочную сторону, вызывает алкалоз. Алкалоз увеличивает сродство гемоглобина к кислороду, что препятствует отдачи им кислорода. В результате развивается гипоксия тканей, энергодефицит, от которого главным образом страдает головной мозг.
3.Высокие концентрации аммиака, при участии глутаминсинтетазы, стимулируют синтез глутамина из глутамата в нервной ткани:
4.Глу + NH3 + АТФ → Глн + АДФ + Н3РО4. Накопление глн в клетках нейроглии приводит к повышению в них осмотического давления, набуханию астроцитов и в больших концентрациях вызвает отёк мозга. Снижение концентрации глу нарушает обмен АК и нейромедиаторов, в частности синтез γ-аминомасляной кислоты (ГАМК), основного тормозного медиатора. При недостатке ГАМК и других медиаторов нарушается проведение нервного импульса, возникают судороги.
5.Ион NH4+ практически не проникает через цитоплазматические и митохондриальные мембраны. Избыток NH4+ в крови нарушает трансмембранный перенос одновалентных катионов Na+ и К+, конкурируя с ними за ионные каналы, что также влияет на проведение нервных импульсов.
6.Низкие концентрации аммиака стимулируют дыхательный центр, а высокие – угнетают.
Связывание (обезвреживание) аммиака
В связи с токсичностью аммиака в тканях происходит его связывание с образованием нетоксичных соединений – АК и мочевины. Процесс образования и обезвреживания аммиака регулируют в основном ферменты глутаматдегидрогеназа и глутаминсинтетаза.
Обмен глутамата
139
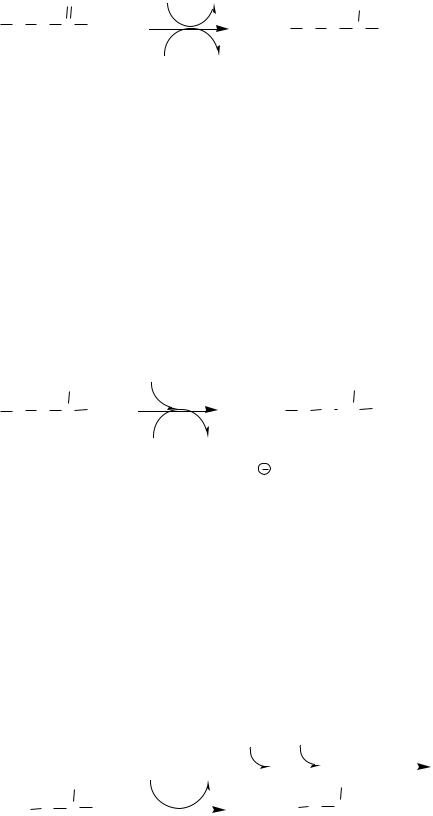
В мозге и некоторых других органах может протекать восстановительное аминирование α-кетоглутарата под действием глутаматдегидрогеназы, катализирующей обратимую реакцию.
|
|
|
|
O |
|
NH |
H O |
|
|
|
|
|
|
|
|
|
|
3 |
2 |
|
|
|
NH |
|
|
|
|
H |
|
|
|
|
|
H |
2 |
|
||
|
|
|
2 |
|
|
|
|
|
|
|
||
HOOC |
C |
C |
|
C |
COOH |
HOOC |
C |
C |
2 |
C |
COOH |
|
|
|
|||||||||||
|
H |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
H |
|
|
H |
|
|
|
2 |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
2 |
|
|
|
|
а-кето глутарат |
+ |
Í ÀÄÍ |
глутам ат |
|
||||||||
|
|
|
|
|
|
Í ÀÄ |
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
Глут ам ат дегидро ген аза |
|
|
|
|
|
|
Однако этот путь обезвреживания аммиака в тканях используется слабо, так как глутаматдегидрогеназа катализирует преимущественно реакцию дезаминирования глутамата. Хотя, если учитывать последующее образование глутамина, реакция выгодна для клеток, так как способствует связыванию сразу 2 молекул NH3.
Обмен глутамина
Основной реакцией связывания аммиака, протекающей во всех тканях организма (основные поставщики мышцы, мозг и печень), является синтез глутамина под действием глутаминсинтетазы:
|
|
|
|
|
|
NH |
|
|
|
|
|
|
|
|
|
|
NH2 |
3 |
|
|
|
NH2 |
|
|
|
|
H |
|
2+ |
|
|
H |
|
||
|
|
|
2 |
|
Mg |
|
|
|
|
||
|
|
|
|
C |
COOH |
H NOC |
C |
2 |
CH |
COOH |
|
HOOC |
C |
|
C |
|
C |
||||||
|
|
H |
|
2 |
H |
|
|
|
|||
|
H |
2 |
|
|
|
|
2 |
|
|
||
|
|
|
|
|
|
|
|
|
|
êèø å÷í èê,  ï î ÷êè
ï î ÷êè
глутам ат |
ÀÒÔ |
ÀÄÔ + Ôí |
глутам ин |
|
Ãëóò àì èí ñèí ò àçà |
ÀÌ Ô, ãëþ êî çî -6ô , ãëè, àëà è ãèñ |
|
Глутаминсинтетаза находиться в митохондриях клеток, содержит кофактор — ионы Mg2+, является одним из основных регуляторных ферментов обмена АК. Она аллостерически ингибируется АМФ, глюкозо-6ф, гли, ала и гис.
Глутамин, путём облегчённой диффузии, легко проходит клеточные мембраны (для глутамата возможен только активный транспорт), поступает из тканей в кровь и транспортируется в кишечник и почки.
В почках происходит гидролиз глутамина под действием глутаминазы с образованием аммиака:
|
|
|
|
|
|
|
|
Í + |
Àí èî í û (Cl-, SO42-) |
|||||||||
|
|
|
|
|
|
H2O |
NH3 |
|
|
|
|
|
|
|
|
Ñî ëè àì ì î í èÿ |
||
|
|
|
|
NH2 |
|
|
|
|
H2N |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
H |
|
|
|
|
|
|
|
|
|
H2 |
|
|
|
|
|
H2NOC |
|
C |
C2 |
C |
COOH |
|
|
|
|
HOOC |
|
C |
C |
|
C |
|
COOH |
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
||||||||||||
|
|
H |
2 |
H |
Ãëóò àì è í àçà |
|
H2 |
|
|
H |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
глутам ин |
глутам ат |
|
140

Аммиак с протонами и анионами образует соли аммония (0,5 г/сут), которые выделяются с мочой. Этот процесс используется для регуляции КОС и сохранения в организме важнейших катионов Na+ и К+. Глутаминаза почек значительно индуцируется при ацидозе, ингибируется при алкалозе.
В клетках кишечника также под действием глутаминазы происходит гидролитическое освобождение амидного азота в виде аммиака:
|
|
|
|
ф екалии |
ï å÷åí ü |
|
|
|
|
|
|
|
|
|
|
H O |
NH |
|
|
|
|
|
|
|
|
|
|
2 |
3 |
|
|
|
|
NH2 |
|
|
H |
|
|
NH2 |
|
|
|
H |
|
||
|
2 |
|
|
|
|
|
|
|
|||
H NOC |
C |
C |
CH COOH |
|
HOOC |
C |
C |
2 |
C |
COOH |
|
|
|
|
|||||||||
2 |
|
|
H |
|
|
|
H |
|
|
H |
|
|
|
|
|
|
|
2 |
|
|
|||
|
|
|
2 |
Ãëóò àì èí àçà |
|
|
|
|
|||
|
|
|
|
глутам ат |
|
||||||
|
глутам ин |
|
|
|
|||||||
|
|
|
|
|
|
|
|
||||
Образовавшийся аммиак поступает через воротную вену в печень или удаляется из организма с фекалиями.
Высокий уровень глутамина в крови и лёгкость его поступления в клетки обусловливают использование глутамина во многих анаболических процессах. Глутамин — основной донор азота в организме. Амидный азот глутамина используется для синтеза пуриновых и пиримидиновых нуклеотидов, аспарагина, аминосахаров и других соединений.
Обмен аспарагина
Обезвреживание аммиака в тканях происходит незначительно при синтезе аспарагина под действием глутаминзависимой и аммиакзависимой
аспарагинсинтетазы.
|
|
|
|
NH2 |
NH3 |
(или глн) |
H2N |
|
||||
|
|
|
|
|
|
|
|
|
||||
|
|
H2 |
|
|
|
|
H2 |
COOH |
||||
HOOC |
|
C |
|
C |
|
|
COOH |
|
|
H2NOC |
C C |
|
|
|
|
|
|
|
|||||||
|
|
|
|
H |
|
|
|
|
H |
|
||
аспартат |
АТФ |
АМФ + ФФн |
аспарагин |
|||||||||
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
||||
Аспарагинсинтаза
Первая функционирует в животных клетках, вторая преобладает в бактериальных клетках, но присутствует и у животных.
Обмен аланина
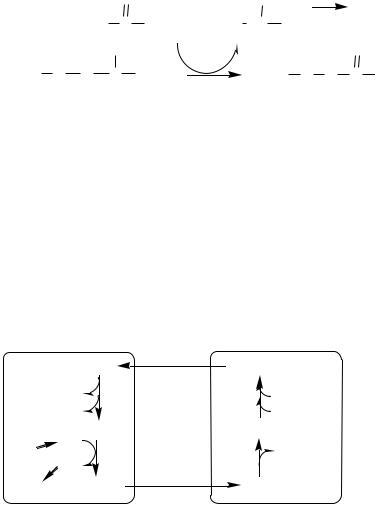
Из мышц и кишечника избыток аминого азота выводится преимущественно в виде аланина.
В кишечнике:
141
|
|
|
|
|
O |
|
|
NH |
2 |
|
|
|
ï |
å÷åí ü |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H C |
C |
COOH |
H C CH |
COOH |
|
|
|
||||
|
|
|
|
3 |
|
Ï ÂÊ |
3 |
àëà |
|
|
|
|
|
|
|
|
|
|
H |
N |
|
|
|
|
|
O |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
H |
H |
2 |
|
|
|
|
|
H |
|
|
|
||
|
2 |
|
|
|
|
|
|
|
|
|||||
HOOC |
C |
2 |
C |
C |
COOH |
|
HOOC |
C |
2 |
C |
C |
COOH |
||
|
|
|
|
|||||||||||
|
|
|
|
|
H |
|
|
|
|
|
|
H |
|
|
|
|
глутам ат |
|
ÀËÒ |
|
|
|
|
2 |
|
|
|||
|
|
|
|
а-кето глутарат |
||||||||||
Глутамат подвергается трансаминированию с ПВК с образованием аланина и α-кетоглутарата. Аланин поступает из кишечника в кровь воротной вены и поглощается печенью.
В мышцах:
Образование аланина в мышцах, его перенос в печень связан с обратным переносом в мышцы синтезированной в печени глюкозы. Этот процесс называется глюкозо-аланиновый цикл:
|
|
Ì |
û ø öà |
|
Ï å÷åí ü |
||
|
|
|
ãëþ êî çà |
|
ãëþ êî çà |
||
|
|
2ÀÒÔ |
|
|
2Í ÀÄÍ |
||
2Í ÀÄÍ |
|
|
|
2 |
|||
2 |
|
Êðî âü |
6ÀÒÔ |
||||
|
|
|
|
|
|
||
|
|
|
|
|
Ï ÂÊ |
Ï ÂÊ |
|
|
|
|
ÀÊ |
|
|||
белки |
|
|
NH |
||||
|
|
|
|
||||
ÊÊ |
|
|
3 |
||||
|
|
|
|
|
|
||
ÑÎ |
|
Í |
Î |
àëàí èí |
|
àëàí èí |
|
2 |
|
|
|
|
|||
|
|
2 |
|
|
|
|
|
Он необходим, так как активность глу-ДГ в мышцах невелика и непрямое дезаминирование АК малоэффективно.
Мышцы выделяют особенно много аланина в силу их большой массы, активного потребления глюкозы при физической работе, а также потому, что часть энергии они получают за счёт распада АК. Образовавшийся аланин поступает в печень, где подвергается непрямому дезаминированию. Выделившийся аммиак идет на синтез мочевины, а ПВК включается в глюконеогенез. Глюкоза из печени поступает в ткани и там, в процессе гликолиза, опять окисляется до ПВК.
ОРНИТИНОВЫЙ ЦИКЛ
Большая часть свободного аммиака, а также аминного азота в составе АК (в основном глутамин, аланин) поступают в печень, где из них синтезируется нетоксичное и хорошо растворимое в воде соединение — мочевина. Мочевина является основной формой выведения азота из организма человека.
142
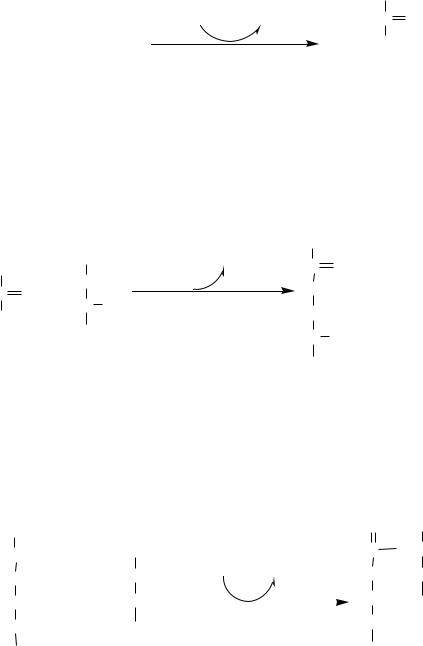
Синтез мочевины происходит в цикле, который замыкается орнитином. Цикл открыли в 40-х годах XX века немецкие биохимики Г. Кребс и К. Гензелейт.
Мочевина (карбамид) — полный амид угольной кислоты — содержит 2 атома азота, один из аммиака, другой – из асп.
Реакции орнитинового цикла
Предварительно в митохондриях под действием карбамоилфосфатсинтетазы I с затратой 2 АТФ аммиак связывается с СО2 с образованием карбамоилфосфата:
|
|
|
NH |
|
|
|
|
|
2 |
|
|
|
|
2ÀÒÔ 2ÀÄÔ+Ôí |
C |
O |
|
NH + CO |
2 |
+ H O |
OPO H |
||
3 |
2 |
|
3 |
2 |
|
|
|
Карбо м о илф о сф ат син т ет аза |
карбо м о илф о сф ат |
||
(Карбамоилфосфатсинтетаза II локализована в цитозоле клеток всех тканей и участвует в синтезе пиримидиновых нуклеотидов).
1. В митохондриях орнитинкарбамоилтрансфераза переносит карбамоильную группу карбамоилфосфата на орнитин и образуется — цитруллин:
|
|
|
|
|
NH |
2 |
|
|
|
|
|
|
|
NH |
|
|
NH2 |
Ôí |
C |
O |
2 |
|
|
|
|||
|
|
(CH ) |
|
|
|
|
|
|
|
|
|
|
|
C |
O |
+ |
2 3 |
|
NH |
|
HC NH |
|
|
||||
|
|
|
|
(CH |
) |
|
OPO H |
|
2 |
О рн и т и н карбо м о и л- |
|||
2 |
|
|
2 3 |
|||
|
3 |
COOH |
|
|
|
|
|
|
|
т ран сф ераза |
HC |
NH |
|
|
|
|
Î ðí èòèí |
|
|
2 |
|
|
|
|
COOH |
||
|
|
|
|
|
||
|
|
|
|
|
Цитруллин |
|
2. В цитозоле аргининосукцинатсинтетаза с затратой 1 АТФ (двух макроэргических связей) связывает цитруллин с аспартатом и образует аргининосукцинат (аргининоянтарная кислота). Фермент нуждается в Mg2+. Аспартат — источник второго атома азота мочевины.
NH2 |
|
|
|
|
|
|
NH |
|
|
COOH |
||||
|
|
|
|
|
|
|
|
H |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
C |
|
|
O |
|
|
COOH |
ÀÒÔ ÀÌ Ô + ÔÔí |
C |
N |
|
CH |
|||
|
|
|
|
|
||||||||||
|
|
|
||||||||||||
|
|
H2N |
|
CH |
NH |
|
|
CH2 |
||||||
NH |
|
|
|
|
|
|||||||||
|
|
|
Mg2+ |
|
|
|||||||||
|
|
|
|
|
|
|
|
(CH 2)3 |
|
|||||
(CH 2)3 |
+ |
|
CH2 |
|
|
|
COOH |
|||||||
|
|
Аргин ин о сукцин ат - |
||||||||||||
|
|
|
|
|
|
|
|
HC |
|
NH2 |
|
|||
|
|
|
|
|
|
|
|
|
|
|||||
HC |
NH2 |
|
|
COOH |
|
|||||||||
|
|
ñèí ò åò àçà |
|
|
|
|
|
|
||||||
COOH |
|
|
|
|
|
COOH |
|
|||||||
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
||||
Цитруллин |
|
Асп артат |
|
|
Аргин ин о сукцин ат |
|||||||||
143
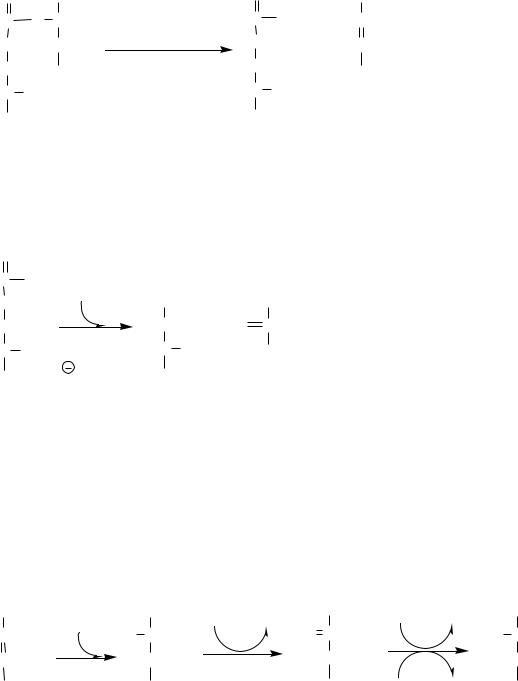
3. В цитозоле аргининосукцинатлиаза (аргининсукциназа) расщепляет аргининосукцинат на аргинин и фумарат (аминогруппа аспартата оказывается в аргинине).
NH |
COOH |
NH |
|
|
|
COOH |
||
|
H |
|
|
C |
NH2 |
|
|
|
C |
N |
CH |
|
|
CH |
|||
NH |
|
CH |
2 |
NH |
|
|
|
CH |
|
|
|
|
|
|
|
|
|
(CH |
) |
|
|
(CH |
) |
|
|
|
COOH |
2 3 |
|
+ |
COOH |
||||
|
2 3 |
|
|
|
||||
HC |
NH2 |
|
Арги н и н о сукци н ат - |
HC |
NH |
2 |
|
|
|
|
|
|
|
||||
COOH |
|
ëè àçà |
COOH |
|
|
|
||
Аргин ин о сукцин ат |
Аргин ин |
|
Ôóì àðàò |
|||||
|
|
|||||||
4. В цитозоле аргиназа гидролизует аргинин на орнитин и мочевину. У аргиназы кофакторы ионы Са2+ или Мn2+, ингибиторы - высокие концентрации орнитина и лизина.
NH |
|
|
|
|
|
|
|
|
|
|
|
|
C |
NH |
2 |
Í |
|
Î |
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
NH |
|
|
|
|
|
NH |
|
|
|
NH |
|
|
|
|
|
|
|
2+ |
2 |
|
|
2 |
|||
|
|
|
|
|
|
Ñà |
|
|
|
|
||
(CH |
2)3 |
|
|
|
|
|
(CH |
2)3 |
+ |
O |
C |
|
HC |
NH |
|
|
Àðãè í è í àçà |
HC |
NH2 |
|
|
NH |
|
||
2 |
|
|
|
|
|
2 |
||||||
|
|
|
|
|
|
|
|
|
|
|||
COOH |
|
|
|
î ðí èòèí |
COOH |
|
Ì |
о чевин а |
||||
|
|
|
лизин |
|
||||||||
|
|
|
|
|
Î ðí èòèí |
|
|
|
|
|||
Аргин ин |
|
|
|
|
|
|
|
|||||
Образующийся орнитин взаимодействует с новой молекулой карбамоилфосфата, и цикл замыкается.
Регенерация аспартата из фумарата
Фумарат, образующийся в орнитиновом цикле, в цитозоле превращается в ЩУК, который переаминируется с аланином или глутаматом с образованием аспартата. Аланин поступает главным образом из мышц и клеток кишечника:
COOH |
Í |
Î |
|
COOH |
+ |
Í ÀÄÍ |
|
COOH |
àëà |
Ï ÂÊ |
COOH |
||
|
|
|
|
Í ÀÄ |
2 |
|
|
|
|||||
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
ÍÎ |
CH |
|
|
|
Î |
C |
|
HN |
CH |
|
CH |
|
|
|
CH |
2 |
|
|
|
CH2 |
|
|
CH |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
||
COOH |
|
|
|
COOH |
|
|
|
COOH |
ãëó |
à-ÊÃ |
COOH |
||
Ôóì àðàò |
|
|
|
Ì àëàò |
|
|
|
Ù ÓÊ |
|
|
àñï |
||
Малат может направиться в митохондрии и включиться в ЦТК.
Пируват, образующийся в этих реакциях из аланина, используется для глюконеогенеза.
Общее уравнение синтеза мочевины:
144
CO2 + NH3 + асп + 3 АТФ + 2 Н2О → мочевина + фумарат + 2АДФ + АМФ + 2Фн + ФФн
|
|
|
|
|
|
|
|
|
|
|
|
Ам и н о т расф ераза |
||||
|
|
|
|
|
|
|
|
|
|
|
NH3 |
ÀÊ1 |
|
|
|
Кето кисло та1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
Î ðí è òè í î âû é öè ê ë |
à-ÊÃ |
|
ãëó |
|||||||||
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ãëó-ÄÃ |
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
NH3 |
|
|
|
ÖÈÒÎ ÇÎ ËÜ |
|
|
|
|
|
|
|
|
|
2ÀÒÔ |
||||||
|
|
|
|
|
|
|
H2N |
|
|
C |
NH2 |
ÑÎ 2 |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
Í 2Î |
|
|
|
|
Карбам о и лф о сф ат - |
|||||||
|
|
|
|
|
Ì |
о чевин а |
|
|||||||||
|
|
|
|
|
|
|
|
ñè í ò åò àçà |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
Аргин ин |
|
|
|
|
|
|
Î ðí èòèí |
|
|
|
2ÀÄÔ + Ôí |
||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
Àðãè í è í àçà |
|
|
Карбам о илф о сф ат |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Ôóì àðàò |
|
Арги н и н о сукци н ат ли аза |
О рн и т и н карбо м о и л- |
|||||||||||||
|
|
|
|
Арги н и н о сукци н ат - |
т ран сф ераза |
|||||||||||
|
|
|
|
|
|
|
|
|
||||||||
Аргин ин о сукцин ат |
ñè í ò åò àçà |
цитруллин |
Ôí |
|
|
|
|
|||||||||
|
|
|
|
|
|
|
||||||||||
ì àëàò |
|
|
Ù ÓÊ |
ÀÌ Ô +Ôí |
ÀÒÔ |
àñï |
Ì ÈÒÎ ÕÎ Í ÄÐÈß |
|||||||||
|
|
|
|
|
|
|
|
|
||||||||
глу а-КГ Кето кисло та2 ÀÊ2
ÀÊ2
Энергетический баланс орнитинового цикла
На синтез 1 мочевины расходуются 4 макроэргических связи 3 АТФ. Дополнительные затраты энергии связаны с трансмембранным переносом веществ и экскрецией мочевины. Энергозатраты при этом частично компенсируются:
при окислительном дезаминировании глутамата образуется 1 молекула НАДН2, которая обеспечивает синтез 3 АТФ;
в ЦТК, при превращении малата в ЩУК образуется еще 1 молекула НАДН2, которая также обеспечивает синтез 3 АТФ;
Орнитиновый цикл в печени выполняет 2 функции:
1.превращение азота АК в мочевину, которая экскретируется и предотвращает накопление токсичных продуктов, главным образом аммиака;
2.синтез аргинина и пополнение его фонда в организме.
Полный набор ферментов орнитинового цикла есть только в гепатоцитах.
Отдельные же ферменты орнитинового цикла обнаруживаются в разных
145
тканях. В энтероцитах, есть карбамоилфосфатсинтетаза I и орнитинкарбамоилтрансфераза, следовательно, может синтезироваться цитруллин. В почках есть аргининосукцинатсинтетаза и аргининосукцинатлиаза. Цитруллин, образовавшийся в энтероцитах, может поступать в почки и превращаться там в аргинин, который переносится в печень и гидролизуется аргиназой. Активность этих рассеянных по разным органам ферментов значительно ниже, чем в печени.
Выделение азота из организма
Азот выводиться из организма с мочой, калом, потом и с выдыхаемым воздухом в виде различных соединений. Основная масса азота выделяется из организма с мочой в виде мочевины (до 90%). В норме соотношение азотсодержащих веществ в моче составляет: мочевина 86%, креатинин 5%, аммиак 3%, мочевая кислота 1,5% и другие вещества 4,5%. Экскреция мочевины в норме составляет 25 г/сут, солей аммония 0,5 г/сут.
46. Частные пути обмена аминокислот (а –е): особенности в детском возрасте, биохимические механизмы развития
нарушений обмена. глу, глутамина асп
серина, глицина цистеина, метионина фениланина и тирозина
патология обмена фенилаланина и тирозина
|
|
|
|
|
|
ГЛУТАМИН |
|
|
|
|
|
|
Синтез глутамина |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
NH |
|
|
|
|
|
|
|
|
|
|
|
NH2 |
3 |
|
|
|
|
|
NH2 |
|
|
|
H |
|
2+ |
|
|
H |
|
||||
|
|
|
|
Mg |
|
|
|
|
||||
HOOC |
C |
C |
2 |
C |
COOH |
H NOC |
C |
C |
2 |
CH |
COOH |
|
|
|
|||||||||||
|
H |
|
2 |
|
H |
|
|
|
|
|||
|
H |
|
|
|
|
|
|
|
|
|
||
|
2 |
|
|
|
|
|
|
2 |
|
|
|
|
|
глутам ат |
ÀÒÔ |
ÀÄÔ + Ôí |
|
глутам ин |
|
||||||
|
|
|
|
|
Ãëóò àì èí ñèí ò àçà |
ÀÌ Ô, ãëþ êî çî -6ô , ãëè, àëà è ãèñ |
||||||
Использование глутамина
1.Используется в синтезе белков, углеводов;
2.Источник азота в синтезе пуриновых и пиримидиновых оснований, аспарагина, аминосахаров;
3.Обеспечивает транспорт азота из тканей;
АСПАРТАТ
Синтез аспартата
146

|
|
|
|
O |
Ãëó |
à-ÊÃ |
|
NH |
|
|
|
|
|
|
|
|
|
||
|
|
H |
|
|
|
|
H |
2 |
|
|
|
2 |
|
|
|
2 |
|
||
Ãëþ êî çà |
HOOC |
C |
|
C |
COOH |
HOOC |
C |
C |
COOH |
|
|
|
|
|
ÀÑÒ |
|
H |
|
|
|
|
|
|
|
асп артат |
||||
|
|
Ù ÓÊ |
|
|
|||||
|
|
|
|
|
|
|
|||
Использование аспартата
1.Используется в синтезе белков, липидов, углеводов;
2.Участвует в орнитиновом цикле при синтезе мочевины;
3.Участвует в синтезе карнозина, анзерина, пуриновых и пиримидиновых нуклеотидов, N-ацетиласпарагиновой кислоты.
АСПАРАГИН
Синтез аспарагина
|
|
|
NH2 |
NH3 |
(èëè ãëí ) |
|
H2N |
|
||
|
|
H2 |
|
|
|
|
H2 |
|
||
|
|
|
|
|
|
|
|
COOH |
||
HOOC |
|
C |
C |
COOH |
|
|
H2NOC C |
C |
||
|
|
|
||||||||
|
|
|
H |
|
|
|
|
|
H |
|
асп артат |
ÀÒÔ |
ÀÌ Ô + ÔÔí |
асп арагин |
|||||||
|
|
|
||||||||
|
|
|
|
|
|
|
||||
Асп арагин син т аза
Использование аспарагина
1.Используется в синтезе белков, липидов, углеводов;
|
|
|
|
|
|
|
|
|
|
ОБМЕН СЕРИНА И ГЛИЦИНА |
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Серин и глицин - заменимые аминокислоты. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
Синтез серина: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
COOH |
Í ÀÄ+ Í ÀÄÍ |
2 COOH |
|
Ãëó à-ÊÃ |
COOH |
H2O Ôí |
COOH |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
ãëþ êî çà |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HC OH |
|
ÄÃ |
|
C |
|
O |
|
|
|
|
HC |
|
NH2 |
ô î ñô î ò àçà |
HC |
|
NH2 |
||||||||||
|
H C |
|
|
OPO H |
|
H C |
|
|
OPO H |
|
Àì èí î ò ðàí ñ- H C |
|
|
OPO H |
H C |
|
|
OH |
||||||||||
|
|
|
2 |
|
|
|
2 |
|
|
2 |
|
|
|
|
||||||||||||||
|
2 |
|
|
|
3 |
|
2 |
3 |
ф ераза |
2 |
|
3 |
|
|
2 |
|
|
|
||||||||||
|
3-ф о сф о глицерат |
3-ô î ñô î î êñè- |
3-Фо сф о серин |
|
|
Ñåðè í |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
п ируват
Обмен глицина:
Основной путь синтеза
1). |
COOH ÒÃÔÊ N5N10-м етилен -ТГФК Н 2Î |
COOH |
|||||||||
|
HC |
|
NH2 |
|
|
|
|
||||
|
|
|
|
|
|
H2C |
|
NH2 |
|||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
||
|
H2C OH |
Серин о ксим ет илт ран сф ераза |
|
||||||||
|
|
|
|
|
|||||||
|
Серин |
|
Ãë è öè í |
||||||||
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
||||
Основной путь катаболизма (в митохондриях печени)
147
|
|
|
ÒÃÔÊ |
5 |
10 |
-м етилен -ТГФК |
Í |
+ |
Í ÀÄÍ |
|
|
|
||
2). |
|
|
N |
N |
ÀÄ |
2 |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
COOH |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
ÑÎ |
2 |
+ NH |
H C |
NH |
|
|
|
|
|
|
|
|
|
||||
2 |
|
|
|
|
|
|
|
|
|
3 |
||||
2 |
|
|
|
|
|
|
Глицин син т аза |
|
|
|
|
|
||
Ãë è öè í |
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
Путь образования оксалатов из глицина |
|
|
|
|
||||
|
|
|
|
|
|
a-ÊÃ |
Ãëó |
[O] |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
COOH |
|
|
|
COOH |
|
|
COOH |
|
|
||
|
|
H C |
NH |
2 |
|
|
HC O |
|
|
COOH |
|
|
||
|
|
|
2 |
|
|
|
|
|
|
|
|
|||
|
|
Ãë è öè í |
|
|
|
Глио ксилат |
|
О ксалат |
|
|
||||
|
|
|
Гл и ци н ам и н о тран сф ераза |
|
|
|
|
|
|
|||||
Схема путей обмена серина и глицина
Серии и глицин выполняют в организме человека разнообразные и очень важные функции.
|
|
|
|
|
|
|
|
ãëþ êî çà |
|
|
|
Глицерат |
|
|
|
|
3-ф о сф о глицерат |
Ï ÂÊ |
|||||
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
||
î êñèÏ ÂÊ |
|
|
|
|
|
|
Ñåðè í |
|
Цистеин |
||
|
|
|
|
|
|
|
Ñô èí ãî ëèï èäû |
||||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
ÒÃÔÊ |
Ôî ñô î ëèï èäû |
|||||||
|
|
|
|
|
|||||||
БЕЛКИ |
|
|
м етилен -ТГФК |
Ëèï èäû |
|||||||
|
|
|
|||||||||
|
|
|
Ãåì , ï î ðô èðèí û |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
òðåî í èí |
|
|
|
|
|
|
Ãë è öè í |
|
|
П урин о вы е н уклео тиды |
|
|
|
|
|
|
|
|
Í ÀÄ, ÔÀÄ |
||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ÒÃÔÊ |
|
Глутатио н |
||||||
|
|
|
|
Креатин |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
м етилен -ТГФК |
Гип п уро вая кисло та |
|||||||
|
|
|
Ко н ъю г. желчн ы е кисло ты |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ÑÎ 2 + NH3 |
|
|
|
Глицин — важнейший (после ГАМК) тормозной нейромедиатор в спинном мозге, промежуточном мозге и некоторых отделах головного мозга.
Наследственные нарушения обмена глицина
Известно несколько заболеваний, связанных с нарушениями обмена глицина. В их основе лежит недостаточность ферментов или дефект системы транспорта этой АК.
Гиперглицинемия возникает при дефекте глицинрасщепляющей системы. Проявляется повреждением мозга, судорогами, гипотонией, нарушением дыхания.
Глицинурия характеризуется повышенным выделением глицина с мочой (до 1 г/сут) при нормальном содержании его в крови. Причиной является нарушение реабсорбции глицина в почках.
Первичная гипероксалатурия характеризуется постоянно высоким выделением оксалата с мочой, независимо от поступления его с пищей. Дефект глицинаминотрансферазы блокирует превращение глиоксилата снова в глицин. Глицин → глиоксилат → оксалат
Прогрессирует двустороннее образование оксалатных камней в мочевыводящих путях, развиваются нефрокальциноз и инфекция мочевыводящих путей. Больные погибают в детском возрасте от почечной недостаточности или гипертонии.
148
В состав белков человека входят 2 АК, содержащие серу, — метионин и цистеин. Эти аминокислоты метаболически тесно связаны между собой.
МЕТИОНИН
Метионин — незаменимая аминокислота, может регенерировать из гомоцистеина с участием серина и глицина. Метионин:
1.участвует в синтезе белков организма;
2.является источником метильной группы, используемой в реакциях трансметилирования;
3.является источником атома серы, необходимого для синтеза цистеина;
4.участвует в реакциях дезаминирования;
5.Метионил-тРНК участвует в инициации процесса трансляции.
Образование S-аденозилметионина
Метильная группа в метионине прочно связана с серой, поэтому донором этого одноуглеродного фрагмента служит активная форма метионина - S-аденозилметионин (SAM). (SAM — нестабилен т.к. сера при валентности 2 имеет 3 связи). SAM образуется при присоединении метионина к аденозину с участием метионинаденозилтрансферазы (есть во всех типах клеток). Аденозин образуется при гидролизе АТФ.
Ресинтез метионина, роль ТГФК и витамина В12.
Связь обменов метионина и цистеина
CH3 |
|
|
|
|
ÀÒÔ |
|
ÔÔí + Ôí |
CH3 |
|
|
|
|
|
|
|
|
À R |
R-CH3 HS |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
S |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+S |
|
|
|
|
ÑÍ 2 |
|
|
Î |
|
|
|
|
|
ÑÍ 2 |
|
Î |
|
Аденин |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
CH |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
Ì |
åò è î í è í àäåí î çè ë- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
CH2 |
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
т ран сф ераза |
|
|
|
|
|
|
|
|
|
Í |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Í |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NH2 ÎÍ |
|
|
|
|
ÎÍ |
|
|
|
|
|
|
|
|
|
|
|
NH2 ÎÍ |
|
|
ÎÍ |
|||||||||||||||||
CH |
|
|
NH |
2 |
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|
|
|
|
|
Ì |
åò è ë- |
|
CH |
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CÎÎÍ |
|
|
|
|
Ñåð |
|
|
|
|
|
|
|
|
CÎÎÍ |
|
|
|
|
|
|
(SAM) |
т ран сф ераза |
CÎÎÍ |
|
|
|
|
(SAÃ) |
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
Ãëè |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
Ì åòèî í èí |
|
|
|
|
|
|
|
|
|
|
S-àäåí î çèëì åòèî í èí |
|
|
|
|
|
|
|
S-аден о зилго м о цистеин |
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
ÒÃÔÊ |
|
|
ì åòèë-ÒÃÔÊ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SH |
|
|
|
|
|
+Í 2Î |
|
ãè äðî ëàçà |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
ì åòèë-Â12 |
Â12 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
2 |
|
|
|
|
|
|
|
|
|
ÑÍ 2ÎÍ |
|
Î |
|
Аденин |
||||
|
|
|
|
|
|
|
|
|
|
Го м о ци ст еи н м ет и лт ран сф ераза |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|
NH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CÎÎÍ |
|
|
|
|
|
|
|
|
|
|
|
|
|
Í |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
ÎH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Го м о цистеин |
|
|
|
|
ÎÍ |
|
ÎÍ |
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Í 2Î H C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Àäåí î çèí |
|
|
||||||||||||||
SH |
|
|
|
|
|
|
|
|
|
|
|
|
|
S |
CH |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
CH2 |
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ÎH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH NH2 |
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
CH2 |
|
|
|
|
|
+ CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
CH |
|
NH |
|
|
|
|
|
|
|
|
|
|
 |
|
|
CÎÎÍ |
|
|
|
CH |
|
|
NH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 |
|
|
|
CH NH2 |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
2 |
|
|
|
CH |
|
|
NH |
2 |
6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CÎÎÍ |
|
|
Í 2Î |
6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
CÎÎÍ |
|
|
|
|
|
|
|
CÎÎÍ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CÎÎÍ |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
Öè ñòåè í |
|
|
Го м о серин |
|
|
|
Цистатио н ин |
|
|
|
|
|
|
|
|
Ñåð |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
à-ÊÃ |
Öè ñò àò è î í è í ëè àçà |
|
Öè ñò àò è î í è í ñè í ò àçà |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
ãëó 
CH3
CH2 C  O
O
CÎÎÍ
а-Кето бутират
Реакции трансметилирования с участием S-аденозилметионина
Отщепление метильной группы от SAM и перенос её на соединение-акцептор катализируют ферменты метилтрансферазы. SAM в ходе реакции превращается в S-аденозилгомоцистеин (SAT).
149
Синтез холина
|
|
ÎÍ |
|
|
|
|
|
CO |
|
|
|
|
ÎÍ |
|
|
3SAM |
3SAÃ |
|
ÎÍ |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
2 |
|
|
|
|
|
|
|
|
|
CH |
2 |
|
|
|
|
|
|
CH |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
NH |
2 |
сери н декарбо кси лаза |
CH |
2 |
|
Ýò àí î ëàì è í - |
|
CH |
2 |
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
CÎÎÍ |
|
|
|
|
|
+ |
|
|
) |
+ |
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
NH |
|
ì |
ет и лт ран сф ераза |
N (CH |
|
|
|
|
|
|||||||||
|
|
Серин |
|
|
|
|
|
|
|
|
|
2 |
|
|
3 3 |
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Õî ëèí |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
Ýòàí î ëàì èí |
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
Синтез лецитина |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
O |
|
|
|
|
|
|
3SAM |
3SAÃ |
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
Í |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Í |
|
|
|
|
|
|
||||
|
|
HC |
P |
Î |
C |
CH |
|
NH |
|
|
|
|
|
|
|
|
|
HC |
P |
|
|
|
CH |
|
+ |
|
|||
|
O |
2 |
2 |
|
|
|
|
|
|
|
|
|
Î |
|
C |
|
) |
||||||||||||
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
O |
|
|
|
2 |
N (CH |
|||||||||
|
|
|
|
OH |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
2 |
3 3 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|||||||
R |
C |
O |
CH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
C |
O |
CH |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
1 |
|
|
|
|
|
|
|
|
|
|
Ì |
ет илт ран сф ераза |
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
||||||
R |
C |
O |
CH |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
R |
C |
O |
CH |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
Фо сф атидилэтан о лам ин |
|
|
|
|
|
|
|
O |
Фо сф атидилхо лин |
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
Аналогично синтезируются:
1.из ГАМК → карнитин;
2.из гуанидинацетата → креатин;
3.из норадреналина → адреналин;
4.из карнозина → анзерин;
5.Реакции трансметилирования используются также в синтезе азотистых оснований, инактивации гормонов, нейромедиаторов и обезвреживании ксенобиотиков.
ЦИСТЕИН
Цистеин – серосодержащая условнозаменимая АК. Синтезируется из незаменимого метионина и заменимого серина.
Нарушение синтеза цистеина возникает при гиповитаминозе фолиевой кислоты, В6, В12 или наследственных дефектах цистатионинсинтазы и цистатионинлиазы. Гомоцистеин превращается в гомоцистин, который накапливается в крови, тканях и выделяется с мочой.
Обмен цистеина: схема путей, их значение.
Цистеин:
1.используется в белках для формирования третичной структуры (дисульфидные мостики);
2.SH группы цистеина формируют активный центр многих ферментов;
3.идет на синтез глутатиона, таурина (парные желчные кислоты), НS-КоА, ПВК (глюкоза);
4.Является источником сульфатов, которые идут на синтез ФАФС или выделяются с мочой.
Образование сульфат-иона, его утилизация (образование ФАФС).
150
SH |
|
Î |
|
|
SO H |
|
|
à-ÊÃ |
ãëó |
|
SO H |
|
|
|
CH |
3 |
|
||
|
|
2 |
|
2 |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H C |
|
|
|
|
H C |
|
|
|
|
|
|
H C |
|
|
|
|
C |
|
O |
2 |
|
|
|
|
2 |
|
|
|
|
|
|
2 |
|
|
|
|
|
||
CH NH |
2 |
|
|
|
CH NH |
2 |
ам и н о т ран сф ераза |
C |
O |
|
|
|
CÎÎÍ |
|
|||||
|
Öè ñò åèí - |
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
п ируват |
|||||||||
CÎÎÍ |
|
CÎÎÍ |
|
|
|
|
|
|
CÎÎÍ |
|
2- |
|
|||||||
|
ди о ксиген аза |
|
|
|
|
|
|
SO |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Цистеин |
|
Цистеин - |
|
|
сульф ин ил- |
3 |
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
сульф ин ат |
|
|
|
п ируват |
SO |
2- |
ÀÒÔ |
ÀÄÔ |
||||||
|
|
|
|
Î |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
2 |
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ÑÎ |
2 |
|
|
ÀÒÔ |
|
|
ÔÀÑ |
ÔÀÔÑ |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
SO H |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
SO H |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
H C |
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
CH2 |
|
|
п арн ы е желчн ы е кисло ты |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
CH |
NH |
|
|
CH |
NH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
CÎÎÍ |
|
|
|
|
Таурин |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Цистеин о вая |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
кисло та |
|
|
|
|
|
|
|
|
|
|
|
|
||
ФАФС используется: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
1. В обезвреживании ксенобиотиков: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
CH3 |
|
|
|
|
CH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ÔÀÔÑ |
ÔÀÔ |
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ÔÀÔÑ |
ÔÀÔ |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
сульф о т ран сф ераза |
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
сульф о т ран сф ераза |
O |
|
|
|||||||||
OH |
|
|
|
|
O |
|
|
S |
OH |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
O |
S |
|
OH |
|
Крезо л |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Крезо лсерн ая |
|
Ôåí î ë |
|
|
|
Фен о лсерн ая O |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
кисло та |
|
|
|
|
|
|
|
|
кисло та |
|
|
|
||
2. В синтезе гликозаминогликанов (сульфирование ОН групп производных глюкозы, галактозы сульфотрансферазой).
ФЕНИЛАЛАНИН
Фенилаланин — незаменимая АК, которая содержится в достаточных количествах в пищевых продуктах. Фенилаланин идет в основном на синтез белков и тирозина.
|
OH |
Î 2 |
|
Fe2+ |
|
CH2 |
CH2 |
HC NH2 |
HC NH2 |
COOH |
COOH |
Превращение фенилаланина в тирозин необратимо катализирует фенилаланингидроксилаза (монооксигеназа), коферментом которой служит тетрагидробиоптерин (Н4БП), кофактором - Fe2+. Н4БП в результате реакции окисляется в дигидробиоптерин (Н2БП). Регенерация последнего происходит при участии дигидроптеридинредуктазы с использованием НАДФH2.
Реакция необходима для удаления избытка фенилаланина, так как высокие концентрации его токсичны для клеток. Образование тирозина не имеет большого значения, так как недостатка этой аминокислоты в клетках практически не бывает.
Ôåí |
Òèð |
Ôен и лалан и н -
ìî í î î êñè ãåí àçà
Фенилкетонурия
151
В печени здоровых людей небольшая часть фенилаланина (10%) превращается в фениллактат и фенилацетилглутамин. При дефекте фенилаланингидроксилазы этот путь катаболизма фенилаланина становится главным, что способствует развитию фенилкетонурии (ФКУ).
Классическая ФКУ — наследственное заболевание, связанное с мутациями в гене фенилаланингидроксилазы (частота 1:10000 новорождённых), которые приводят к снижению активности фермента или полной его инактивации.
При ФКУ концентрация фен повышается в крови в 20—30 раз, в моче — в 100—300 раз по сравнению с нормой. В крови и моче повышается содержание метаболитов альтернативного пути: фенилпирувата, фенилацетата, фениллактата и фенилацетилглутамина.
Проявления ФКУ:
1.нарушение умственного и физического развития;
2.судорожный синдром;
3.нарушение пигментации.
Проявления ФКУ связаны с токсическим действием на клетки мозга высоких концентраций фенилаланина, фенилпирувата, фениллактата. Большие концентрации фенилаланина ограничивают транспорт тирозина и триптофана через гематоэнцефалический барьер и тормозят синтез нейромедиаторов (дофамина, норадреналина, серотонина).
Прогрессирующее нарушение умственного и физического развития у детей, больных ФКУ, можно предотвратить диетой с очень низким содержанием или полным исключением фенилаланина. Если такое лечение начато сразу после рождения ребёнка, то повреждение мозга предотвращается. Считается, что ограничения в питании могут быть ослаблены после 10-летнего возраста (окончание процессов миелинизации мозга), однако в настоящее время многие педиатры склоняются в сторону «пожизненной диеты». При отсутствии лечения больные не доживают до 30 лет.
Для диагностики ФКУ используют качественные и количественные методы обнаружения патологических метаболитов в моче, определение концентрации фенилаланина в крови и моче.
Дефектный ген, ответственный за фенилкетонурию, можно обнаружить у фенотипически нормальных гетерозиготных носителей с помощью теста толерантности к фенилаланину.
Òè ðî çèí - |
|
|
|
|
|
|
|
|
|
||||
ам и н о т ран сф ераза |
|
Í ÀÄÍ 2 Í ÀÄ+ |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
à-ÊÃ ãëó |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
CH2 |
||||
 |
|
|
|
|
Í ÀÄ+ Í ÀÄÍ 2 |
HC |
|
OH |
|||||
|
|
|
|
|
|||||||||
6 |
|
|
|
|
|
|
|
|
|
|
|||
CH2 |
CH2 |
|
COOH |
||||||||||
|
ф ен иллактат |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
||||
HC |
|
NH2 |
C |
|
O |
|
Ãëí Í 2Î |
||||||
|
|
|
|||||||||||
|
|
|
|||||||||||
COOH |
COOH |
|
|||||||||||
Ôåí |
|
|
|
ô åí èë- |
H2O CO2 |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
п ируват |
|
|
|
|
|
|||
CH2 |
|
|
CH2 |
|
|
|
|
||
|
O |
|
|
|
H |
|
H |
|
|
COOH |
|
C |
|
N |
|
C |
|
COOH |
|
|
|
|
|
||||||
Фен илацетат |
CH2 |
|
|
|
CH2 |
CONH 2
Фен илацетилглутам ин
ТИРОЗИН
Тирозин — условно заменимая АК, образуется из незаменимого фенилаланина. Содержание тир в пищевых белках достаточно
велико.
Тирозин используется в синтезе белков, катехоламинов, тиреоидных гормонов и меланинов. Обмен тирозина зависит от типа
тканей.
1.Обмен тирозина в надпочечниках и нервной ткани
Вмозговом веществе надпочечников и нервной ткани тирозин метаболизирует по катехоламиновому пути с образованием дофамина, норадреналина и адреналина (только в надпочечниках).
152
|
н о радрен алин |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
Î 2 |
OH |
|
|
ÑÎ |
OH |
|
|
|
OH |
|
|
|
OH |
|
|
|
|
|
|
|
2 |
|
|
|
Î |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
OH |
|
|
OH |
2 |
|
OH |
|
|
|
OH |
||||
|
|
|
|
|
|
|
|
|
|
||||||||
|
2+ |
|
|
|
B |
|
|
|
âèò. Ñ |
|
|
|
|
|
|
|
|
|
Fe |
|
|
|
|
|
|
|
|
SAM |
SAÃ |
|
|
||||
|
|
|
|
6 |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
2+ |
|
|
|
|
|
|
|
CH2 |
CH |
2 |
|
|
CH |
2 |
|
Cu |
HC |
ÎÍ |
|
|
HC |
ÎÍ |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
HC |
NH2 |
HC |
NH |
2 |
|
H C |
|
NH |
2 |
|
H C |
NH |
2 |
|
H2C |
|
|
|
|
|
|
|
2 |
|
|
|
2 |
|
|
|
|
|
|||
COOH |
COOH |
|
|
äî ô àì èí |
|
|
н о радрен алин |
|
NÍCH |
3 |
|||||||
|
|
|
|
|
|
|
|||||||||||
Òèð |
ÄÎ ÔÀ |
|
|
|
|
|
|
|
|
|
|
|
адрен алин |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
Òè ðî çè í - |
|
|
ÄÎ Ô À- |
|
|
äî ô àì è í - |
|
ì |
åò è ë- |
|
|
|||||
ì |
î í î î êñè ãåí àçà |
декарбо кси лаза |
ì |
î í î î êñè ãåí àçà |
т ран сф ераза |
|
|
||||||||||
Тирозингидроксилаза (тирозинмонооксигеназа) Fe2+ -зависимый фермент, в качестве кофермента использующий Н4БП. Ее ингибирует норадреналин.
Дофамин и норадреналин служат медиаторами в синаптической передаче нервных импульсов, а адреналин — гормон широкого спектра действия, регулирующий энергетический обмен. Одна из функций катехоламинов — регуляция деятельности ССС.
Нарушение синтеза катехоламинов может вызывать различные нервно-психические заболевания, причём патологические отклонения наблюдаются как при снижении, так и при увеличении их количества. Снижение в нервных клетках содержания дофамина и норадреналина часто приводит к депрессивным состояниям. При шизофрении в височной доле мозга наблюдается гиперсекреция дофамина.
Болезнь Паркинсона
Болезнь Паркинсона развивается при снижении активности тирозинмонооксигеназы и ДОФА-декарбоксилазы, что приводит к недостаточности дофамина в чёрной субстанции мозга. Это одно из самых распространённых неврологических заболеваний (частота 1:200 среди людей старше 60 лет). Заболевание сопровождается акинезией (скованность движений), ригидностью (напряжение мышц) и тремором (непроизвольное дрожание).
Дофамин не проникает через гематоэнцефалический барьер и как лекарственный препарат не используется. Для лечения паркинсонизма используют заместительную терапию препаратами-предшественниками дофамина (производными ДОФА) — леводопа, мадопар, наком и др. Также подавляют инактивацию дофамина ингибиторами МАО (депренил, ниаламид, пиразидол и др.).
2.Обмен тирозина в меланоцитах
Впигментных клетках (меланоцитах) обмен тирозин идет по меланиновому пути. Из тирозина синтезируются пигменты — меланины 2 типов: эумеланины и феомеланины. Эумеланины (чёрного и коричневого цвета) — нерастворимые высокомолекулярные полимеры 5,6-дигидроксииндола. Феомеланины — жёлтые или красновато-коричневые полимеры, растворимые в разбавленных щелочах.
Меланины присутствуют в сетчатке глаз, в составе волос, в коже. Цвет кожи зависит от распределения меланоцитов и количества в них разных типов меланинов.
OH |
OH |
O |
|
|
Î 2 |
OH |
|
COOH |
Ýóì åë àí è í û |
|
|
|||
|
|
O |
N |
(÷åðí û å è êî ðè÷í åâû å) |
Cu2+ |
|
H |
|
|
|
|
|
||
|
ДО ФАхро м |
|
||
|
|
|
||
CH2 |
CH |
|
N |
|
|
2 |
|
|
|
HC NH2 |
HC NH2 |
NH2 |
|
Ôåî ì åë àí è í û |
|
|
|
(желты е, красн о -ко ричн евы е) |
|
COOH |
COOH |
HC C |
S |
|
Òèð |
ÄÎ ÔÀ |
|
||
H2 |
|
|||
Òè ðî çè í àçà |
COOH |
Бен зо тиазин |
|
|
Альбинизм
При наследственном дефекте тирозиназы (1:20000) в меланоцитах нарушается синтез меланинов и развивается альбинизм.
Клиническое проявление альбинизма (от лат. albus — белый) — отсутствие пигментации кожи, сетчатки глаз и волос. У больных часто снижена острота зрения, возникает светобоязнь. Длительное пребывание таких больных под открытым солнцем приводит к раку кожи.
153
3.Превращение тирозина в щитовидной железе
Вщитовидной железе из тирозина синтезируются и выделяются гормоны йодтиронины: тироксин (тетрайодтиронин) и трийодтиронин.
5.Катаболизм тирозина в печени
Катаболизм тирозина происходит в печени по гомогентизиновому пути (схема). |
|
|
|
|
|
||||||||||||
|
|
Òè ðî çè í - |
ги дро кси ф ен и лп и руват - |
|
äè î êñè ãåí àçà |
|
|
|
|
||||||||
|
|
|
ãî ì î ãåí ò è çè í î âî é |
|
|
|
|
||||||||||
ам и н о т ран сф ераза |
äè î êñè ãåí àçà |
|
|
|
|
|
|||||||||||
|
|
êè ñëî ò û |
|
|
|
|
|||||||||||
OH |
|
|
OH |
|
|
|
|
OH |
|
|
OH |
|
|
|
|||
|
|
|
|
|
|
|
|
|
Î |
|
|
|
|
|
|
|
|
|
|
à-ÊÃ ãëó |
|
O |
2 |
CO |
|
|
|
2 |
2+ |
|
|
|
|
||
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Fe |
|
|
|
|
|
|
 |
|
|
|
|
|
2+ |
C |
COOH |
|
|
|
C |
COOH |
||
|
|
6 |
|
âèò. Ñ, |
Fe |
|
HOOC |
O |
|||||||||
|
|
|
|
|
H |
|
|
|
H |
||||||||
CH |
|
|
CH |
|
|
|
|
OH |
2 |
|
|
|
|
|
|
|
2 |
2 |
|
2 |
|
|
|
|
|
|
|
Фум арилацето ацетат |
|||||||
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
Го м о ген тизин о вая |
|
|
|||||||||
HC |
|
NH |
C |
O |
|
|
|
|
|
|
|
|
|
||||
|
|
2 |
|
|
|
|
|
кисло та |
|
|
|
COOH |
|
CH |
|
|
|
COOH |
COOH |
|
|
|
|
|
|
|
3 |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Òèð |
п -гидро ксиф ен ил- |
|
|
|
|
|
CH |
|
C |
|
O |
||||||
|
п ируват |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
CH |
|
CH |
2 |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
COOH |
|
COOH |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
Ôóì àðàò |
Ацето ацетат |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Ф ум ари лацет о ацет ат - |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
ãè äðî ëàçà |
|
|
|
|
Фумарат может окисляться до СО2 и Н2О или использоваться для глюконеогенеза. Ацетоацетат — кетоновое тело, окисляемое до СО2 и Н2О с выделением энергии.
Алкаптонурия («чёрная моча»)
При наследственном дефекте диоксигеназы гомогентизиновой кислоты (2—5 случаев на 1 млн новорождённых) развивается алкаптонурия. При алкаптонурии происходит накопление в организме гомогентизиновой кислоты, избытки которой выделяются с мочой. На воздухе гомогентизиновая кислота окисляется с образованием тёмных пигментов - алкаптонов.
Клиническими проявлениями болезни, кроме потемнения мочи на воздухе, являются пигментация соединительной ткани (охроноз) и артрит.
Тирозинемии
Некоторые нарушения катаболизма тирозина в печени приводят к тирозинемии и тирозинурии. Различают 3 типа тирозинемии.
1.Тирозинемия типа 1 (тирозиноз). Причиной заболевания является дефект фумарилацетоацетатгидролазы. Накапливающиеся метаболиты снижают активность некоторых ферментов и транспортных систем аминокислот. Патофизиология этого нарушения достаточно сложна. Острая форма тирозиноза характерна для новорождённых. Клинические проявления — диарея, рвота, задержка в развитии. Без лечения дети погибают в возрасте 6—8 мес из-за развивающейся недостаточности печени. Хроническая форма характеризуется сходными, но менее выраженными симптомами. Гибель наступает в возрасте 10 лет. Содержание тирозина в крови у больных в несколько раз превышает норму. Для лечения используют диету с пониженным содержанием тирозина и фенилаланина.
2.Тирозинемия типа II (синдром Рихнера—Ханхорта). Причина — дефект тирозинаминотрансферазы. Концентрация тирозина в крови больных повышена. Для заболевания характерны поражения глаз и кожи, умеренная умственная отсталость, нарушение координации движений.
3.Тирозинемия новорождённых (кратковременная). Заболевание возникает в результате снижения активности фермента п- гидроксифенилпируватдиоксигеназы. В результате в крови больных повышается концентрация п-гидроксифенилацетата, тирозина и фенилаланина. При лечении назначают бедную белком диету и витамин С.
154
