- •«Общая химия»
- •1. Основные понятия термодинамики. Термодинамические системы: определение, классификация
- •2. Кинетика химических реакций, классификация
- •3. Скорость химической реакции, факторы на нее влияющие
- •3. Температура. При повышении температуры на каждые 10°c скорость реакции возрастает в 2-4 раза (Правило Вант-Гоффа).
- •4. Зависимость скорости химической реакции от концентрации реагирующих веществ. Закон действующих масс
- •5. Зависимость скорости реакции от температуры. Энергия активации. Температурный коэффициент скорости и его особенности для биохимических процессов.
- •6. Химическое равновесие. Обратимые и необратимые реакции. Константа химического равновесия. Прогнозирование смещения химического равновесия. Принцип Ле-Шателье-Брауна
- •7. Катализ гомогенный и гетерогенный . Особенности ферментативного катализа
- •8. Физико-химические свойства воды, определяющие её роль в природе и организме. Биологически важные свойства воды. Примеры водородных связей в биологических системах
- •9. Растворы. Коллигативные свойства растворов. Закон Рауля
- •10. Диффузия и осмос. Осмотическое давление. Закон Вант-Гоффа. Осмолярность биологических жидкостей. Осмотически-активные компоненты плазмы крови
- •11. Биологическое значение осмотического давления. Поведение эритроцитов в растворах различной концентрации. Применение в медицине растворов различной осмолярности
- •12. Коллоидно-осмотическое давление крови. Гипотеза Старлинга как один из механизмов возникновения отеков
- •13. Ионное произведение воды и водородный показатель. Методы определения pН растворов. Индикаторы и их свойства
- •15. Реакция среды в растворах слабых кислот и оснований. Константа диссоциации. Реакция среды в растворах солей. Закон разведения Оствальда
- •16. Буферные системы: определение понятия, типии буферной системы. Буферная емкость и pН буферной системы
- •17. Механизм действия буферных систем. Буферные системы крови
- •18. Типы окислительно-восстановительных (редокс) реакций в организме
- •19. Строение комплексных соединений. Классификация и номенклатура
- •1. По знаку заряда комплекса:
- •2. По принадлежности комплексного соединения к определенному классу соединений:
- •3. По природе лиганда:
- •4. По внутренней структуре комплекса:
- •20. Понятие о хелатных соединениях. Хелатообразующие лиганды, примеры
- •21. Представление о строении гемопротеидов
- •22. Сорбция. Понятия адсорбции и абсорбции. Физическая и химическая адсорбция. Зависимость величины адсорбции от различных факторов
- •23. Дисперсные системы, их классификации
- •Классификация дисперсных систем по агрегатному состоянию фаз
- •24. Грубодисперсные системы: классификация, применение в медицине
- •25. Коллоидные растворы: строение коллоидной частицы, устойчивость коллоидных систем. Факторы, влияющие на устойчивость коллоидных систем. Коагуляция
- •26. Роль дисперсных систем в организме
- •4) Пространственная изомерия: Конфигурационная и Конформационная.
- •5) Симметрия молекул
- •1. Сопряжение. Сопряженные системы с открытой цепью
- •2. Замкнутые сопряженные системы. Ароматичность.
- •13)Классификация органических реакций по результату: замещения, присоединения, элиминирования, перегруппировки, овр.
- •14) Кислоты и основания по Бренстеду, их классификация.
- •15) Влияние различных факторов на кислотные и основные свойства веществ. Примеры.
- •16) Спирты и фенолы. Многотомные спирты.
- •19) Классификация карбоновых кислот: по основности, насыщенности, наличию функциональной группы, числу атомов углерода в цепи.
- •20) Химические свойства карбоновых кислот с участием карбоксильной группы : декарбоксилирование, образование солей, амидов, ангидридов, галоген-ангидридов, сложных эфиров.
- •21) Вжк: классификация, номенклатура, структура и физические свойства. Заменимые и незаменимые вжк, витамин f, функции в организме.
- •22) Дикарбоновые кислоты: щавелевая, малоновая, янтарная, глутаровая, фумаровая. Их роль в организме.
- •23) Оксо- и гидроксикарбоновые кислоты: пвк и молочная, яблочная и щавелевоуксусная, лимонная, ацетоуксусная и бета-гидроксимасляная, альфа-кетоглутаровая. Функции в организме.
- •24) Общее представление о липидах. Классификация липидов
- •25) Простые липиды: триацилглицеролы (таг): состав, номенклатура, свойства. Гидролиз таг. Биологическая роль.
- •26) Сложные липиды – глицерофосфолипиды. Строение и функции фосфатидилсерина, фосфатидилэтаноламина, фосфатидилхолина и фосфатидилинозитола.
- •27)Соединения стероидной природы: холестерин, желчные кислоты. Строение и роль.
- •28)Углеводы. Классификация. Функции
- •29)Моносахариды. Классификация. Хим. Свойства. Окислительно-восстановительные реакции.
- •I. Реакции по карбонильной группе
- •1. Окисление.
- •2. Восстановление.
- •II. Реакции по гидроксильным группам
- •III. Специфические реакции
- •30)Стереоизомерия моносахаридов d- и l-ряды. Открытые и циклические формулы. Пиранозы и фуранозы. Α- и β-аномеры. Циклоцепная таутомерия. Явление муторотации.
- •31)Строение
- •32)Строение
- •33)Полисахариды. Классификация. Функции
- •34)Дисахариды. Структура и свойства мальтозы, лактозы, сахарозы, целлобиозы
- •35)Гомополисахариды: крахмал (амилоза и амилопектин), гликоген, целлюлоза. Строение, свойства, биологическая роль
- •36)Гетерополисахариды: гиалуроновая кислота, хондроитинсульфаты. Строение, биологическая роль
- •37)Азотистые основания пуриновые (аденин, гуанин) и пиримидиновые (тимин, урацил, цитозин). Строение, лактим-лактамная таутомерия.
- •39)Нуклеотиды: строение, номенклатура, характер связи. Гидролиз нуклеотидов.
- •39) Свободные нуклеотиды: цамф и цгмф, атф, адф, фад, над. Строение, функции.
- •41) Первичная структура нуклеиновых кислот. Нуклеотидный состав днк и рнк.
- •42)Понятие о вторичной структуре днк. Комплементарность нуклеиновых оснований. Водородные связи в комплементарных парах нуклеиновых оснований.
- •43)Аминокислоты номенклатура и классификация.
- •1. Моноаминомонокарбоновые.
- •44)Кислотно-основные свойства аминокислот.
- •45)Химические свойства аминокислот.Биологически важные свойства аминокислот.
- •I. Общие свойства
- •II. Свойства карбоксильной группы (кислотность)
- •III. Свойства аминогруппы (основность)
- •1. С сильными кислотами → соли:
- •IV. Качественная реакция
- •1. Все аминокислоты окисляются нингидрином с образованием продуктов сине-фиолетового цвета!
- •46)Физиологические активные пептиды. Примеры.
- •47)Уровни организации белковой молекулы.
- •48)Вторичная структура белка
- •49)Третичная и четвертичная структуры белков. Олигомерные белки.
- •50) Классификация белков
- •51)Физико-химические свойства белков
- •52)Особенности растворов вмс: набухание и растворение
- •53)Аномальная вязкость растворов вмс.
- •54)Классификация сложных белков
- •56) Кооперативное связывание кислорода гемоглобином, эффект Бора, влияние 2,3-бфг на сродство гемоглобина к кислороду.
44)Кислотно-основные свойства аминокислот.
Аминокислоты - амфотерные соединения. Амфотерность аминокислот обусловлена кислотными (СООН) и основными (NH2) функциональными группами в их молекулах. Аминокислоты образуют соли как со щелочами, так и с кислотами.
В кристаллическом состоянии α-аминокислоты существуют как диполярные ионы H3N+-CHR-COO- (обычно используемая запись строения аминокислоты в неионизированной форме служит лишь для удобства).В водном растворе аминокислоты существуют в виде равновесной смеси диполярного иона, катионной и анионной форм.
Положение равновесия зависит от рН среды. У всех аминокислот преобладают катионные формы в сильнокислых (рН = 1-2) и анионные - в сильнощелочных (рН >11) средах.
Значение рН, при котором концентрация диполярных ионов максимальна, а минимальные концентрации катионных и анионных форм аминокислоты равны, называется изоэлектрической точкой (рI).Другими словами, изоэлектрическая точка аминокислоты - значение pH, при котором максимальная доля молекул аминокислоты обладает нулевым зарядом.
Нейтральные α-аминокислоты. Эти аминокислоты имеют значения рI несколько ниже 7 (5,5-6,3) вследствие большей способности к ионизации карбоксильной группы под влиянием -I-эффекта группы NH2. Например, у аланина изоэлектрическая точка находится при рН 6,0.
Кислые α-аминокислоты. Эти аминокислоты имеют в радикале дополнительную карбоксильную группу и в сильнокислой среде находятся в полностью протонированной форме. Кислые аминокислоты являются трехосновными.Основные α-аминокислоты. В случае основных аминокислот изоэлектрические точки находятся в области рН выше 7.
В организме основные аминокислоты находятся в виде катионов, т.е. у них протонированы обе аминогруппы.
В целом ни одна α-аминокислота in vivo не находится в своей изоэлектрической точке и не попадает в состояние, отвечающее наименьшей растворимости в воде. Все аминокислоты в организме находятся в ионной форме.
45)Химические свойства аминокислот.Биологически важные свойства аминокислот.
Аминокислоты амфотерные органические соединения, для них характерны кислотно-основные свойства.
I. Общие свойства
1. Внутримолекулярная нейтрализация → образуется биполярный цвиттер-ион:
Водные растворы электропроводны. Эти свойства объясняются тем, что молекулы аминокислот существуют в виде внутренних солей, которые образуются за счет переноса протона от карбоксила к аминогруппе:
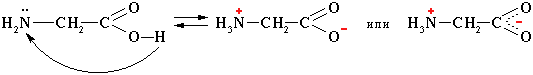
цвиттер-ион
Водные растворы аминокислот имеют нейтральную, кислую или щелочную среду в зависимости от количества функциональных групп.
2. Поликонденсация → образуются полипептиды (белки):
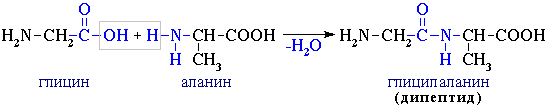
При взаимодействии двух α-аминокислот образуется дипептид.
3. Разложение → Амин + Углекислый газ:
NH2-CH2-COOH → NH2-CH3 + CO2↑
II. Свойства карбоксильной группы (кислотность)
1. С основаниями → образуются соли:
NH2-CH2-COOH + NaOH → NH2-CH2-COONa + H2O
NH2-CH2-COONa - натриевая соль 2-аминоуксусной кислоты
2. Со спиртами → образуются сложные эфиры – летучие вещества (р. этерификации): NH2-CH2-COOH + CH3OH HCl(газ)→ NH2-CH2-COOCH3 + H2O
NH2-CH2-COOCH3 - метиловый эфир 2- аминоуксусной кислоты
3. С аммиаком → образуются амиды:
NH2-CH(R)-COOH + H-NH2 → NH2-CH(R)-CONH2 + H2O
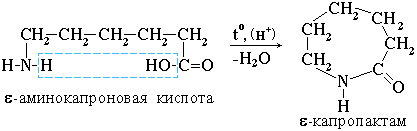
4. Практическое значение имеет внутримолекулярное взаимодействие функциональных групп ε-аминокапроновой кислоты, в результате которого образуется ε-капролактам (полупродукт для получения капрона):