- •«Общая химия»
- •1. Основные понятия термодинамики. Термодинамические системы: определение, классификация
- •2. Кинетика химических реакций, классификация
- •3. Скорость химической реакции, факторы на нее влияющие
- •3. Температура. При повышении температуры на каждые 10°c скорость реакции возрастает в 2-4 раза (Правило Вант-Гоффа).
- •4. Зависимость скорости химической реакции от концентрации реагирующих веществ. Закон действующих масс
- •5. Зависимость скорости реакции от температуры. Энергия активации. Температурный коэффициент скорости и его особенности для биохимических процессов.
- •6. Химическое равновесие. Обратимые и необратимые реакции. Константа химического равновесия. Прогнозирование смещения химического равновесия. Принцип Ле-Шателье-Брауна
- •7. Катализ гомогенный и гетерогенный . Особенности ферментативного катализа
- •8. Физико-химические свойства воды, определяющие её роль в природе и организме. Биологически важные свойства воды. Примеры водородных связей в биологических системах
- •9. Растворы. Коллигативные свойства растворов. Закон Рауля
- •10. Диффузия и осмос. Осмотическое давление. Закон Вант-Гоффа. Осмолярность биологических жидкостей. Осмотически-активные компоненты плазмы крови
- •11. Биологическое значение осмотического давления. Поведение эритроцитов в растворах различной концентрации. Применение в медицине растворов различной осмолярности
- •12. Коллоидно-осмотическое давление крови. Гипотеза Старлинга как один из механизмов возникновения отеков
- •13. Ионное произведение воды и водородный показатель. Методы определения pН растворов. Индикаторы и их свойства
- •15. Реакция среды в растворах слабых кислот и оснований. Константа диссоциации. Реакция среды в растворах солей. Закон разведения Оствальда
- •16. Буферные системы: определение понятия, типии буферной системы. Буферная емкость и pН буферной системы
- •17. Механизм действия буферных систем. Буферные системы крови
- •18. Типы окислительно-восстановительных (редокс) реакций в организме
- •19. Строение комплексных соединений. Классификация и номенклатура
- •1. По знаку заряда комплекса:
- •2. По принадлежности комплексного соединения к определенному классу соединений:
- •3. По природе лиганда:
- •4. По внутренней структуре комплекса:
- •20. Понятие о хелатных соединениях. Хелатообразующие лиганды, примеры
- •21. Представление о строении гемопротеидов
- •22. Сорбция. Понятия адсорбции и абсорбции. Физическая и химическая адсорбция. Зависимость величины адсорбции от различных факторов
- •23. Дисперсные системы, их классификации
- •Классификация дисперсных систем по агрегатному состоянию фаз
- •24. Грубодисперсные системы: классификация, применение в медицине
- •25. Коллоидные растворы: строение коллоидной частицы, устойчивость коллоидных систем. Факторы, влияющие на устойчивость коллоидных систем. Коагуляция
- •26. Роль дисперсных систем в организме
- •4) Пространственная изомерия: Конфигурационная и Конформационная.
- •5) Симметрия молекул
- •1. Сопряжение. Сопряженные системы с открытой цепью
- •2. Замкнутые сопряженные системы. Ароматичность.
- •13)Классификация органических реакций по результату: замещения, присоединения, элиминирования, перегруппировки, овр.
- •14) Кислоты и основания по Бренстеду, их классификация.
- •15) Влияние различных факторов на кислотные и основные свойства веществ. Примеры.
- •16) Спирты и фенолы. Многотомные спирты.
- •19) Классификация карбоновых кислот: по основности, насыщенности, наличию функциональной группы, числу атомов углерода в цепи.
- •20) Химические свойства карбоновых кислот с участием карбоксильной группы : декарбоксилирование, образование солей, амидов, ангидридов, галоген-ангидридов, сложных эфиров.
- •21) Вжк: классификация, номенклатура, структура и физические свойства. Заменимые и незаменимые вжк, витамин f, функции в организме.
- •22) Дикарбоновые кислоты: щавелевая, малоновая, янтарная, глутаровая, фумаровая. Их роль в организме.
- •23) Оксо- и гидроксикарбоновые кислоты: пвк и молочная, яблочная и щавелевоуксусная, лимонная, ацетоуксусная и бета-гидроксимасляная, альфа-кетоглутаровая. Функции в организме.
- •24) Общее представление о липидах. Классификация липидов
- •25) Простые липиды: триацилглицеролы (таг): состав, номенклатура, свойства. Гидролиз таг. Биологическая роль.
- •26) Сложные липиды – глицерофосфолипиды. Строение и функции фосфатидилсерина, фосфатидилэтаноламина, фосфатидилхолина и фосфатидилинозитола.
- •27)Соединения стероидной природы: холестерин, желчные кислоты. Строение и роль.
- •28)Углеводы. Классификация. Функции
- •29)Моносахариды. Классификация. Хим. Свойства. Окислительно-восстановительные реакции.
- •I. Реакции по карбонильной группе
- •1. Окисление.
- •2. Восстановление.
- •II. Реакции по гидроксильным группам
- •III. Специфические реакции
- •30)Стереоизомерия моносахаридов d- и l-ряды. Открытые и циклические формулы. Пиранозы и фуранозы. Α- и β-аномеры. Циклоцепная таутомерия. Явление муторотации.
- •31)Строение
- •32)Строение
- •33)Полисахариды. Классификация. Функции
- •34)Дисахариды. Структура и свойства мальтозы, лактозы, сахарозы, целлобиозы
- •35)Гомополисахариды: крахмал (амилоза и амилопектин), гликоген, целлюлоза. Строение, свойства, биологическая роль
- •36)Гетерополисахариды: гиалуроновая кислота, хондроитинсульфаты. Строение, биологическая роль
- •37)Азотистые основания пуриновые (аденин, гуанин) и пиримидиновые (тимин, урацил, цитозин). Строение, лактим-лактамная таутомерия.
- •39)Нуклеотиды: строение, номенклатура, характер связи. Гидролиз нуклеотидов.
- •39) Свободные нуклеотиды: цамф и цгмф, атф, адф, фад, над. Строение, функции.
- •41) Первичная структура нуклеиновых кислот. Нуклеотидный состав днк и рнк.
- •42)Понятие о вторичной структуре днк. Комплементарность нуклеиновых оснований. Водородные связи в комплементарных парах нуклеиновых оснований.
- •43)Аминокислоты номенклатура и классификация.
- •1. Моноаминомонокарбоновые.
- •44)Кислотно-основные свойства аминокислот.
- •45)Химические свойства аминокислот.Биологически важные свойства аминокислот.
- •I. Общие свойства
- •II. Свойства карбоксильной группы (кислотность)
- •III. Свойства аминогруппы (основность)
- •1. С сильными кислотами → соли:
- •IV. Качественная реакция
- •1. Все аминокислоты окисляются нингидрином с образованием продуктов сине-фиолетового цвета!
- •46)Физиологические активные пептиды. Примеры.
- •47)Уровни организации белковой молекулы.
- •48)Вторичная структура белка
- •49)Третичная и четвертичная структуры белков. Олигомерные белки.
- •50) Классификация белков
- •51)Физико-химические свойства белков
- •52)Особенности растворов вмс: набухание и растворение
- •53)Аномальная вязкость растворов вмс.
- •54)Классификация сложных белков
- •56) Кооперативное связывание кислорода гемоглобином, эффект Бора, влияние 2,3-бфг на сродство гемоглобина к кислороду.
4) Пространственная изомерия: Конфигурационная и Конформационная.
Конформации:
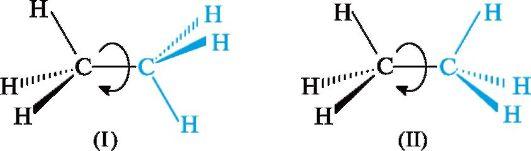
Вокруг простой связи С-С возможно свободное вращение, в результате которого молекула может принимать различные формы в пространстве. Это видно на стереохимических формулах этана (I) и (II), где отмеченные цветом группы СН3 расположены по-разному относительно другой группы СН3.
Поворот одной группы СН3 относительно другой происходит без нарушения конфигурации - изменяется лишь взаимное расположение в пространстве атомов водорода
Конформации ациклических соединений
Простейшим соединением со связью С-С является этан; рассмотрим две из множества его конформаций. В одной из них (рис. 7, а) расстояние между атомами водорода двух групп СН3 наименьшее, поэтому находящиеся друг против друга связи С-Н отталкиваются. Это приводит к увеличению энергии молекулы, а, следовательно, к меньшей устойчивости этой конформации. При взгляде вдоль связи С-С видно, что три связи С-Н у каждого атома углерода попарно «заслоняют» друг друга. Такую конформацию называют заслоненной. В другой конформации этана, возникающей при повороте одной из групп СН3 на 60° (см. рис. 7, в), атомы водорода двух метильных групп максимально удалены друг от друга. При этом отталкивание электронов связей С-Н будет минимальным, энергия такой конформации также будет минимальной. Эту более устойчивую конформацию называют заторможенной. Разница в энергии обеих конформаций невелика и составляет ~12 кДж/моль; она определяет так называемый энергетический барьер вращения.

5) Симметрия молекул
Элементы симметрии представляют собой геометрические места, относительно которых осуществляются операции симметрии. При этом различают:
элементы симметрии 1 рода – оси симметрии (оси вращения);
элементы симметрии 2 рода – плоскости симметрии (зеркальные плоскости), центры симметрии (центры инверсии) и оси зеркального отражения.
Под термином операции симметрии понимают геометрические операции, осуществляемые на элементах симметрии и переводящие объект (молекулу) в неотличимую, эквивалентную или идентичную ориентацию.
Различают четыре основных операции симметрии:
вращение на угол 2π/n = 360°/n вокруг оси вращения;
отражение в плоскости симметрии;
инверсия (отражение в точке) в центре симметрии;
вращение с отражением вокруг оси зеркального отражения (вращение на угол 2π/n и отражение в плоскости, перпендикулярной к оси вращения).
Асимметрический атом — атом многовалентного элемента (напр., углерода, азота), к которому присоединены неодинаковые атомные группы или атомы других элементов.
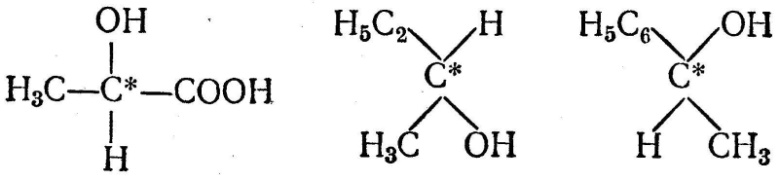 Примеры
ассиметричного атома.
Примеры
ассиметричного атома.
Стереоизомерами называются изомеры, различающиеся только расположением атомов и групп атомов в пространстве. Имеются органические молекулы, не обладающие плоскостью симметрии, и такие молекулы оказывается совместимыми со своим зеркальным изображением -это хиральность. Энантиомеры - ϶ᴛᴏ стереоизомеры, обладающие одинаковыми физическими (кроме знака вращения) и химическими свойствами и относящиеся друг к другу как предмет к своему зеркальному отражению.
6)
Проекция Фишера (проекционная
формула Фишера, формула
Фишера) —
способ изображения трёхмерной молекулы
в видеопроекции,
в которой вертикальные связи удаляются
за проекционную плоскость, а горизонтальные
связи выступают перед этой плоскостью.

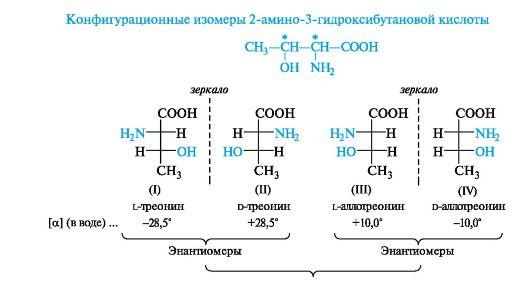
Структуры (I) и (II), соответствующие L- и D-треонину, а также (III) и (IV), соответствующие L- и D-аллотреонину (от греч. alios - другой), относятся друг к другу, как предмет и несовместимое с ним зеркальное отражение, т. е. они представляют собой пары энантиомеров. При сопоставлении структур (I) и (III), (I) и (IV), (II) и (III), (II) и (IV) видно, что в этих парах соединений у одного асимметрического центра конфигурация одинаковая, а у другого - противоположная. Такие пары стереоизомеров представляют собой диастереомеры. Подобные изомеры называют σ-диастереомерами, так как заместители в них связаны с центром хиральности σ-связями.
Аминокислоты и гидроксикислоты с двумя центрами хиральности относят к D- или L-ряду по конфигурации асимметрического атома с наименьшим номером.
Диастереомеры, в отличие от энантиомеров, различаются физическими и химическими свойствами. Например L-треонин, входящий в состав белков, и L-аллотреонин имеют разные значения удельного вращения (как показано выше).
σ-Диастереомеры. Многие биологически важные вещества содержат в молекуле более одного центра хиральности. При этом возрастает число конфигурационных изомеров, которое определяется как 2n, где n - число центров хиральности. Например, при наличии двух асимметрических атомов соединение может существовать в виде четырех стереоизомеров (22 = 4), составляющих две пары энантиомеров.
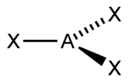
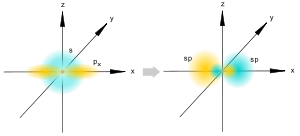
7) sp-Гибридизация.
sp-гибридизация
Происходит при смешивании одной s- и одной p-орбиталей. Образуются две равноценные sp-атомные орбитали, расположенные линейно под углом 180 градусов и направленные в разные стороны от ядра центрального атома. Две оставшиеся негибридные p-орбитали располагаются во взаимно перпендикулярных плоскостях и участвуют в образовании π-связей, либо занимаются не поделёнными парами электронов.
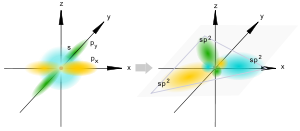
sp2-Гибридизация.
sp2-гибридизация
Происходит при смешивании одной s- и двух p-орбиталей. Образуются три гибридные орбитали с осями, расположенными в одной плоскости и направленными к вершинам треугольника под углом 120 градусов. Негибридная p-атомная орбиталь перпендикулярна плоскости и, как правило, участвует в образовании π-связей
 .
.
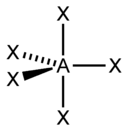
sp3-Гибридизация
sp3-гибридизация
Происходит при смешивании одной s- и трех p-орбиталей, образуя четыре равноценные по форме и энергии sp3-гибридные орбитали. Могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов.
Оси sp3-гибридных орбиталей направлены к вершинам тетраэдра, тогда как ядро центрального атома расположено в центре описанной сферы этого тетраэдра. Угол между любыми двумя осями приближённо равен 109°28'[3], что соответствует наименьшей энергии отталкивания электронов. Также sp3-орбитали могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов. Такое состояние характерно для атомов
углерода
в насыщенных углеводородах и соответственно
в алкильных радикалах .

разовании химических связей (отсутствуют неподелённые электронные пары)[4].
Основные характеристики:
Тип гибридизации |
Число гибридных орбиталей |
Геометрия |
Структура |
Примеры |
sp |
2 |
Линейная |
|
BeF2, CO2, NO2+ |
sp2 |
3 |
Треугольная |
|
BF3, NO3-, CO32- |
sp3 |
4 |
Тетраэдрическая |
|
CH4, ClO4-, SO42-, NH4+ |
dsp2 |
4 |
Плоскоквадратная |
|
[Ni(CN)4,](2-) [PdCl4]2- |
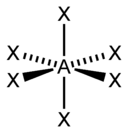
sp3d |
5 |
Гексаэдрическая |
|
PCl5, AsF5 |
sp3d2, d2sp3 |
6 |
Октаэдрическая |
|
SF6, Fe(CN)63-, |
8)Сопряжение – перераспределение (выравнивание) электронной плотности в сопряженной системе, приводящее к стабилизации молекулы.Возможны два типа сопряжения π,π-сопряжение и р,π-сопряжение
-В π,π– сопряженной системе в сопряжении участвует две или более π – связи. π,π– сопряженная система может включать гетероатом (О,N). (При перекрывании четырёх рz-орбиталей происходит образование единого π-электронного облака, т.е.сопряжение двух двойных связей.)Бутадиен – 1,3, пропеналь – это π,π – сопряженная системы.(CH2=CH–CH=CH2CH2=CH–CH=O - бутадиен–1,3 пропеналь)
-В р,π– сопряженной системе π – связь должна быть отделена одной одинарной от р-негибридной орбитали гетероатомом (О,N),где Р-орбиталь гетероатома сопряжена с орбиталями π-связи.(В молекулах этих соединений осуществляется сопряжение двойной связи с р-орбиталью гетероатома.) К таким соединениям относятся галогениды, эфиры, ацетамиды, карбкатионы.
(СН2 = СН – О – СН3 - Винилметиловый эфир)
Сопряжение – энергетически выгодный процесс, поэтому делокализация электронной плотности сопровождается выделением энергии. Система переходит на более низкий энергетический уровень и становится более устойчивой.
Энергия, которая выделяется за счет сопряжения, называется энергией сопряжения (ΔЕ).
Чем длиннее цепь сопряжения, тем больше ΔЕ, тем устойчивее система.