
- •«Общая химия»
- •1. Основные понятия термодинамики. Термодинамические системы: определение, классификация
- •2. Кинетика химических реакций, классификация
- •3. Скорость химической реакции, факторы на нее влияющие
- •3. Температура. При повышении температуры на каждые 10°c скорость реакции возрастает в 2-4 раза (Правило Вант-Гоффа).
- •4. Зависимость скорости химической реакции от концентрации реагирующих веществ. Закон действующих масс
- •5. Зависимость скорости реакции от температуры. Энергия активации. Температурный коэффициент скорости и его особенности для биохимических процессов.
- •6. Химическое равновесие. Обратимые и необратимые реакции. Константа химического равновесия. Прогнозирование смещения химического равновесия. Принцип Ле-Шателье-Брауна
- •7. Катализ гомогенный и гетерогенный . Особенности ферментативного катализа
- •8. Физико-химические свойства воды, определяющие её роль в природе и организме. Биологически важные свойства воды. Примеры водородных связей в биологических системах
- •9. Растворы. Коллигативные свойства растворов. Закон Рауля
- •10. Диффузия и осмос. Осмотическое давление. Закон Вант-Гоффа. Осмолярность биологических жидкостей. Осмотически-активные компоненты плазмы крови
- •11. Биологическое значение осмотического давления. Поведение эритроцитов в растворах различной концентрации. Применение в медицине растворов различной осмолярности
- •12. Коллоидно-осмотическое давление крови. Гипотеза Старлинга как один из механизмов возникновения отеков
- •13. Ионное произведение воды и водородный показатель. Методы определения pН растворов. Индикаторы и их свойства
- •15. Реакция среды в растворах слабых кислот и оснований. Константа диссоциации. Реакция среды в растворах солей. Закон разведения Оствальда
- •16. Буферные системы: определение понятия, типии буферной системы. Буферная емкость и pН буферной системы
- •17. Механизм действия буферных систем. Буферные системы крови
- •18. Типы окислительно-восстановительных (редокс) реакций в организме
- •19. Строение комплексных соединений. Классификация и номенклатура
- •1. По знаку заряда комплекса:
- •2. По принадлежности комплексного соединения к определенному классу соединений:
- •3. По природе лиганда:
- •4. По внутренней структуре комплекса:
- •20. Понятие о хелатных соединениях. Хелатообразующие лиганды, примеры
- •21. Представление о строении гемопротеидов
- •22. Сорбция. Понятия адсорбции и абсорбции. Физическая и химическая адсорбция. Зависимость величины адсорбции от различных факторов
- •23. Дисперсные системы, их классификации
- •Классификация дисперсных систем по агрегатному состоянию фаз
- •24. Грубодисперсные системы: классификация, применение в медицине
- •25. Коллоидные растворы: строение коллоидной частицы, устойчивость коллоидных систем. Факторы, влияющие на устойчивость коллоидных систем. Коагуляция
- •26. Роль дисперсных систем в организме
- •4) Пространственная изомерия: Конфигурационная и Конформационная.
- •5) Симметрия молекул
- •1. Сопряжение. Сопряженные системы с открытой цепью
- •2. Замкнутые сопряженные системы. Ароматичность.
- •13)Классификация органических реакций по результату: замещения, присоединения, элиминирования, перегруппировки, овр.
- •14) Кислоты и основания по Бренстеду, их классификация.
- •15) Влияние различных факторов на кислотные и основные свойства веществ. Примеры.
- •16) Спирты и фенолы. Многотомные спирты.
- •19) Классификация карбоновых кислот: по основности, насыщенности, наличию функциональной группы, числу атомов углерода в цепи.
- •20) Химические свойства карбоновых кислот с участием карбоксильной группы : декарбоксилирование, образование солей, амидов, ангидридов, галоген-ангидридов, сложных эфиров.
- •21) Вжк: классификация, номенклатура, структура и физические свойства. Заменимые и незаменимые вжк, витамин f, функции в организме.
- •22) Дикарбоновые кислоты: щавелевая, малоновая, янтарная, глутаровая, фумаровая. Их роль в организме.
- •23) Оксо- и гидроксикарбоновые кислоты: пвк и молочная, яблочная и щавелевоуксусная, лимонная, ацетоуксусная и бета-гидроксимасляная, альфа-кетоглутаровая. Функции в организме.
- •24) Общее представление о липидах. Классификация липидов
- •25) Простые липиды: триацилглицеролы (таг): состав, номенклатура, свойства. Гидролиз таг. Биологическая роль.
- •26) Сложные липиды – глицерофосфолипиды. Строение и функции фосфатидилсерина, фосфатидилэтаноламина, фосфатидилхолина и фосфатидилинозитола.
- •27)Соединения стероидной природы: холестерин, желчные кислоты. Строение и роль.
- •28)Углеводы. Классификация. Функции
- •29)Моносахариды. Классификация. Хим. Свойства. Окислительно-восстановительные реакции.
- •I. Реакции по карбонильной группе
- •1. Окисление.
- •2. Восстановление.
- •II. Реакции по гидроксильным группам
- •III. Специфические реакции
- •30)Стереоизомерия моносахаридов d- и l-ряды. Открытые и циклические формулы. Пиранозы и фуранозы. Α- и β-аномеры. Циклоцепная таутомерия. Явление муторотации.
- •31)Строение
- •32)Строение
- •33)Полисахариды. Классификация. Функции
- •34)Дисахариды. Структура и свойства мальтозы, лактозы, сахарозы, целлобиозы
- •35)Гомополисахариды: крахмал (амилоза и амилопектин), гликоген, целлюлоза. Строение, свойства, биологическая роль
- •36)Гетерополисахариды: гиалуроновая кислота, хондроитинсульфаты. Строение, биологическая роль
- •37)Азотистые основания пуриновые (аденин, гуанин) и пиримидиновые (тимин, урацил, цитозин). Строение, лактим-лактамная таутомерия.
- •39)Нуклеотиды: строение, номенклатура, характер связи. Гидролиз нуклеотидов.
- •39) Свободные нуклеотиды: цамф и цгмф, атф, адф, фад, над. Строение, функции.
- •41) Первичная структура нуклеиновых кислот. Нуклеотидный состав днк и рнк.
- •42)Понятие о вторичной структуре днк. Комплементарность нуклеиновых оснований. Водородные связи в комплементарных парах нуклеиновых оснований.
- •43)Аминокислоты номенклатура и классификация.
- •1. Моноаминомонокарбоновые.
- •44)Кислотно-основные свойства аминокислот.
- •45)Химические свойства аминокислот.Биологически важные свойства аминокислот.
- •I. Общие свойства
- •II. Свойства карбоксильной группы (кислотность)
- •III. Свойства аминогруппы (основность)
- •1. С сильными кислотами → соли:
- •IV. Качественная реакция
- •1. Все аминокислоты окисляются нингидрином с образованием продуктов сине-фиолетового цвета!
- •46)Физиологические активные пептиды. Примеры.
- •47)Уровни организации белковой молекулы.
- •48)Вторичная структура белка
- •49)Третичная и четвертичная структуры белков. Олигомерные белки.
- •50) Классификация белков
- •51)Физико-химические свойства белков
- •52)Особенности растворов вмс: набухание и растворение
- •53)Аномальная вязкость растворов вмс.
- •54)Классификация сложных белков
- •56) Кооперативное связывание кислорода гемоглобином, эффект Бора, влияние 2,3-бфг на сродство гемоглобина к кислороду.
54)Классификация сложных белков
Сло́жные белки́ (протеиды, холопротеины) — двухкомпонентные белки, в которых помимо пептидных цепей (простого белка) содержится компонент неаминокислотной природы — простетическая группа. При гидролизе сложных белков, кроме аминокислот, освобождается небелковая часть или продукты её распада.В качестве простетической группы могут выступать различные органические (липиды, углеводы) и неорганические (металлы) вещества.
В зависимости от химической природы простетических групп среди сложных белков выделяют следующие классы:
Гликопротеиды, содержащие в качестве простетической группы ковалентно связанные углеводные остатки и их подкласс — протеогликаны, с мукополисахаридными простетическими группами. В образовании связи с углеводными остатками обычно участвуют гидроксильные группы серина или треонина. Большая часть внеклеточных белков, в частности, иммуноглобулины — гликопротеиды. В протеогликанах углеводная часть составляет ~95 %, они являются основным компонентом межклеточного матрикса.
Липопротеиды, содержащие в качестве простетической части нековалентно связанные липиды. Липопротеиды, образованные белками-аполипопротеинами связывающимися с ними липидами и выполняют функцию транспорта липидов.
Металлопротеины, содержащие негемовые координационно связанные ионы металлов. Среди металлопротеидов есть белки, выполняющие депонирующие и транспортные функции (например, железосодержащие ферритин и трансферрин) и ферменты (например, цинксодержащая карбоангидраза и различные супероксиддисмутазы, содержащие в качестве активных центров ионы меди, марганца, железа и других металлов)
Нуклеопротеины, содержащие нековалентно связанные ДНК или РНК, в частности, хроматин, из которого состоят хромосомы, является нуклеопротеидом[2].
Фосфопротеиды, содержащие в качестве простетической группы ковалентно связанные остатки фосфорной кислоты. В образовании сложноэфирной связи с фосфатом участвуют гидроксильные группы серина или треонина, фосфопротеинами являются, в частности, казеин молока
Хромопротеиды — собирательное название сложных белков с окрашенными простетическими группами различной химической природы. К ним относится множество белков с металлсодержащей порфириновой простетической группой, выполняющие разнообразные функции — гемопротеины (белки, содержащие в качестве простетической группы гем — гемоглобин, цитохромы и др.), хлорофиллы; флавопротеиды с флавиновой группой, и др.
55) Гемопротеины. Сравнительная характеристика структур и функций миоглобина и гемоглобина. Гемопротеины, гемопротеиды — простые белки, связанные с окрашенным небелковым компонентом. Различают Г. (содержат в качестве простетической группы железо), магнийпорфирины и флавопротеины (содержат производные изоаллаксазина). К Г. относятся цитохром с, миоглобин, гемоглобин и др. Г. участвуют в таких фундаментальных процессах жизнедеятельности, как фотосинтез , дыхание клеток и целого организма, транспорт кислорода и СО2, окислительно-восстановительные реакции, свето- и цветовосприятие и др.
Миоглобин- сложный белок третьего уровня структурной организации. Состоит из одной полипептидной цепи (153 остатка). Третичная структура белка образована, главным образом, альфа-спиралями вторичной структуры, на которые приходится около 70 процентов АКО, остальные- на повороты и начальный и конечный участки. Белок содержит в себе так называемый ГЕМ- комплекс порфирина и иона железа в степени окисления +2.
Миоглобин сосредоточен, главным образом, в мышцах и его главной функцией является хранение кислорода. Скорость насыщения миоглобина кислородом намного превышает таковую для гемоглобина. Миоглобин мало приспособлен для транспортировки кислорода из легких в ткани, поскольку скорость отдачи кислорода в тканях невелика.
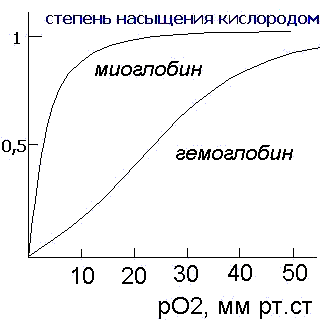
Гемоглобин представляет собой белок четвертичной структуры, состоящий из двух пар субъединиц альфа- (141 АКО) и бетта- (147 АКО- аминокислотных остатков). Субъединицы миоглобина и гемоглобина очень сходны между собой, как весьма сходна и третичная структура обоих белков.
Главное отличие гемоглобина от миоглобина заключается в проявлении особого рода эффектов- кооперативных, влияющих на скорости присоединения- отсоединения молекул кислорода. Каждая молекула гемоглобина способна присоединять и переносить четыре молекулы кислорода, при этом кооперативность проявляется в том, что как присоединение, так и отсоединение каждой последующей молекулы кислорода облегчается в результате структурных изменений в конформации молекулы, которых у гемоглобина имеется две основных- оксигенированная и дезоксигенированная. Промежуточные состояния нестабильны. Предполагается следующий механизм кооперативного эффекта. Присоединение первой молекулы кислорода приводит тому что атом железа смещается от своего места, вызывая изменения конформации субъединицы. Изменившаяся конформация по аллостерическому эффекту облегчает присоединение кислорода к другой субъединице и т.д. Это позволяет максимально ускорить процесс присоединения кислорода в легких .
