
- •«Общая химия»
- •1. Основные понятия термодинамики. Термодинамические системы: определение, классификация
- •2. Кинетика химических реакций, классификация
- •3. Скорость химической реакции, факторы на нее влияющие
- •3. Температура. При повышении температуры на каждые 10°c скорость реакции возрастает в 2-4 раза (Правило Вант-Гоффа).
- •4. Зависимость скорости химической реакции от концентрации реагирующих веществ. Закон действующих масс
- •5. Зависимость скорости реакции от температуры. Энергия активации. Температурный коэффициент скорости и его особенности для биохимических процессов.
- •6. Химическое равновесие. Обратимые и необратимые реакции. Константа химического равновесия. Прогнозирование смещения химического равновесия. Принцип Ле-Шателье-Брауна
- •7. Катализ гомогенный и гетерогенный . Особенности ферментативного катализа
- •8. Физико-химические свойства воды, определяющие её роль в природе и организме. Биологически важные свойства воды. Примеры водородных связей в биологических системах
- •9. Растворы. Коллигативные свойства растворов. Закон Рауля
- •10. Диффузия и осмос. Осмотическое давление. Закон Вант-Гоффа. Осмолярность биологических жидкостей. Осмотически-активные компоненты плазмы крови
- •11. Биологическое значение осмотического давления. Поведение эритроцитов в растворах различной концентрации. Применение в медицине растворов различной осмолярности
- •12. Коллоидно-осмотическое давление крови. Гипотеза Старлинга как один из механизмов возникновения отеков
- •13. Ионное произведение воды и водородный показатель. Методы определения pН растворов. Индикаторы и их свойства
- •15. Реакция среды в растворах слабых кислот и оснований. Константа диссоциации. Реакция среды в растворах солей. Закон разведения Оствальда
- •16. Буферные системы: определение понятия, типии буферной системы. Буферная емкость и pН буферной системы
- •17. Механизм действия буферных систем. Буферные системы крови
- •18. Типы окислительно-восстановительных (редокс) реакций в организме
- •19. Строение комплексных соединений. Классификация и номенклатура
- •1. По знаку заряда комплекса:
- •2. По принадлежности комплексного соединения к определенному классу соединений:
- •3. По природе лиганда:
- •4. По внутренней структуре комплекса:
- •20. Понятие о хелатных соединениях. Хелатообразующие лиганды, примеры
- •21. Представление о строении гемопротеидов
- •22. Сорбция. Понятия адсорбции и абсорбции. Физическая и химическая адсорбция. Зависимость величины адсорбции от различных факторов
- •23. Дисперсные системы, их классификации
- •Классификация дисперсных систем по агрегатному состоянию фаз
- •24. Грубодисперсные системы: классификация, применение в медицине
- •25. Коллоидные растворы: строение коллоидной частицы, устойчивость коллоидных систем. Факторы, влияющие на устойчивость коллоидных систем. Коагуляция
- •26. Роль дисперсных систем в организме
- •4) Пространственная изомерия: Конфигурационная и Конформационная.
- •5) Симметрия молекул
- •1. Сопряжение. Сопряженные системы с открытой цепью
- •2. Замкнутые сопряженные системы. Ароматичность.
- •13)Классификация органических реакций по результату: замещения, присоединения, элиминирования, перегруппировки, овр.
- •14) Кислоты и основания по Бренстеду, их классификация.
- •15) Влияние различных факторов на кислотные и основные свойства веществ. Примеры.
- •16) Спирты и фенолы. Многотомные спирты.
- •19) Классификация карбоновых кислот: по основности, насыщенности, наличию функциональной группы, числу атомов углерода в цепи.
- •20) Химические свойства карбоновых кислот с участием карбоксильной группы : декарбоксилирование, образование солей, амидов, ангидридов, галоген-ангидридов, сложных эфиров.
- •21) Вжк: классификация, номенклатура, структура и физические свойства. Заменимые и незаменимые вжк, витамин f, функции в организме.
- •22) Дикарбоновые кислоты: щавелевая, малоновая, янтарная, глутаровая, фумаровая. Их роль в организме.
- •23) Оксо- и гидроксикарбоновые кислоты: пвк и молочная, яблочная и щавелевоуксусная, лимонная, ацетоуксусная и бета-гидроксимасляная, альфа-кетоглутаровая. Функции в организме.
- •24) Общее представление о липидах. Классификация липидов
- •25) Простые липиды: триацилглицеролы (таг): состав, номенклатура, свойства. Гидролиз таг. Биологическая роль.
- •26) Сложные липиды – глицерофосфолипиды. Строение и функции фосфатидилсерина, фосфатидилэтаноламина, фосфатидилхолина и фосфатидилинозитола.
- •27)Соединения стероидной природы: холестерин, желчные кислоты. Строение и роль.
- •28)Углеводы. Классификация. Функции
- •29)Моносахариды. Классификация. Хим. Свойства. Окислительно-восстановительные реакции.
- •I. Реакции по карбонильной группе
- •1. Окисление.
- •2. Восстановление.
- •II. Реакции по гидроксильным группам
- •III. Специфические реакции
- •30)Стереоизомерия моносахаридов d- и l-ряды. Открытые и циклические формулы. Пиранозы и фуранозы. Α- и β-аномеры. Циклоцепная таутомерия. Явление муторотации.
- •31)Строение
- •32)Строение
- •33)Полисахариды. Классификация. Функции
- •34)Дисахариды. Структура и свойства мальтозы, лактозы, сахарозы, целлобиозы
- •35)Гомополисахариды: крахмал (амилоза и амилопектин), гликоген, целлюлоза. Строение, свойства, биологическая роль
- •36)Гетерополисахариды: гиалуроновая кислота, хондроитинсульфаты. Строение, биологическая роль
- •37)Азотистые основания пуриновые (аденин, гуанин) и пиримидиновые (тимин, урацил, цитозин). Строение, лактим-лактамная таутомерия.
- •39)Нуклеотиды: строение, номенклатура, характер связи. Гидролиз нуклеотидов.
- •39) Свободные нуклеотиды: цамф и цгмф, атф, адф, фад, над. Строение, функции.
- •41) Первичная структура нуклеиновых кислот. Нуклеотидный состав днк и рнк.
- •42)Понятие о вторичной структуре днк. Комплементарность нуклеиновых оснований. Водородные связи в комплементарных парах нуклеиновых оснований.
- •43)Аминокислоты номенклатура и классификация.
- •1. Моноаминомонокарбоновые.
- •44)Кислотно-основные свойства аминокислот.
- •45)Химические свойства аминокислот.Биологически важные свойства аминокислот.
- •I. Общие свойства
- •II. Свойства карбоксильной группы (кислотность)
- •III. Свойства аминогруппы (основность)
- •1. С сильными кислотами → соли:
- •IV. Качественная реакция
- •1. Все аминокислоты окисляются нингидрином с образованием продуктов сине-фиолетового цвета!
- •46)Физиологические активные пептиды. Примеры.
- •47)Уровни организации белковой молекулы.
- •48)Вторичная структура белка
- •49)Третичная и четвертичная структуры белков. Олигомерные белки.
- •50) Классификация белков
- •51)Физико-химические свойства белков
- •52)Особенности растворов вмс: набухание и растворение
- •53)Аномальная вязкость растворов вмс.
- •54)Классификация сложных белков
- •56) Кооперативное связывание кислорода гемоглобином, эффект Бора, влияние 2,3-бфг на сродство гемоглобина к кислороду.
1. Сопряжение. Сопряженные системы с открытой цепью
Сопряженная система представляет собой систему, в которой имеет место чередование простых и кратных связей или по-другому – система, в которой кратные связи находятся друг от друга на расстоянии одной одинарной связи. Такая цепь сопряженных связей называется цепью конъюгации .В сопряженных системах имеет место дополнительное перекрывание π-электронных облаков кратной связи. Двойная связь представляет собой сочетание σ-связи и π-связи. В алкенах электронная плотность π-связи охватывает только 2 атома и ее называют локализованной. Локализованные двойные связи часто встречаются в природных соединениях, например в ненасыщенных карбоновых кислотах.
В сопряженных системах происходит такое электронное взаимодействие, при котором электронная плотность в молекуле распределяется равномерно, т.е. образуется общая электронная плотность.
π,π-сопряжение (Н2С = СН – СН = СН2 Бутадиен-1,3 ) / р,π-сопряжение (Н2С = СН – Cl Хлорэтен)
2. Замкнутые сопряженные системы. Ароматичность.
Сопряженные системы с замкнутой цепью сопряжения – это арены, гетероциклические соединения и небензоидные ароматические структуры.Простейшие замкнутые сопряженные структуры – арены, родоначальник - бензол. (Каждая р-орбиталь в равной степени перекрывается с р-орбиталями соседних атомов. Наблюдается сопряжение, возникает единое замкнутое π – электронное облако, которое охватывает все шесть атомов С.)Такая замкнутая с. система называется ароматической. Бензол Все атомы углерода в бензольном цикле находятся в sр2- гибридизации, все связи С–С равны между собой, имеют длину 1,40 А° и занимают как бы промежуточное положение между простой (1,54 А°) и двойной (1,33 А°) связями, При этом каждый атом углерода образует три s- связи (одну связь С–Н и две s-связи С–С), лежащих в одной плоскости , т.е. у каждого атома углерода осталось по одному р-электрону, орбитали которых, за счет двукратного перекрывания друг с другом образуют замкнутую p-электронную систему, которая охватывает все атомы углерода.p-Электронная плотность в такой системе распределена равномерно. Замкнутый секстет электронов представляет собой связь, которая отличается от других типов, и ее часто называют ароматической.
Электронное строение молекулы бензола можно описать с помощью теории резонанса, согласно которой молекула бензола рассматривается как резонансный гибрид двух предельных (граничных структур).
9)
Ароматичность — особое свойство некоторых химических соединений, благодаря которому сопряженноекольцо ненасыщенных связей проявляет аномально высокую стабильность; большую чем та, которую можнобыло бы ожидать только при одном сопряжении.
К ароматическим системам относятся любые плоские замкнутые циклы, отвечающие критериям ароматичности.
Критерии ароматичности
1. Молекула имеет плоское циклическое строение.
2. Все атомы в цикле в состоянии sp2- гибридизации (следовательно s-скелет плоский и все рz-орбитали параллельны.
3. В молекуле существует делокализованная p-электронная система, содержащая 4n + 2 p-электрона , где n = 0,1,2, – натуральный ряд чисел. Это правило получило название правила Хюккеля, предложено в 1931 на основании метода молекулярных орбиталей).
Правило Хюккеля применимо не только для моноциклических p-электронных систем, но и для плоских конденсированных систем.
Нафталин (4n+2=10 p-эл-нов,n = 2) /Антрацен (4n+2=14 p-эл-нов,n = 3) /Фенантрен(4n+2=14 p-эл-нов,n = 3)
Однако н все замкнутые ароматические структуры являются ароматическими. Так, например, циклооктатетраен-1,3,5,7 не относится к ароматическим, т.к. не удовлетворяется правило Хюккеля, 4n + 2 = 8 p-электронов, n = 1,5.
10)Электронные эффекты - смещение электронной плотности в молекуле, ионе или радикале под влиянием заместителей. Заместителем считается любой атом (кроме водорода) или группа атомов, связанные с атомом углерода. Различают индуктивный (I) и мезомерный (M) эффекты заместителей.
Взаимное влияние, передающееся по цепи σ-связей, называется индуктивным эффектом (I)атома или группы, а передающееся по цепи π-связей -мезомерным эффектом или эффектом сопряжения (M).
Заместители проявляют отрицательный индуктивный эффект (-I), если они смещают к себе электронную плотность σ-связи от атома углерода сильнее, чем водород. Таким свойством обладают группы, содержащие полярные связи, и атомы более электроотрицательные, чем углерод:
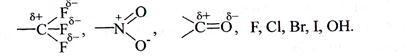
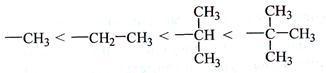
Заместители характеризуются положительным индуктивным эффектом (+I), если они отталкивают электронную плотность σ-связи к углероду. +I проявляют металлы I-III групп периодической системы и алкильные группы:
Положительный мезомерный эффект (+М) проявляют атомы азота, кислорода и галогенов, непосредственно связанные с ненасыщенными атомами углерода.
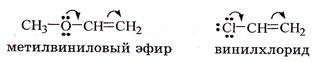
1.Индуктивный эффект — смещение электронной плотности по цепи σ-связей, которое обусловлено различиями в электроотрицательностях атомов.(Наличие в молекуле полярной σ-связи вызывает поляризацию ближайших двух–трех σ-связей и ведет к возникновению частичных зарядов δ+ (дельта плюс) или δ– (дельта минус) на соседних атомах)
Индуктивный эффект передаётся по цепи с затуханием, т. к. при образовании ϭ-связи выделяется большое количество энергии и она плохо поляризуется и поэтому индуктивный эффект проявляется в большей степени на одну две связи. Направление смещения электронной плотности всех ϭ-связей обозначают прямыми стрелками.→
Например: СH3δ+ <→CH2δ+<→CH2δ+<→Clδ-Э.О. Сl> Э.О. С / СH3δ+< →CH2δ+<→CH2δ+<→OHδ- Э.О. ОН > Э.О. С
Атом или группа атомов, смещающие электронную плотность ϭ-связи от атома углерода на себя называются электроноакцепторными заместителями и проявляют отрицательный индуктивный эффект(-I-эффект).
Ими являются галогены (Cl, Br, I), OH-, NH2-, COOH, COH, NO2, SO3H и др.
Атом или группа атомов, отдающие электронную плотность называются электронодонорными заместителями и проявляют положительный индуктивный эффект(+I-эффект).
+I-эффект проявляют алифатические углеводородные радикалы, СН3, С2Н5и др.
Индуктивный эффект проявляется и в случае, когда связанные атомы углерода различны по состоянию гибридизации. Например, в молекуле пропена группа СН3 проявляет +I-эффект, так как атом углерода в ней находится в sp3-гибридном состоянии, а атомы углерода при двойной связи в sp2-гибридном состоянии и проявляют большую электроотрицательность, поэтому проявляют -I-эффект и являются электроноакцепторами.(пропен-1)
2)Мезомерный эффект - смещение электронной плотности по цепи делокализованных (сопряженных) π-связей.
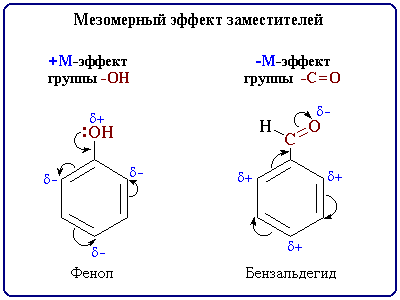
Этот эффект проявляют заместители, связанные с sp2- или sp-гибридизованным атомом. Благодаря подвижности π-электронов, М-эффект передается по цепи сопряжения без затухания. +М-эффектом обладают заместители, повышающие электронную плотность в сопряженной системе. К ним относятся группы, которые содержат атомы с неподеленной парой электронов, способные к передаче этой пары электронов в общую систему сопряжения. +М-эффект характерен для групп -OH и -NH2. Так, в молекуле фенола C6H5OH группа -OH проявляет +М-эффект за счет участия одной из неподеленных электронных пар атома кислорода в системе сопряжения.
–М-эффект проявляют заместители с электроотрицательными атомами и смещающие электронную плотность на себя. –М-эффект характерен для групп -CH=O, -COOH, -NO2. Хотя эти группы имеют неподеленные электронные пары, пространственное расположение орбиталей с этими электронами не позволяет им вступать в систему сопряжения. Таким образом, в данном случае заместитель может лишь оттягивать электроны из общей системы сопряжения за счет своей более высокой электроотрицательности.
Направление смещения электронной плотности под влиянием М-эффекта обозначается изогнутыми стрелками.
11)Гомолитический разрыв связи — разрыв, когда каждому атому отходит по одному электрону. Характерен для обменного механизма образования ковалентной связи.
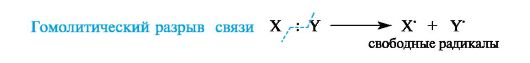
Гетеролитический разрыв связи — разрыв, когда в результате образуются положительно и отрицательно заряженные частицы, т.к. оба электрона из общей электронной пары остаются при одном из атомов. Характерен для донорно-акцепторного механизма образования ковалентной связи.
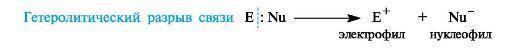
-Процесс, обратный образованию ковалентной связи по обменному механизму, в результате которого образуются два свободных радикала, называется гомолитическим разрывом связи.
-Процесс обратный образованию связи по донорно-акцепторному механизму называется гетеролитическим разрывом сввязи. При этом часто (но не всегда!!!) образуются заряженные частицы ионы.
Частица с неподеленной электронной парой называется нуклеофил, а частица с пустой орбиталью – электрофил.
12) Радикальные реагенты (радикалы) - свободные атомы или частицы с неспаренным электроном. Примеры радикальных реагентов: гидроксильные НОˑ, гидропероксильные HOOˑ, алкильные Rˑ радикалы, атомы галогенов Сˑ, Brˑ. Электрофильные реагенты (электрофилы) - частицы, образующие новую ковалентную связь за счет электронной пары реакционного партнера. Электрофильные частицы обозначаются символом Е+ или Е. Они могут нести положительный заряд - протон Н+, карбокатионы R3C+, ацилий-катионы R-C=O - или быть электронейтральными, например триоксид серы SO3.
Нуклеофильные реагенты (нуклеофилы) - частицы, образующие новую ковалентную связь с реакционным партнером, предоставляя для этого свою электронную пару. Нуклеофильные частицы обозначаются символами Nu или Nu и могут быть отрицательно заряженными - гидрид-ион Н-, гидроксид-ион НО- , алкоксид-ион RO- , карбанион R3C- , хлорид-ион Cl- или быть электронейтральными. В этом случае их нуклеофильность обусловлена р- или π-электронами (NH3, H2O, CH2=CH2, C6H6). -Термин «нуклеофил» применяется к частице, реагирующей с любым электрофильным реакционным партнером за исключением протона Н+.
-Взаимодействующие вещества разделяют на субстраты и реагенты. Такое распределение достаточно условно, но субстратом, как правило, выступает молекулы, которая поставляет атом углерода для образования новой связи. В зависимости от природы реагента (атакующей частицы) все реакции делятся на нуклеофильные, электрофильные и радикальные.
Нуклеофильные (И) - это реакции, в которых реагентом выступает нулкеофил (В-), имеющей отрицательный заряд и хотя бы одну неразделенную электронную пару. Эта пара электронов образует ковалентную связь с атомом, с которым они вступают в реакцию. Условно все нуклеофилы можно разделить на три группы: 1)Анионы:2)Соединения со свободными парами электронов:3)Ненасыщенные соединения с p-электронами: алкены, алкины, диены, арены.
Нуклеофльные реакции обозначаются символом N.
Электрофильный реакции (II) - это реакции, в которых реагентом выступает электрофил (Е +), что имеет положительный заряд и вакантную (свободную) орбиталь или высокое сродство к электрону. Эта свободная орбиталь участвует в об-нии ковалентной химической связи с атомом, с которым они вступают в реакцию. Все электрофильные реагенты условно можно разделить на три группы:1)Катионы:2)Соединения со свободными парами электронов:3)Соединения с полярными связями, в которых на атоме углерода существуют эффективные положительные заряды: нитрилы R-C º N, карбонильные соединения RCX = O и другие.
Электрофильный реакции обозначаются символом Е.
Радикальные реакции (iii) - это реакции, в которых реагентом выступает ради-кал (R ¢), не имеет заряда, но имеет неспаренный электрон на атомной орбита-ли. Этот неспаренный электрон образует ковалентную связь с атомом, с которым он вступает в реакцию. Наиболее распространены радикалы можно расположить в последовательности уменьшения их устойчивости в такой ряд:
Радикальные реакции обозначаются символом R.
