
- •«Общая химия»
- •1. Основные понятия термодинамики. Термодинамические системы: определение, классификация
- •2. Кинетика химических реакций, классификация
- •3. Скорость химической реакции, факторы на нее влияющие
- •3. Температура. При повышении температуры на каждые 10°c скорость реакции возрастает в 2-4 раза (Правило Вант-Гоффа).
- •4. Зависимость скорости химической реакции от концентрации реагирующих веществ. Закон действующих масс
- •5. Зависимость скорости реакции от температуры. Энергия активации. Температурный коэффициент скорости и его особенности для биохимических процессов.
- •6. Химическое равновесие. Обратимые и необратимые реакции. Константа химического равновесия. Прогнозирование смещения химического равновесия. Принцип Ле-Шателье-Брауна
- •7. Катализ гомогенный и гетерогенный . Особенности ферментативного катализа
- •8. Физико-химические свойства воды, определяющие её роль в природе и организме. Биологически важные свойства воды. Примеры водородных связей в биологических системах
- •9. Растворы. Коллигативные свойства растворов. Закон Рауля
- •10. Диффузия и осмос. Осмотическое давление. Закон Вант-Гоффа. Осмолярность биологических жидкостей. Осмотически-активные компоненты плазмы крови
- •11. Биологическое значение осмотического давления. Поведение эритроцитов в растворах различной концентрации. Применение в медицине растворов различной осмолярности
- •12. Коллоидно-осмотическое давление крови. Гипотеза Старлинга как один из механизмов возникновения отеков
- •13. Ионное произведение воды и водородный показатель. Методы определения pН растворов. Индикаторы и их свойства
- •15. Реакция среды в растворах слабых кислот и оснований. Константа диссоциации. Реакция среды в растворах солей. Закон разведения Оствальда
- •16. Буферные системы: определение понятия, типии буферной системы. Буферная емкость и pН буферной системы
- •17. Механизм действия буферных систем. Буферные системы крови
- •18. Типы окислительно-восстановительных (редокс) реакций в организме
- •19. Строение комплексных соединений. Классификация и номенклатура
- •1. По знаку заряда комплекса:
- •2. По принадлежности комплексного соединения к определенному классу соединений:
- •3. По природе лиганда:
- •4. По внутренней структуре комплекса:
- •20. Понятие о хелатных соединениях. Хелатообразующие лиганды, примеры
- •21. Представление о строении гемопротеидов
- •22. Сорбция. Понятия адсорбции и абсорбции. Физическая и химическая адсорбция. Зависимость величины адсорбции от различных факторов
- •23. Дисперсные системы, их классификации
- •Классификация дисперсных систем по агрегатному состоянию фаз
- •24. Грубодисперсные системы: классификация, применение в медицине
- •25. Коллоидные растворы: строение коллоидной частицы, устойчивость коллоидных систем. Факторы, влияющие на устойчивость коллоидных систем. Коагуляция
- •26. Роль дисперсных систем в организме
- •4) Пространственная изомерия: Конфигурационная и Конформационная.
- •5) Симметрия молекул
- •1. Сопряжение. Сопряженные системы с открытой цепью
- •2. Замкнутые сопряженные системы. Ароматичность.
- •13)Классификация органических реакций по результату: замещения, присоединения, элиминирования, перегруппировки, овр.
- •14) Кислоты и основания по Бренстеду, их классификация.
- •15) Влияние различных факторов на кислотные и основные свойства веществ. Примеры.
- •16) Спирты и фенолы. Многотомные спирты.
- •19) Классификация карбоновых кислот: по основности, насыщенности, наличию функциональной группы, числу атомов углерода в цепи.
- •20) Химические свойства карбоновых кислот с участием карбоксильной группы : декарбоксилирование, образование солей, амидов, ангидридов, галоген-ангидридов, сложных эфиров.
- •21) Вжк: классификация, номенклатура, структура и физические свойства. Заменимые и незаменимые вжк, витамин f, функции в организме.
- •22) Дикарбоновые кислоты: щавелевая, малоновая, янтарная, глутаровая, фумаровая. Их роль в организме.
- •23) Оксо- и гидроксикарбоновые кислоты: пвк и молочная, яблочная и щавелевоуксусная, лимонная, ацетоуксусная и бета-гидроксимасляная, альфа-кетоглутаровая. Функции в организме.
- •24) Общее представление о липидах. Классификация липидов
- •25) Простые липиды: триацилглицеролы (таг): состав, номенклатура, свойства. Гидролиз таг. Биологическая роль.
- •26) Сложные липиды – глицерофосфолипиды. Строение и функции фосфатидилсерина, фосфатидилэтаноламина, фосфатидилхолина и фосфатидилинозитола.
- •27)Соединения стероидной природы: холестерин, желчные кислоты. Строение и роль.
- •28)Углеводы. Классификация. Функции
- •29)Моносахариды. Классификация. Хим. Свойства. Окислительно-восстановительные реакции.
- •I. Реакции по карбонильной группе
- •1. Окисление.
- •2. Восстановление.
- •II. Реакции по гидроксильным группам
- •III. Специфические реакции
- •30)Стереоизомерия моносахаридов d- и l-ряды. Открытые и циклические формулы. Пиранозы и фуранозы. Α- и β-аномеры. Циклоцепная таутомерия. Явление муторотации.
- •31)Строение
- •32)Строение
- •33)Полисахариды. Классификация. Функции
- •34)Дисахариды. Структура и свойства мальтозы, лактозы, сахарозы, целлобиозы
- •35)Гомополисахариды: крахмал (амилоза и амилопектин), гликоген, целлюлоза. Строение, свойства, биологическая роль
- •36)Гетерополисахариды: гиалуроновая кислота, хондроитинсульфаты. Строение, биологическая роль
- •37)Азотистые основания пуриновые (аденин, гуанин) и пиримидиновые (тимин, урацил, цитозин). Строение, лактим-лактамная таутомерия.
- •39)Нуклеотиды: строение, номенклатура, характер связи. Гидролиз нуклеотидов.
- •39) Свободные нуклеотиды: цамф и цгмф, атф, адф, фад, над. Строение, функции.
- •41) Первичная структура нуклеиновых кислот. Нуклеотидный состав днк и рнк.
- •42)Понятие о вторичной структуре днк. Комплементарность нуклеиновых оснований. Водородные связи в комплементарных парах нуклеиновых оснований.
- •43)Аминокислоты номенклатура и классификация.
- •1. Моноаминомонокарбоновые.
- •44)Кислотно-основные свойства аминокислот.
- •45)Химические свойства аминокислот.Биологически важные свойства аминокислот.
- •I. Общие свойства
- •II. Свойства карбоксильной группы (кислотность)
- •III. Свойства аминогруппы (основность)
- •1. С сильными кислотами → соли:
- •IV. Качественная реакция
- •1. Все аминокислоты окисляются нингидрином с образованием продуктов сине-фиолетового цвета!
- •46)Физиологические активные пептиды. Примеры.
- •47)Уровни организации белковой молекулы.
- •48)Вторичная структура белка
- •49)Третичная и четвертичная структуры белков. Олигомерные белки.
- •50) Классификация белков
- •51)Физико-химические свойства белков
- •52)Особенности растворов вмс: набухание и растворение
- •53)Аномальная вязкость растворов вмс.
- •54)Классификация сложных белков
- •56) Кооперативное связывание кислорода гемоглобином, эффект Бора, влияние 2,3-бфг на сродство гемоглобина к кислороду.
19) Классификация карбоновых кислот: по основности, насыщенности, наличию функциональной группы, числу атомов углерода в цепи.
По основности : одноосновные ( 1 карб. гр.); многоосновные ( 2 и более карб. гр.)
по количеству атомов углерода:
1) низшие - от 1 до 4 атомов углерода
2) Короткоцепочечные от 5 до 10 атомов С
3) Высшие жирные кислоты от 10 и более атомов С
насыщенные карбоновые кислоты – карбоновые кислоты, в которых насыщенный углеводородный радикал соединен с одной карбоксильной группой -COOH.
Насыщенные монокарбоновые кислоты (производные алканов и циклоалканов):
CnH2n+1COOH ,
б) Ненасыщенные монокарбоновые кислоты (производные алкинов, алкенов, алкадиенов и других ненасыщенных углеводородов,
CnH2n-1COOH , CnH2n-3COOH и др.
По строению радикала:
1) Алифотические ( насыщенные, ненасыщенные)
2) Циклические ( ароматические, гетероциклический)
20) Химические свойства карбоновых кислот с участием карбоксильной группы : декарбоксилирование, образование солей, амидов, ангидридов, галоген-ангидридов, сложных эфиров.
1)Реакции декарбоксилирования карбоновых кислот – энергетически выгодный процесс, т.к. в результате образуется устойчивая молекула СО2. Декарбоксилирование характерно для кислот у которых в ά-положении имеется электроноакцепторный заместитель. Легче всего декарбоксилируются двухосновные кислоты.
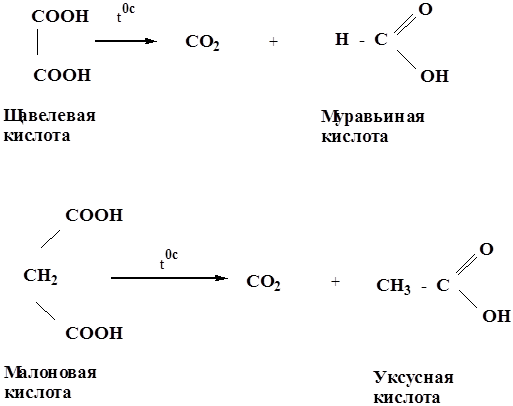
2) Образование солей. Карбоновые кислоты обладают всеми свойствами обычных кислот. Они реагируют с активными металлами, основными оксидами, основаниями и солями слабых кислот:
2RCOOH + Мg → (RCOO)2Mg + Н2,
2RCOOH + СаО → (RCOO)2Ca + Н2О,
RCOOH + NaOH → RCOONa + Н2О,
RCOOH + NaHCO3→ RCOONa + Н2О + СО2↑.
Карбоновые кислоты — слабые, поэтому сильные минеральные кислоты вытесняют их из соответствующих солей:
CH3COONa + HCl → СН3СООН + NaCl.
Соли карбоновых кислот в водных растворах гидролизованы:
СН3СООК
+ Н2О
![]() СН3СООН
+ КОН.
СН3СООН
+ КОН.
3)Реакция получения галоген-ангидридов: R - C = O - OH + PCl5 = R - C = O - Cl + POCl3 + HCl
4)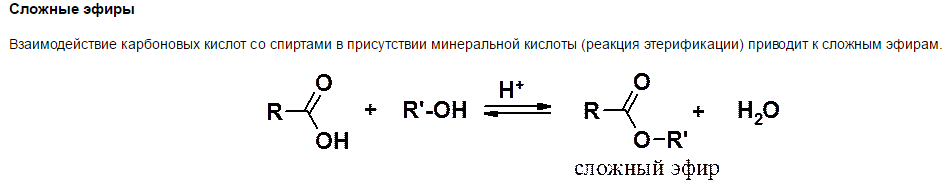
5)
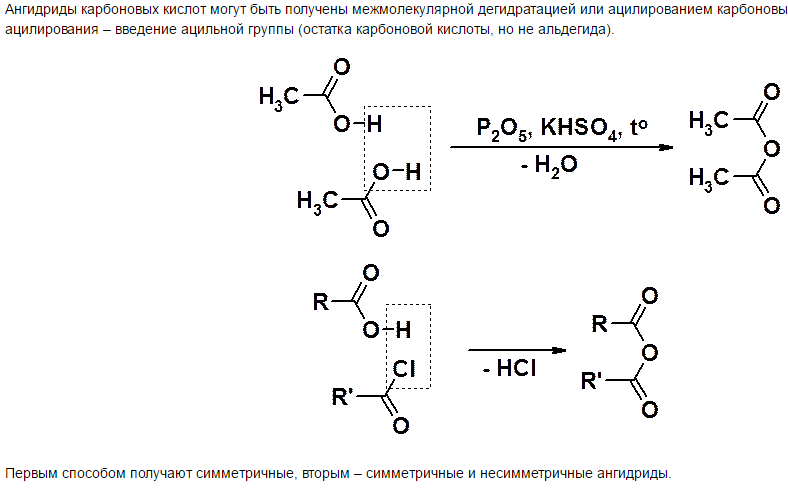
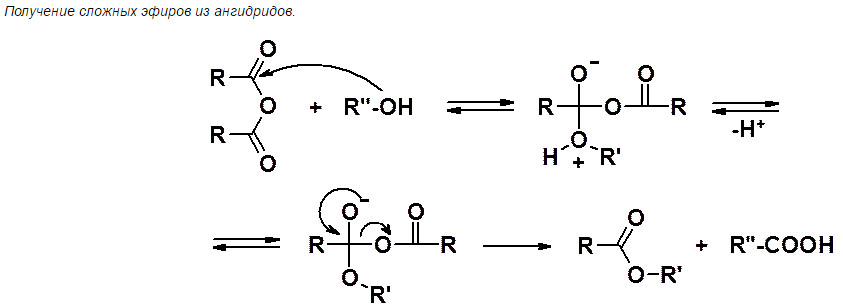
21) Вжк: классификация, номенклатура, структура и физические свойства. Заменимые и незаменимые вжк, витамин f, функции в организме.
Классификация ВЖК:
Насыщенные: все свободные атомы С соединены с Н; высокостабильные; прочные; синтезируются в организме из углеводов; содержатся в животном жире и растительных маслах.
Мононенасыщенные: одна связь С=С; умеренностабильны; содержатся в масла орехов; образуются из насыщенных.
Полиненасыщенные: 2 и более С=С; линолевая, линоленоваякислоты; незаменимые.
Для названия Ненасыщенных жирных кислот наиболее удобна ω-номенклатура, в соответствии с которой структура любой ненасыщенной жирной кислоты может быть выражена тремя цифрами : длиной цепи (количеством углеродных атомов), количеством двойных связей и количеством углеродных атомов между двойной связью и метильной группой (ω-углеродом). Наличие двойной связи может быть также обозначено цифрой, указывающей начало двойной связи, считая с карбоксильного конца молекулы.
Структура:
1) практически все содержат четное число атомов С
2) Практически все содержат неразветвленный радикал
3) Все ненасыщенные Ж.К. являются цис-изомерами
Физические свойства: Физико-химические свойства. Насыщенные ВЖК фракции С10-С13 – жидкости, С14 и более – твердые вещества от белого до светло-желтого цвета. Насыщенные ВЖК имеют низкие Т.пл. и поэтому, как правило – жидкие вещества. Обладают неприятным запахом. Все практически нерастворимы в воде. Растворяются в спирте, эфире. Т.вспл. С10-С16 – 1760, С17-С20 – 1970. Т.свспл. – 3300 и 3430соответственно.
Жирные кислоты — алифатические одноосновные карбоновые кислоты с открытой цепью, содержащиеся в этерифицированной форме в жирах, маслах и восках растительного и животного происхождения. Жирные кислоты, как правило, содержат неразветвленную цепь из четного числа атомов углерода (С4-24, включая карбоксильный углерод) и могут быть как насыщенными, так и ненасыщенными.
Заменимые ЖК - это те, которые могут самостоятельно синтезироваться в организме из других жиров и элементов, а незаменимые - нет. Поэтому незаменимые жиры обязательно должны поступать к нам извне, с пищей. К незаменимым жирным кислотам относятся всего две жирных кислоты: линолевая и линоленовая, из которых в нашем организме синтезируются ещё три. Из линолевой – арахидоновая кислота, а из линоленовой – эйкозапентаеновая и докозагексаеновая кислоты, которые обладают очень сильными и многообразными биологическими свойствами. Незаменимые жирные кислоты: линолевая и линоленовая, вместе с арахидоновой, относящиеся к классам омега-3 и омега-6 еще называют витаминомF (1%).
Витамин F - комплекс линолевой, ланолиновой и арахедоновой кислот.
Функции витамина F в организме:
принимает участие в синтезе жиров, обмене холестерина, способствует "сжиганию" насыщенных жиров;
предотвращает отложение холестерина в сосудах и артериях;
обеспечивает здоровье волос и кожи;
препятствует развитию патологий сердца;
обладает противовоспалительным и антигистаминным эффектом;
стимулирует иммунную защиту организма, способствует заживлению ран;
влияет на процесс сперматогенеза;
участвует в образование простагландинов;
во взаимосвязи с витамином D содействует усвоению фосфора и кальция, которые необходимы для костной ткани;
содействует общему росту.
