- •«Общая химия»
- •1. Основные понятия термодинамики. Термодинамические системы: определение, классификация
- •2. Кинетика химических реакций, классификация
- •3. Скорость химической реакции, факторы на нее влияющие
- •3. Температура. При повышении температуры на каждые 10°c скорость реакции возрастает в 2-4 раза (Правило Вант-Гоффа).
- •4. Зависимость скорости химической реакции от концентрации реагирующих веществ. Закон действующих масс
- •5. Зависимость скорости реакции от температуры. Энергия активации. Температурный коэффициент скорости и его особенности для биохимических процессов.
- •6. Химическое равновесие. Обратимые и необратимые реакции. Константа химического равновесия. Прогнозирование смещения химического равновесия. Принцип Ле-Шателье-Брауна
- •7. Катализ гомогенный и гетерогенный . Особенности ферментативного катализа
- •8. Физико-химические свойства воды, определяющие её роль в природе и организме. Биологически важные свойства воды. Примеры водородных связей в биологических системах
- •9. Растворы. Коллигативные свойства растворов. Закон Рауля
- •10. Диффузия и осмос. Осмотическое давление. Закон Вант-Гоффа. Осмолярность биологических жидкостей. Осмотически-активные компоненты плазмы крови
- •11. Биологическое значение осмотического давления. Поведение эритроцитов в растворах различной концентрации. Применение в медицине растворов различной осмолярности
- •12. Коллоидно-осмотическое давление крови. Гипотеза Старлинга как один из механизмов возникновения отеков
- •13. Ионное произведение воды и водородный показатель. Методы определения pН растворов. Индикаторы и их свойства
- •15. Реакция среды в растворах слабых кислот и оснований. Константа диссоциации. Реакция среды в растворах солей. Закон разведения Оствальда
- •16. Буферные системы: определение понятия, типии буферной системы. Буферная емкость и pН буферной системы
- •17. Механизм действия буферных систем. Буферные системы крови
- •18. Типы окислительно-восстановительных (редокс) реакций в организме
- •19. Строение комплексных соединений. Классификация и номенклатура
- •1. По знаку заряда комплекса:
- •2. По принадлежности комплексного соединения к определенному классу соединений:
- •3. По природе лиганда:
- •4. По внутренней структуре комплекса:
- •20. Понятие о хелатных соединениях. Хелатообразующие лиганды, примеры
- •21. Представление о строении гемопротеидов
- •22. Сорбция. Понятия адсорбции и абсорбции. Физическая и химическая адсорбция. Зависимость величины адсорбции от различных факторов
- •23. Дисперсные системы, их классификации
- •Классификация дисперсных систем по агрегатному состоянию фаз
- •24. Грубодисперсные системы: классификация, применение в медицине
- •25. Коллоидные растворы: строение коллоидной частицы, устойчивость коллоидных систем. Факторы, влияющие на устойчивость коллоидных систем. Коагуляция
- •26. Роль дисперсных систем в организме
- •4) Пространственная изомерия: Конфигурационная и Конформационная.
- •5) Симметрия молекул
- •1. Сопряжение. Сопряженные системы с открытой цепью
- •2. Замкнутые сопряженные системы. Ароматичность.
- •13)Классификация органических реакций по результату: замещения, присоединения, элиминирования, перегруппировки, овр.
- •14) Кислоты и основания по Бренстеду, их классификация.
- •15) Влияние различных факторов на кислотные и основные свойства веществ. Примеры.
- •16) Спирты и фенолы. Многотомные спирты.
- •19) Классификация карбоновых кислот: по основности, насыщенности, наличию функциональной группы, числу атомов углерода в цепи.
- •20) Химические свойства карбоновых кислот с участием карбоксильной группы : декарбоксилирование, образование солей, амидов, ангидридов, галоген-ангидридов, сложных эфиров.
- •21) Вжк: классификация, номенклатура, структура и физические свойства. Заменимые и незаменимые вжк, витамин f, функции в организме.
- •22) Дикарбоновые кислоты: щавелевая, малоновая, янтарная, глутаровая, фумаровая. Их роль в организме.
- •23) Оксо- и гидроксикарбоновые кислоты: пвк и молочная, яблочная и щавелевоуксусная, лимонная, ацетоуксусная и бета-гидроксимасляная, альфа-кетоглутаровая. Функции в организме.
- •24) Общее представление о липидах. Классификация липидов
- •25) Простые липиды: триацилглицеролы (таг): состав, номенклатура, свойства. Гидролиз таг. Биологическая роль.
- •26) Сложные липиды – глицерофосфолипиды. Строение и функции фосфатидилсерина, фосфатидилэтаноламина, фосфатидилхолина и фосфатидилинозитола.
- •27)Соединения стероидной природы: холестерин, желчные кислоты. Строение и роль.
- •28)Углеводы. Классификация. Функции
- •29)Моносахариды. Классификация. Хим. Свойства. Окислительно-восстановительные реакции.
- •I. Реакции по карбонильной группе
- •1. Окисление.
- •2. Восстановление.
- •II. Реакции по гидроксильным группам
- •III. Специфические реакции
- •30)Стереоизомерия моносахаридов d- и l-ряды. Открытые и циклические формулы. Пиранозы и фуранозы. Α- и β-аномеры. Циклоцепная таутомерия. Явление муторотации.
- •31)Строение
- •32)Строение
- •33)Полисахариды. Классификация. Функции
- •34)Дисахариды. Структура и свойства мальтозы, лактозы, сахарозы, целлобиозы
- •35)Гомополисахариды: крахмал (амилоза и амилопектин), гликоген, целлюлоза. Строение, свойства, биологическая роль
- •36)Гетерополисахариды: гиалуроновая кислота, хондроитинсульфаты. Строение, биологическая роль
- •37)Азотистые основания пуриновые (аденин, гуанин) и пиримидиновые (тимин, урацил, цитозин). Строение, лактим-лактамная таутомерия.
- •39)Нуклеотиды: строение, номенклатура, характер связи. Гидролиз нуклеотидов.
- •39) Свободные нуклеотиды: цамф и цгмф, атф, адф, фад, над. Строение, функции.
- •41) Первичная структура нуклеиновых кислот. Нуклеотидный состав днк и рнк.
- •42)Понятие о вторичной структуре днк. Комплементарность нуклеиновых оснований. Водородные связи в комплементарных парах нуклеиновых оснований.
- •43)Аминокислоты номенклатура и классификация.
- •1. Моноаминомонокарбоновые.
- •44)Кислотно-основные свойства аминокислот.
- •45)Химические свойства аминокислот.Биологически важные свойства аминокислот.
- •I. Общие свойства
- •II. Свойства карбоксильной группы (кислотность)
- •III. Свойства аминогруппы (основность)
- •1. С сильными кислотами → соли:
- •IV. Качественная реакция
- •1. Все аминокислоты окисляются нингидрином с образованием продуктов сине-фиолетового цвета!
- •46)Физиологические активные пептиды. Примеры.
- •47)Уровни организации белковой молекулы.
- •48)Вторичная структура белка
- •49)Третичная и четвертичная структуры белков. Олигомерные белки.
- •50) Классификация белков
- •51)Физико-химические свойства белков
- •52)Особенности растворов вмс: набухание и растворение
- •53)Аномальная вязкость растворов вмс.
- •54)Классификация сложных белков
- •56) Кооперативное связывание кислорода гемоглобином, эффект Бора, влияние 2,3-бфг на сродство гемоглобина к кислороду.
15) Влияние различных факторов на кислотные и основные свойства веществ. Примеры.
Все то, что усиливает кислотные свойства, уменьшает основные.
1) Сольватация - это совокупность всех процессов, сопровождающих перенос рассматриваемой частицы из состояния, где она максимально изолирована от взаимодействий с другими частицами (идеальный газ), в раствор.
2) Влияние заместителей - электронно-донорныйе усиливают свойства, электронно-акцепторные - уменьшают.
3) Влияние растворителя
4) Природа гетероатом в основном центре - сила оснований зависит от Э.О. гетероатом ( чем больше Э.О. атома, тем слабее основные свойства)
16) Спирты и фенолы. Многотомные спирты.
Однотомные спирты получают
1) Гидратацией алкенов в кислой среде
2) Гидролизом галогенпроизводных
3) Восстановлением карбонильных соединений
4) Взаимодействием первичных админов с азотистой кислотой.
Однотомные фенолы могут быть получены взаимодействием ароматических сульфокислот с гидроксидами щелочных металлов.
Медико-биологическое значение и применение в народном хозяйстве.
Этиловый спирт в больших количествах вызывает состояние, близкое к наркозу, используется для приготовления настоек и обеззараживающего средства
Метиловый спирт - сильный яд, в пищеварительном тракте образует формальдегид и муравьиную кислоту
ФЕНОЛЫ применят как дезинфицирующие средства.
ФЕНОЛ или карболовая кислота - первый антисептик введенный в хирургию, может вызвать ожог кожи, широко используется для производства пластмасс, лекарственных средств.
Многотомные спирты
Этиленгликоль C2H6O2 - токсичная жидкость
Глицерин C3H8O3 - нетактичная вязкая бесцветная жидкость сладкого вкуса
Получение многотомных спиртов
1. Каталитическая гидратация оксида этилена (получение этиленгликоля):
2. Взаимодействие дигалогенпроизводных алканов с водными растворами щелочей:
3. Из синтез-газа:
2CO + 3H2 250°,200МПа,kat → CH2(OH)-CH2(OH)
17)Химические свойства спиртов
1)Горение:
C2H5OH + 3O2
![]() 2CO2
+3H2O + Q
2CO2
+3H2O + Q
2)Реакции с щелочными и щелочноземельными металлами ("кислотные" свойства):Атомы водорода гидроксильных групп молекул спиртов, также как и атомы водорода в молекулах воды, могут восстанавливаться атомами щелочных и щелочноземельных металлов ("замещаться" на них).
2Na
+ 2H—O—H
2NaOH
+ H2![]()
2Na + 2R—O—H 2RONa + H2
3)Реакции с галогеноводородами:
C2H5OH
+ HBr
![]() C2H5Br
+ H2O
C2H5Br
+ H2O
4)Внутримолекулярная дегидратация (t > 140oС, образуются алкены):
C2H5OH
![]() C2H4
+ H2O
C2H4
+ H2O
5)Межмолекулярная дегидратация (t < 140oС, образуются простые эфиры):
2C2H5OH C2H5OC2H5 + H2O
6)Окисление (мягкое, до альдегидов):
CH3CH2OH
+ CuO
![]() CH3—CHO
+ Cu + H2O
CH3—CHO
+ Cu + H2O
Это качественная реакция на спирты: цвет осадка изменяется с черного на розовый, ощущается своеобразный "фруктовый" запах альдегида).
18) Альдегиды, особенности строения карбонильный группы. Химические свойства альдегидов: образование
ацеталей и полуацеталей, реакция диспропорционирования и альдольной конденсации, ОВР, образование оснований Шифра.
Альдегиды и кислородсодержащие органические соединения, содержа-щие карбонильную группу (-С=О).Общая
формула
карбонильных соединений: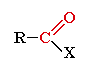
В альдегидах Х = Н (исключением является формальдегид (R = Х = H);
Строение карбонильной группы C=O
Свойства альдегидов определяются строением карбонильной группы >C=O.
Атомы углерода и кислорода в карбонильной группе находятся в состоянии sp2-гибридизации. Углерод своими sp2-гибридными орбиталями образует 3 s-связи (одна из них - связь С–О), которые располагаются в одной плоскости под углом около 120° друг к другу. Одна из трех sp2-орбиталей кислорода участвует в s-связи С–О, две другие содержат неподеленнные электронные пары.
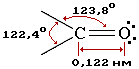
p-Связь образована р-электронами атомов углерода и кислорода.

Связь С=О сильно поляризована. Электроны кратной связи С=О, в особенности более подвижные p-электроны, смещены к электроотрицательному атому кислорода, что приводит к появлению на нем частичного отрицательного заряда. Карбонильный углерод приобретает частичный положительный заряд.
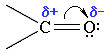
Поэтому углерод подвергается атаке нуклеофильными реагентами, а кислород - электрофильными, в том числе и протонами Н+.
В составе альдегидов имеется оксо-группа. В оксо-группе электронная плотность смещена в сторону более электроотрицательного кислорода и на атоме углерода этой группы возникает положительный заряд.Следовательно для альдегидов характерным является способность вступать в химические реакции, протекающие по механизму нуклеофильного присоединения
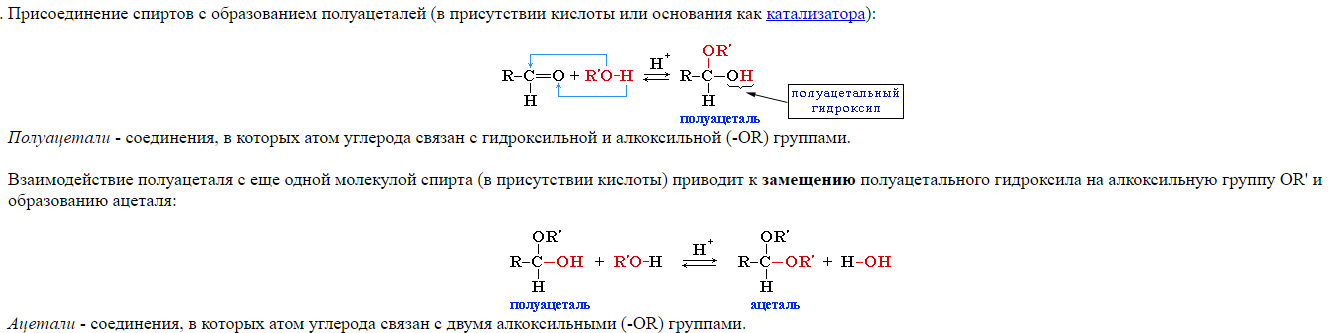
Альдегиды
и кетоны реагируют с первичными аминами
с образованием иминов (оснований Шиффа,
азометинов).