
- •1. Ферменти: визначення; властивості ферментів як біологічних каталізаторів
- •2. Класифікація та номенклатура ферментів, характеристика окремих класів ферментів
- •3. Будова та механізми дії ферментів. Активний та алостеричний (регуляторний) центри
- •4. Кофактори та коферменти. Будова та властивості коферментів; вітаміни як попередники в біосинтезі коферментів
- •5. Коферменти: типи реакцій, які каталізують окремі класи коферментів
- •6. Вітамін в1 (тіамін): будова, біологічні властивості, механізм дії
- •7. Вітамін в2 (рибофлавін): будова, біологічні властивості, механізм дії
- •8. Вітамін рр (нікотинова кислота, нікотинамід): будова, біологічні властивості, механізм дії
- •9. Вітамін в6 (піридоксин): будова, біологічні властивості, механізм дії
- •10. Вітамін в12 (кобаламін): біологічні властивості, механізм дії
- •11. Вітамін Вс (фолієва кислота): біологічні властивості, механізм дії.
- •12. Вітамін н (біотин): біологічні властивості, механізм дії
- •13. Вітамін в3 (пантотенова кислота): біологічні властивості, механізм дії
- •14. Вітамін с (аскорбінова кислота): будова, біологічні властивості, механізм дії
- •15. Вітамін р (флавоноїди): будова, біологічні властивості, механізм дії
- •16. Ізоферменти, особливості будови та функціонування, значення в діагностиці захворювань
- •17. Механізми дії та кінетика ферментативних реакцій: залежність швидкості реакції від концентрації субстрату, рН та температури
- •18. Активатори та інгібітори ферментів: приклади та механізми дії
- •19. Типи інгібування ферментів: зворотнє (конкурентне, неконкурентне) та незворотнє інгібування
- •20. Регуляція ферментативних процесів. Шляхи та механізми регуляції: алостеричні ферменти; ковалентна модифікація ферментів
- •21. Циклічні нуклеотиди (цАмф, цГмф) як регулятори ферментативних реакцій та біологічних функцій клітини
- •22. Ензимопатії – уроджені (спадкові) вади метаболізму вуглеводів, амінокислот, порфіринів, пуринів
- •23. Ензимодіагностика патологічних процесів та захворювань
- •24. Ензимотерапія – застосування ферментів, їх активаторів та інгібіторів в медицині
- •25. Принципи та методи виявлення ферментів у біооб'єктах. Одиниці виміру активності та кількості ферментів
- •26. Обмін речовин (метаболізм) - загальні закономірності протікання катаболічних та анаболічних процесів
- •27. Спільні стадії внутрішньоклітинного катаболізму біомолекул: білків, вуглеводів, ліпідів
- •28. Цикл трикарбонових кислот. Локалізація, послідовність ферментативних реакцій, значення в обміні речовин
- •29. Енергетичний баланс циклу трикарбонових кислот. Фізіологічне значення реакцій цтк
- •30. Реакції біологічного окислення; типи реакцій (дегідрогеназні, оксидазні, оксигеназні) та їх біологічне значення. Тканинне дихання
- •31. Ферменти біологічного окислення в мітохондріях: піридин-, флавін-залежні дегідрогенази, цитохроми
- •32. Послідовність компонентів дихального ланцюга мітохондрій. Молекулярні комплекси внутрішніх мембран мітохондрій.
- •33. Окисне фосфорилювання: пункти спряження транспорту електронів та фосфорилювання, коефіцієнт окисного фосфорилювання
- •34. Хеміосмотична теорія окисного фосфорилювання, атф-синтетаза мітохондрій.
- •35. Інгібітори транспорту електронів та роз’єднувачі окисного фосфорилювання
- •36. Мікросомальне окислення: цитохром р-450; молекулярна організація ланцюга переносу електронів.
- •37. Анаеробне окислення глюкози. Послідовність реакцій та ферменти гліколізу
- •2. Перетворення (ізомеризація) глюкоза-б-фосфату у фруктоза-6-фосфат (ферм. Фосфогексоізомеразою)
- •5. Взаємоперетворення двох фосфотріоз (доаф та г -3-ф ), що каталізується ферментом тріозофосфатізомеразою:
- •6.2. Перетворення 1,3-дифосфогліцерату на 3-фосфогліцерат (ферментом фосфогліцераткіназою)
- •38. Аеробне окислення глюкози. Етапи перетворення глюкози до со2 і н2о.
- •39. Окислювальне декарбоксилювання пірувату. Ферменти, коферменти та послідовність реакцій в мультиферментному комплексі
- •40. Порівняльна характеристика біоенергетики аеробного та анаеробного окислення глюкози, ефект Пастера.
- •41. Фосфоролітичний шлях розщеплення глікогену в печінці та м'язах. Регуляція активності глікогенфосфорилази.
- •42. Біосинтез глікогену: ферментативні реакції, фізіологічне значення. Регуляція активності глікогенсинтази.
- •43. Механізми реципрокної регуляції глікогенолізу та глікогенезу за рахунок каскадного цАмф-залежного фосфорилювання ферментних білків.
- •44. Роль адреналіну, глюкагону та інсуліну в гормональній регуляції обміну глікогену в м'язах та печінці.
- •45. Генетичні порушення метаболізму глікогену (глікогенози, аглікогенози).
- •1. Піруват у фосфоенолпіруват. – у дві стадії,
- •2. Фруктозо-1,6-дифосф. У фруктозо-6-фосф.:
- •3. Глюкозо-6-фосф. У глюкозу:
- •47. Глюкозо-лактатний (цикл Корі) та глюкозо-аланіновий цикли.
- •48. Глюкоза крові (глюкоземія): нормоглікемія, гіпо- та гіперглікемії, глюкозурія.
- •49. Гормональна регуляція концентрації та обміну глюкози крові.
- •50. Пентозофосфатний шлях окислення глюкози: схема процесу та біологічне значення
- •2.6 Ізомеризація 5 фрукт.-6-фосф. (ферм. Фосфогексоізомераза).
- •51. Метаболічні шляхи перетворення фруктози та галактози; спадкові ензимопатії їх обміну.
- •52. Катаболізм триацилгліцеролів в адипоцитах жирової тканини: послідовність реакцій, механізми регуляції активності тригліцеридліпази.
- •53. Нейрогуморальна регуляція ліполізу за участю адреналіну, норадреналіну, глюкагону та інсуліну
- •54. Реакції окислення жирних кислот (β-окислення); роль карнітину в транспорті жирних кислот в мітохондрії.
- •55. Окислення гліцеролу: ферментативні реакції, біоенергетика
- •56. Кетонові тіла. Реакції біосинтезу та утилізації кетонових тіл, фізіологічне значення.
- •57. Порушення обміну кетонових тіл за умов патології (цукровий діабет,голодування)
- •58. Біосинтез вищих жирних кислот: реакції біосинтезу насичених жирних кислот (пальмітату) та регуляція процесу.
- •1.Регуляція на рівні ацетил-КоА-карбоксилази.
- •2. Регуляція на рівні комплексу синтетази жирних кислот
- •59. Біосинтез моно- та поліненасичених жирних кислот в організмі людини
- •60. Біосинтез триацилгліцеролів та фосфогліцеридів
- •61. Метаболізм сфінголіпідів. Генетичні аномалії обміну сфінголіпідів – сфінголіпідози.
- •62. Біосинтез холестеролу: схема реакцій, регуляція синтезу холестеролу.
- •63. Шляхи біотрансформації холестерину: етерифікація; утворення жовчних кислот, стероїдних гормонів, вітаміну d3.
- •2. Біосинтез стероїдних гормонів
- •64. Циркуляторний транспорт та депонування ліпідів у жировій тканині. Ліпопротеїнліпаза ендотелію
- •65. Ліпопротеїни плазми крові: ліпідний та білковий (апопротеїни) склад. Гіперліпопротеїнемії
- •66. Патології ліпідного обміну: атеросклероз, ожиріння, цукровий діабет
- •67. Пул вільних амінокислот в організмі: шляхи надходження та використання вільних амінокислот в тканинах.
- •68. Трансамінування амінокислот: реакції та їх біохімічне значення, механізми дії амінотрансфераз.
- •1) Взаємодія амінокислоти, що втрачає аміногрупу, з піридоксальфосфатом з утворенням кетокислоти та піридоксамінфосфату:
- •2) Взаємодія а-кетокислоти, що акцептує аміногрупу, з піридоксамінфосфатом з утворенням нової амінокислоти та регенерацією піридоксальфосфату:
- •69. Пряме та непряме дезамінування вільних l-амінокислот в тканинах
- •70. Декарбоксилювання l-амінокислот в організмі людини. Фізіологічне значення утворених продуктів. Окислення біогенних амінів
- •1. Утворення фізіологічно активних сполук - гормонів, медіаторів, регуляторних факторів місцевої дії:
- •71. Шляхи утворення та знешкодження аміаку в організмі.
- •72. Біосинтез сечовини: послідовність ферментних реакцій біосинтезу, генетичні аномалії ферментів циклу сечовини
- •73. Загальні шляхи метаболізму вуглецевих скелетів амінокислот в організмі людини. Глюкогенні та кетогенні амінокислоти.
- •74. Біосинтез та біологічна роль креатину і креатинфосфату
- •75. Глутатіон: будова, біосинтез та біологічні функції глутатіону
- •76. Спеціалізовані шляхи метаболізму циклічних амінокислот – фенілаланіну, та тирозину
- •1. Шляхи метаболізму фенілаланіну
- •2. Шляхи метаболізму тирозину
- •2.3. Шлях синтезу тиреоїдних гормонів - реалізується в клітинах щитовидної залози і полягає в утворенні йодованих тиронінів.
- •77. Спадкові ензимопатії обміну циклічних амінокислот – фенілаланіну та тирозину
- •78. Метаболізм порфіринів: будова гему; схема реакцій біосинтезу протопорфірину IX та гему
- •3) Взаимодействие двух молекул δ -аминолевуленовой кислоты в реакции дегидратации с образованием порфобилиногена
- •4.1. Синтез із чотирьох молекул порфобіліногену уропорфіриногену ііі:
- •2)Білка уропорфіриноген ііі-косинтази.
16. Ізоферменти, особливості будови та функціонування, значення в діагностиці захворювань
Ізоферменти (ізоензими; ізозими) – множинні молекулярні форми одного й того ж ферменту. Ізоферменти каталізують одну й ту ж біохімічну реакцію, але розрізняються за своєю первинною структурою і, відповідно, фізико-хімічними (молекулярною масою, рухомістю при електрофорезі тощо) та каталітичними (різною спорідненістю ферменту із субстратом - Кm ) властивостями. Різні ізоферменти одного й того ж ферменту можуть бути присутні в різних органах і тканинах (ізоферменти лактатдегідрогенази), субклітинних структурах (мітохондріальний та цитозольний ізоферменти ізоцитратдегідрогенази).
ЛДГ

ЛДГ1 (HHHH) – серцевий м’яз (збільшується при інфаркті міокарда), еритроцити
ЛДГ2 (HHHM) - серцевий м’яз, нирки, мозок
ЛДГ3 (HHMM) - лімфоїдна тканина, селезінка, деякі ендокринні залози
ЛДГ4 (HMMM) - печінка (гепатит), легені, плацента
ЛДГ 5 (MMMM) - м’язи
Норма: ЛДГ2 > ЛДГ1 > ЛДГ3 > ЛДГ4 > ЛДГ5
Гемолітична анемія: ЛДГ2+ЛДГ1 > ЛДГ3+ЛДГ4+ЛДГ5 (активність збільшена у 2-5 разів)
Інфаркт міокарда: ЛДГ4 > ЛДГ2 > ЛДГ3 > ЛДГ1 > ЛДГ 5 (активність у 10 разів вища)
Причины повышения активности лактатдегидрогеназы общей:
инфаркт миокарда,
легочная эмболия и инфаркт легкого,
заболевания крови, сопровождающиеся гемолизом (гемолитическая, пернициозная, мегалобластическая, серповидно-клеточная анемии, эритремия),
злокачественные новообразования различных локализаций (рак яичек, рак печени, лимфома, метастазы в костную ткань и печень и т. д.),
лейкозы,
патология печени (вирусные и токсические гепатиты, цирроз печени, обтурационная желтуха, алкогольная болезнь печени),
болезни почек (инфаркт почки, гломерулонефрит, пиелонефрит),
патология мышц (мышечная дистрофия, травма, атрофия),
переломы костей,
застойная сердечная недостаточность, острая коронарная недостаточность (без инфаркта), миокардит (умеренное повышение фермента),
инфекционный мононуклеоз,
инфаркт кишечника,
преждевременная отслойка плаценты.
Креатинфосфокиназа
КФК (КФ 2.7.3.2.) существует в виде 3
изоферментов:
КФК-ВВ (мозговая) черепно-мозговая травма, заболевания ЦНС
КФК-МВ (сердечная) инфаркт миокарда, кардиомиопатии, миокардит, аритмии
КФК-ММ (мышечная) травмы, миопатии, отравления, инфекции, шок, физические нагрузки
Підвищення активності КФК:
Гострий інфаркт міокарда
Гострий міокардит, травми, операції на серці
Деякі клінічні варіанти нестабільної стенокардії
Ураження скелетних м’язів
Внутрішньовенні та внутрішньом’язові ін’єкції
Рідше – генералізовані судоми, виражене фізичне навантаження, емболія легеневої артерії
17. Механізми дії та кінетика ферментативних реакцій: залежність швидкості реакції від концентрації субстрату, рН та температури
Вплив концентрації фермента та субстрату на швидкість ферментативної реакції.
Швидкість будь-якої ферментативної реакції залежить від концентрації фермента. У переважній більшості випадків у початковий період реакції, за умови надлишку фермента та невеликої кількості продукту швидкість реакції (V) прямо пропорційна його концентрації – [Е] і має лінійний характер: V=К×[Е], де К – коефіцієнт (рис. 4, А). Але з часом кількість продукту зростає і з’являється можливість для перебігу зворотної реакції, внаслідок чого лінійна залежність втрачається. Якщо ж концентрацію фермента залишити постійною, змінюючи лише концентрацію субстрату [S], то графік швидкості ферментативної реакції буде описуватися гіперболою (рис. 4, Б).
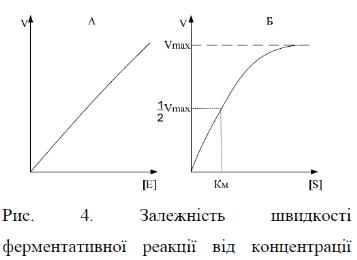
При збільшенні кількості субстрату початкова швидкість зростає і коли фермент повністю насичується субстратом, тобто відбувається максимально можливе утворення фермент-субстратних комплексів, спостерігають найвищу швидкість утворення продукту. Але подальше збільшення концентрації субстрату не призведе до збільшення утворення продукту, оскільки швидкість реакції збільшуватися не буде. Описаний стан відповідає максимальній швидкості реакції (V max).
Ферментативна реакція є двостадійною. На першій стадії фермент вступає в швидку зворотну взаємодію з субстратом з утворенням фермент-субстратного комплексу (ES), а під час другої стадії, яка відбувається повільніше і лімітує швидкість процесу, комплекс ES розпадається з утворенням продукту реакції (Р) та відновленого стану ферменту:

де к1 – константа швидкості утворення ES, к-1 – константа швидкості зворотної реакції (розпаду ES), к2 – константа швидкості утворення продукту реакції. Співвідношення констант швидкостей (к-1 + к2) / к1 називають константою Міхаеліса (КМ). На основі цього було виведено рівняння, яке пов’язує V і [S], відоме під назвою рівняння Міхаеліса:

де: V – початкова швидкість реакції, тобто швидкість, що реєструється впродовж періоду часу, за який рівень субстрату не перевищує 10 %. У цей період швидкість реакції можна вважати приблизно постійною, оскільки, поперше, зменшення кількості субстрату невелике, а по-друге, концентрація продукту незначна. Vмакс дає характеристику каталітичній активності фермента і має розмірність швидкості ферментативної реакції моль/л, тобто, вона визначає максимальну можливість утворення продукту при певній концентрації фермента в умовах надлишку субстрату. У випадку, коли швидкість реакції рівна половині максимальної (V = Vmax/2), то КМ = [S]. Таким чином, константа Міхаеліса чисельно дорівнює концентрації субстрату, при якій швидкість ферментативної реакції становить половину від максимальної. Ця величина характеризує спорідненість того чи іншого фермента до конкретного субстрата і є величиною постійною, незалежною від концентрації фермента. Якщо КМ значно більша від [S], Рис. 5. Графік Лайнуівера-Берка тобто Км >> S, то сума (КМ + S) приблизно дорівнює КМ, відповідно рівняння набуває вигляду: V = Vмакс × [S] / КМ. У цьому випадку швидкість ферментативної реакції прямо пропорційна концентрації субстрату, тобто при малих концентраціях субстрату швидкість буде зростати із збільшенням концентрації. Якщо [S] >> КМ, то зростання концентрації субстрату на величину КМ + [S] практично не впливає і нею можна знехтувати. Тому швидкість реакції буде дорівнювати максимальній швидкості: V = Vмакс.
Залежність швидкості ферментативної реакції від температури.
Зростання температури до певних визначених меж чинить вплив на швидкість ферментативної реакції, подібно до впливу температури на будь-яку хімічну реакцію, що супроводжується прискоренням руху молекул і, відповідно, прискоренням ймовірності взаємодії реагуючих речовин. Крім того, температура може підвищувати енергію реагуючих речовин, що теж прискорює реакцію. Однак, швидкість ферментативної реакції має свій температурний оптимум, перевищення якого супроводжується зниженням ферментативної активності внаслідок термічної денатурації білкових молекул (рис. 6).

Рис. 6. Вплив температури на швидкість ферментативної реакції: 1 – зростання швидкості реакції при підвищенні температури; 2 - зниження швидкості реакції при денатурації фермента
Для більшості ферментів людини оптимальна температура 37-40 °С, проте в природі існують і термостабільні ферменти.
Зниження температури нижче оптимальної тимчасово сповільнює активність ферменту внаслідок зменшення процесів дифузії молекул; повернення того чи іншого фермента в оптимальне температурне середовище відновлює його активність. Цю здатність ферментів широко використовують у медицині для пригнічення метаболічних процесів у тканинах (під час трансплантації органів, операцій на серці), у фармації для збереження препаратів і лікарських форм (наприклад, білкових препаратів, відварів, настоїв, емульсій тощо.
Залежність швидкості ферментативної реакції від pH середовища. Для кожного фермента існує певне значення рН середовища, в якому він виявляє максимальну активність. Для пепсину воно становить 1,5 – 2,0, піруваткарбоксилази 4,8, аргінази – 9,5 – 10,0. Проте, більшість ферментів організму людини мають оптимум рН, наближений до нейтрального: фумараза 6,5; каталаза 6,8 – 7; уреаза 6,8 – 7,2; амілаза слини 6,8 – 7,4, карбоксипептидаза 7,5; трипсин 7,5 – 8,5, (рис. 7).
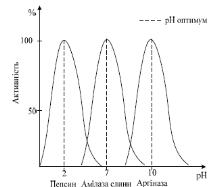
Рис. 7. Залежність швидкості ферментативної реакції від рН середовища
Вплив рН на активність фермента пов’язаний із іонізацією функціональних груп амінокислотних залишків білкової молекули, що забезпечує оптимальну конформацію активного центра. Відхилення рН від оптимальних величин порушує іонізацію функціональних груп в активному центрі фермента. Так, наприклад, залуження середовища спричинює від’єднання іонів Н+ від карбоксильних груп (СОО-), тоді як закиснення, навпаки, приєднання протонів до вільних аміногруп (NН3+). Це викликає зниження активності ферменту, порушує спорідненість субстрату до фермента і гальмує каталітичний процес в цілому. При значному відхиленні від оптимального значення рН може відбуватися денатурація білкової молекули з повною втратою ферментативної активності. Зміна рН середовища може також впливати і на просторову організацію субстрату.
