
- •1. Ферменти: визначення; властивості ферментів як біологічних каталізаторів
- •2. Класифікація та номенклатура ферментів, характеристика окремих класів ферментів
- •3. Будова та механізми дії ферментів. Активний та алостеричний (регуляторний) центри
- •4. Кофактори та коферменти. Будова та властивості коферментів; вітаміни як попередники в біосинтезі коферментів
- •5. Коферменти: типи реакцій, які каталізують окремі класи коферментів
- •6. Вітамін в1 (тіамін): будова, біологічні властивості, механізм дії
- •7. Вітамін в2 (рибофлавін): будова, біологічні властивості, механізм дії
- •8. Вітамін рр (нікотинова кислота, нікотинамід): будова, біологічні властивості, механізм дії
- •9. Вітамін в6 (піридоксин): будова, біологічні властивості, механізм дії
- •10. Вітамін в12 (кобаламін): біологічні властивості, механізм дії
- •11. Вітамін Вс (фолієва кислота): біологічні властивості, механізм дії.
- •12. Вітамін н (біотин): біологічні властивості, механізм дії
- •13. Вітамін в3 (пантотенова кислота): біологічні властивості, механізм дії
- •14. Вітамін с (аскорбінова кислота): будова, біологічні властивості, механізм дії
- •15. Вітамін р (флавоноїди): будова, біологічні властивості, механізм дії
- •16. Ізоферменти, особливості будови та функціонування, значення в діагностиці захворювань
- •17. Механізми дії та кінетика ферментативних реакцій: залежність швидкості реакції від концентрації субстрату, рН та температури
- •18. Активатори та інгібітори ферментів: приклади та механізми дії
- •19. Типи інгібування ферментів: зворотнє (конкурентне, неконкурентне) та незворотнє інгібування
- •20. Регуляція ферментативних процесів. Шляхи та механізми регуляції: алостеричні ферменти; ковалентна модифікація ферментів
- •21. Циклічні нуклеотиди (цАмф, цГмф) як регулятори ферментативних реакцій та біологічних функцій клітини
- •22. Ензимопатії – уроджені (спадкові) вади метаболізму вуглеводів, амінокислот, порфіринів, пуринів
- •23. Ензимодіагностика патологічних процесів та захворювань
- •24. Ензимотерапія – застосування ферментів, їх активаторів та інгібіторів в медицині
- •25. Принципи та методи виявлення ферментів у біооб'єктах. Одиниці виміру активності та кількості ферментів
- •26. Обмін речовин (метаболізм) - загальні закономірності протікання катаболічних та анаболічних процесів
- •27. Спільні стадії внутрішньоклітинного катаболізму біомолекул: білків, вуглеводів, ліпідів
- •28. Цикл трикарбонових кислот. Локалізація, послідовність ферментативних реакцій, значення в обміні речовин
- •29. Енергетичний баланс циклу трикарбонових кислот. Фізіологічне значення реакцій цтк
- •30. Реакції біологічного окислення; типи реакцій (дегідрогеназні, оксидазні, оксигеназні) та їх біологічне значення. Тканинне дихання
- •31. Ферменти біологічного окислення в мітохондріях: піридин-, флавін-залежні дегідрогенази, цитохроми
- •32. Послідовність компонентів дихального ланцюга мітохондрій. Молекулярні комплекси внутрішніх мембран мітохондрій.
- •33. Окисне фосфорилювання: пункти спряження транспорту електронів та фосфорилювання, коефіцієнт окисного фосфорилювання
- •34. Хеміосмотична теорія окисного фосфорилювання, атф-синтетаза мітохондрій.
- •35. Інгібітори транспорту електронів та роз’єднувачі окисного фосфорилювання
- •36. Мікросомальне окислення: цитохром р-450; молекулярна організація ланцюга переносу електронів.
- •37. Анаеробне окислення глюкози. Послідовність реакцій та ферменти гліколізу
- •2. Перетворення (ізомеризація) глюкоза-б-фосфату у фруктоза-6-фосфат (ферм. Фосфогексоізомеразою)
- •5. Взаємоперетворення двох фосфотріоз (доаф та г -3-ф ), що каталізується ферментом тріозофосфатізомеразою:
- •6.2. Перетворення 1,3-дифосфогліцерату на 3-фосфогліцерат (ферментом фосфогліцераткіназою)
- •38. Аеробне окислення глюкози. Етапи перетворення глюкози до со2 і н2о.
- •39. Окислювальне декарбоксилювання пірувату. Ферменти, коферменти та послідовність реакцій в мультиферментному комплексі
- •40. Порівняльна характеристика біоенергетики аеробного та анаеробного окислення глюкози, ефект Пастера.
- •41. Фосфоролітичний шлях розщеплення глікогену в печінці та м'язах. Регуляція активності глікогенфосфорилази.
- •42. Біосинтез глікогену: ферментативні реакції, фізіологічне значення. Регуляція активності глікогенсинтази.
- •43. Механізми реципрокної регуляції глікогенолізу та глікогенезу за рахунок каскадного цАмф-залежного фосфорилювання ферментних білків.
- •44. Роль адреналіну, глюкагону та інсуліну в гормональній регуляції обміну глікогену в м'язах та печінці.
- •45. Генетичні порушення метаболізму глікогену (глікогенози, аглікогенози).
- •1. Піруват у фосфоенолпіруват. – у дві стадії,
- •2. Фруктозо-1,6-дифосф. У фруктозо-6-фосф.:
- •3. Глюкозо-6-фосф. У глюкозу:
- •47. Глюкозо-лактатний (цикл Корі) та глюкозо-аланіновий цикли.
- •48. Глюкоза крові (глюкоземія): нормоглікемія, гіпо- та гіперглікемії, глюкозурія.
- •49. Гормональна регуляція концентрації та обміну глюкози крові.
- •50. Пентозофосфатний шлях окислення глюкози: схема процесу та біологічне значення
- •2.6 Ізомеризація 5 фрукт.-6-фосф. (ферм. Фосфогексоізомераза).
- •51. Метаболічні шляхи перетворення фруктози та галактози; спадкові ензимопатії їх обміну.
- •52. Катаболізм триацилгліцеролів в адипоцитах жирової тканини: послідовність реакцій, механізми регуляції активності тригліцеридліпази.
- •53. Нейрогуморальна регуляція ліполізу за участю адреналіну, норадреналіну, глюкагону та інсуліну
- •54. Реакції окислення жирних кислот (β-окислення); роль карнітину в транспорті жирних кислот в мітохондрії.
- •55. Окислення гліцеролу: ферментативні реакції, біоенергетика
- •56. Кетонові тіла. Реакції біосинтезу та утилізації кетонових тіл, фізіологічне значення.
- •57. Порушення обміну кетонових тіл за умов патології (цукровий діабет,голодування)
- •58. Біосинтез вищих жирних кислот: реакції біосинтезу насичених жирних кислот (пальмітату) та регуляція процесу.
- •1.Регуляція на рівні ацетил-КоА-карбоксилази.
- •2. Регуляція на рівні комплексу синтетази жирних кислот
- •59. Біосинтез моно- та поліненасичених жирних кислот в організмі людини
- •60. Біосинтез триацилгліцеролів та фосфогліцеридів
- •61. Метаболізм сфінголіпідів. Генетичні аномалії обміну сфінголіпідів – сфінголіпідози.
- •62. Біосинтез холестеролу: схема реакцій, регуляція синтезу холестеролу.
- •63. Шляхи біотрансформації холестерину: етерифікація; утворення жовчних кислот, стероїдних гормонів, вітаміну d3.
- •2. Біосинтез стероїдних гормонів
- •64. Циркуляторний транспорт та депонування ліпідів у жировій тканині. Ліпопротеїнліпаза ендотелію
- •65. Ліпопротеїни плазми крові: ліпідний та білковий (апопротеїни) склад. Гіперліпопротеїнемії
- •66. Патології ліпідного обміну: атеросклероз, ожиріння, цукровий діабет
- •67. Пул вільних амінокислот в організмі: шляхи надходження та використання вільних амінокислот в тканинах.
- •68. Трансамінування амінокислот: реакції та їх біохімічне значення, механізми дії амінотрансфераз.
- •1) Взаємодія амінокислоти, що втрачає аміногрупу, з піридоксальфосфатом з утворенням кетокислоти та піридоксамінфосфату:
- •2) Взаємодія а-кетокислоти, що акцептує аміногрупу, з піридоксамінфосфатом з утворенням нової амінокислоти та регенерацією піридоксальфосфату:
- •69. Пряме та непряме дезамінування вільних l-амінокислот в тканинах
- •70. Декарбоксилювання l-амінокислот в організмі людини. Фізіологічне значення утворених продуктів. Окислення біогенних амінів
- •1. Утворення фізіологічно активних сполук - гормонів, медіаторів, регуляторних факторів місцевої дії:
- •71. Шляхи утворення та знешкодження аміаку в організмі.
- •72. Біосинтез сечовини: послідовність ферментних реакцій біосинтезу, генетичні аномалії ферментів циклу сечовини
- •73. Загальні шляхи метаболізму вуглецевих скелетів амінокислот в організмі людини. Глюкогенні та кетогенні амінокислоти.
- •74. Біосинтез та біологічна роль креатину і креатинфосфату
- •75. Глутатіон: будова, біосинтез та біологічні функції глутатіону
- •76. Спеціалізовані шляхи метаболізму циклічних амінокислот – фенілаланіну, та тирозину
- •1. Шляхи метаболізму фенілаланіну
- •2. Шляхи метаболізму тирозину
- •2.3. Шлях синтезу тиреоїдних гормонів - реалізується в клітинах щитовидної залози і полягає в утворенні йодованих тиронінів.
- •77. Спадкові ензимопатії обміну циклічних амінокислот – фенілаланіну та тирозину
- •78. Метаболізм порфіринів: будова гему; схема реакцій біосинтезу протопорфірину IX та гему
- •3) Взаимодействие двух молекул δ -аминолевуленовой кислоты в реакции дегидратации с образованием порфобилиногена
- •4.1. Синтез із чотирьох молекул порфобіліногену уропорфіриногену ііі:
- •2)Білка уропорфіриноген ііі-косинтази.
31. Ферменти біологічного окислення в мітохондріях: піридин-, флавін-залежні дегідрогенази, цитохроми
1. Дегідрогенази, залежні від нікотинамідних коферментів (НАД(Ф)-залежні дегідрогенази).
Коферментами цих дегідрогеназ є нуклеотиди НАД або НАДФ, у структурі молекул яких міститься похідна піридину - нікотинамід. Зв'язок між НАД (або НАДФ) та білковою частиною ферменту (апоферментом) у складі піридинзалежних дегідрогеназ нестійкий: він утворюється та руйнується в процесі каталітичного циклу, що дозволяє вважати нікотинамідні нуклеотиди скоріше субстратами, ніж простетичними групами.
А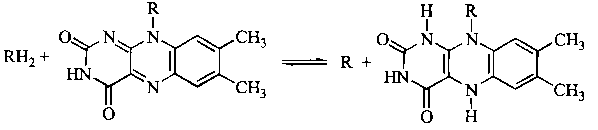 ктивною
структурою в молекулі НАД або НАДФ, що
акцептує відновлювальні еквіваленти
від субстрату, є піридинове кільце
никотинаміду. У ході ферментативної
реакції субстрат відщеплює два атоми
водню (2Н+
+ 2е-),
один з яких у формі гідридіона: Н-
(тобто Н+
+ 2е-)
приєднується до піридинового кільця
НАД(Ф), а другий у вигляді протона (іона
Н+)
надходить у реакційне середовище. Як
свідчить наведене рівняння, під час
реакції до четвертого вуглецевого атома
нікотинаміду приєднується атом водню
(тобто Н++
е-),
а додатковий електрон гідридіона
взаємодіє з азотом піридинового кільця.
Дегідрогенази, залежні від нікотинамідних
коферментів, дуже поширені в живих
клітинах. Вони виконують функції
анаеробних дегідрогеназ, що відщеплюють
протони та електрони від багатьох
субстратів, відновлюючи НАД або НАДФ,
які передають в подальшому відновлювальні
еквіваленти на інші акцептори. НАД-залежні
дегідрогенази - ці ферменти каталізують
окислювально-відновлювальні реакції,
що містяться на окислювальних шляхах
метаболізму - гліколізу, циклу лимонної
кислоти, β-окислення жирних кислот,
окисного дезамінування амінокислот,
дихального ланцюга мітохондрій.
НАДФ-залежні дегідрогенази - ці ферменти
беруть участь у процесах відновлювального
синтезу, що відбуваються в цитозолі,
зокрема постачають атоми водню при
синтезі жирних кислот та стероїдів.
Головним джерелом відновленого НАДФ є
дегідрогеназні реакції пентозофосфатного
шляху окислення глюкози.
ктивною
структурою в молекулі НАД або НАДФ, що
акцептує відновлювальні еквіваленти
від субстрату, є піридинове кільце
никотинаміду. У ході ферментативної
реакції субстрат відщеплює два атоми
водню (2Н+
+ 2е-),
один з яких у формі гідридіона: Н-
(тобто Н+
+ 2е-)
приєднується до піридинового кільця
НАД(Ф), а другий у вигляді протона (іона
Н+)
надходить у реакційне середовище. Як
свідчить наведене рівняння, під час
реакції до четвертого вуглецевого атома
нікотинаміду приєднується атом водню
(тобто Н++
е-),
а додатковий електрон гідридіона
взаємодіє з азотом піридинового кільця.
Дегідрогенази, залежні від нікотинамідних
коферментів, дуже поширені в живих
клітинах. Вони виконують функції
анаеробних дегідрогеназ, що відщеплюють
протони та електрони від багатьох
субстратів, відновлюючи НАД або НАДФ,
які передають в подальшому відновлювальні
еквіваленти на інші акцептори. НАД-залежні
дегідрогенази - ці ферменти каталізують
окислювально-відновлювальні реакції,
що містяться на окислювальних шляхах
метаболізму - гліколізу, циклу лимонної
кислоти, β-окислення жирних кислот,
окисного дезамінування амінокислот,
дихального ланцюга мітохондрій.
НАДФ-залежні дегідрогенази - ці ферменти
беруть участь у процесах відновлювального
синтезу, що відбуваються в цитозолі,
зокрема постачають атоми водню при
синтезі жирних кислот та стероїдів.
Головним джерелом відновленого НАДФ є
дегідрогеназні реакції пентозофосфатного
шляху окислення глюкози.
2. Флавінзалежні дегідрогенази
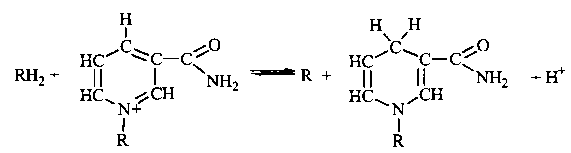 Дегідрогенази
цього типу за хімічною природою є
флавопротеїнами, простетичними групами
в яких є флавінаденіндинуклеотид (ФАД)
та флавінмононуклеотид (ФАД). На відміну
від піридинзалежних дегідрогеназ, у
більшості флавінзалежних ферментів
коферменти (ФАД та ФМН) міцно зв'язані
з білковою частиною і не відщеплюються
від неї на жодній стадії каталітичного
циклу. Виключенням є ФАД-залежна оксидаза
D-амінокислот, у складі якої білок має
низьку спорідненість із коферментом.
Активною частиною молекули ФАД або ФМН,
що бере участь в окислювально-відновлювальній
реакції, є ізоалоксазинове кільце
рибофлавіну, яке акцептує два атоми
водню (2Н+
+ 2е-)
від субстрату.
Дегідрогенази
цього типу за хімічною природою є
флавопротеїнами, простетичними групами
в яких є флавінаденіндинуклеотид (ФАД)
та флавінмононуклеотид (ФАД). На відміну
від піридинзалежних дегідрогеназ, у
більшості флавінзалежних ферментів
коферменти (ФАД та ФМН) міцно зв'язані
з білковою частиною і не відщеплюються
від неї на жодній стадії каталітичного
циклу. Виключенням є ФАД-залежна оксидаза
D-амінокислот, у складі якої білок має
низьку спорідненість із коферментом.
Активною частиною молекули ФАД або ФМН,
що бере участь в окислювально-відновлювальній
реакції, є ізоалоксазинове кільце
рибофлавіну, яке акцептує два атоми
водню (2Н+
+ 2е-)
від субстрату.
Цитохроми
- залізовмісні білки мітохондрій, що
належать до класу гемопротеїнів. У
цитохромах іон заліза входить до складу
металопорфіринового комплексу (гемінове
залізо), близького за хімічною структурою
до простетичних груп гемоглобіну та
міоглобіну. За рахунок оберненої зміни
валентності гемінового заліза цитохроми
виконують функцію транспорту електронів
у ланцюгах біологічного окислення в
аеробних клітинах:
![]()
Залежно від характерних особливостей спектрів поглинання, розрізняють три класи цитохромів (а, b, с). У мітохондріях еукаріотів наявні п'ять різновидів цитохромів - b, с, с1, а, а3; в ендоплазматичному ретикулумі гепатоцитів містяться цитохроми Р-450 та b5 що беруть участь у реакціях окислювального гідроксилування.
бх до 40
