
- •1. Ферменти: визначення; властивості ферментів як біологічних каталізаторів
- •2. Класифікація та номенклатура ферментів, характеристика окремих класів ферментів
- •3. Будова та механізми дії ферментів. Активний та алостеричний (регуляторний) центри
- •4. Кофактори та коферменти. Будова та властивості коферментів; вітаміни як попередники в біосинтезі коферментів
- •5. Коферменти: типи реакцій, які каталізують окремі класи коферментів
- •6. Вітамін в1 (тіамін): будова, біологічні властивості, механізм дії
- •7. Вітамін в2 (рибофлавін): будова, біологічні властивості, механізм дії
- •8. Вітамін рр (нікотинова кислота, нікотинамід): будова, біологічні властивості, механізм дії
- •9. Вітамін в6 (піридоксин): будова, біологічні властивості, механізм дії
- •10. Вітамін в12 (кобаламін): біологічні властивості, механізм дії
- •11. Вітамін Вс (фолієва кислота): біологічні властивості, механізм дії.
- •12. Вітамін н (біотин): біологічні властивості, механізм дії
- •13. Вітамін в3 (пантотенова кислота): біологічні властивості, механізм дії
- •14. Вітамін с (аскорбінова кислота): будова, біологічні властивості, механізм дії
- •15. Вітамін р (флавоноїди): будова, біологічні властивості, механізм дії
- •16. Ізоферменти, особливості будови та функціонування, значення в діагностиці захворювань
- •17. Механізми дії та кінетика ферментативних реакцій: залежність швидкості реакції від концентрації субстрату, рН та температури
- •18. Активатори та інгібітори ферментів: приклади та механізми дії
- •19. Типи інгібування ферментів: зворотнє (конкурентне, неконкурентне) та незворотнє інгібування
- •20. Регуляція ферментативних процесів. Шляхи та механізми регуляції: алостеричні ферменти; ковалентна модифікація ферментів
- •21. Циклічні нуклеотиди (цАмф, цГмф) як регулятори ферментативних реакцій та біологічних функцій клітини
- •22. Ензимопатії – уроджені (спадкові) вади метаболізму вуглеводів, амінокислот, порфіринів, пуринів
- •23. Ензимодіагностика патологічних процесів та захворювань
- •24. Ензимотерапія – застосування ферментів, їх активаторів та інгібіторів в медицині
- •25. Принципи та методи виявлення ферментів у біооб'єктах. Одиниці виміру активності та кількості ферментів
- •26. Обмін речовин (метаболізм) - загальні закономірності протікання катаболічних та анаболічних процесів
- •27. Спільні стадії внутрішньоклітинного катаболізму біомолекул: білків, вуглеводів, ліпідів
- •28. Цикл трикарбонових кислот. Локалізація, послідовність ферментативних реакцій, значення в обміні речовин
- •29. Енергетичний баланс циклу трикарбонових кислот. Фізіологічне значення реакцій цтк
- •30. Реакції біологічного окислення; типи реакцій (дегідрогеназні, оксидазні, оксигеназні) та їх біологічне значення. Тканинне дихання
- •31. Ферменти біологічного окислення в мітохондріях: піридин-, флавін-залежні дегідрогенази, цитохроми
- •32. Послідовність компонентів дихального ланцюга мітохондрій. Молекулярні комплекси внутрішніх мембран мітохондрій.
- •33. Окисне фосфорилювання: пункти спряження транспорту електронів та фосфорилювання, коефіцієнт окисного фосфорилювання
- •34. Хеміосмотична теорія окисного фосфорилювання, атф-синтетаза мітохондрій.
- •35. Інгібітори транспорту електронів та роз’єднувачі окисного фосфорилювання
- •36. Мікросомальне окислення: цитохром р-450; молекулярна організація ланцюга переносу електронів.
- •37. Анаеробне окислення глюкози. Послідовність реакцій та ферменти гліколізу
- •2. Перетворення (ізомеризація) глюкоза-б-фосфату у фруктоза-6-фосфат (ферм. Фосфогексоізомеразою)
- •5. Взаємоперетворення двох фосфотріоз (доаф та г -3-ф ), що каталізується ферментом тріозофосфатізомеразою:
- •6.2. Перетворення 1,3-дифосфогліцерату на 3-фосфогліцерат (ферментом фосфогліцераткіназою)
- •38. Аеробне окислення глюкози. Етапи перетворення глюкози до со2 і н2о.
- •39. Окислювальне декарбоксилювання пірувату. Ферменти, коферменти та послідовність реакцій в мультиферментному комплексі
- •40. Порівняльна характеристика біоенергетики аеробного та анаеробного окислення глюкози, ефект Пастера.
- •41. Фосфоролітичний шлях розщеплення глікогену в печінці та м'язах. Регуляція активності глікогенфосфорилази.
- •42. Біосинтез глікогену: ферментативні реакції, фізіологічне значення. Регуляція активності глікогенсинтази.
- •43. Механізми реципрокної регуляції глікогенолізу та глікогенезу за рахунок каскадного цАмф-залежного фосфорилювання ферментних білків.
- •44. Роль адреналіну, глюкагону та інсуліну в гормональній регуляції обміну глікогену в м'язах та печінці.
- •45. Генетичні порушення метаболізму глікогену (глікогенози, аглікогенози).
- •1. Піруват у фосфоенолпіруват. – у дві стадії,
- •2. Фруктозо-1,6-дифосф. У фруктозо-6-фосф.:
- •3. Глюкозо-6-фосф. У глюкозу:
- •47. Глюкозо-лактатний (цикл Корі) та глюкозо-аланіновий цикли.
- •48. Глюкоза крові (глюкоземія): нормоглікемія, гіпо- та гіперглікемії, глюкозурія.
- •49. Гормональна регуляція концентрації та обміну глюкози крові.
- •50. Пентозофосфатний шлях окислення глюкози: схема процесу та біологічне значення
- •2.6 Ізомеризація 5 фрукт.-6-фосф. (ферм. Фосфогексоізомераза).
- •51. Метаболічні шляхи перетворення фруктози та галактози; спадкові ензимопатії їх обміну.
- •52. Катаболізм триацилгліцеролів в адипоцитах жирової тканини: послідовність реакцій, механізми регуляції активності тригліцеридліпази.
- •53. Нейрогуморальна регуляція ліполізу за участю адреналіну, норадреналіну, глюкагону та інсуліну
- •54. Реакції окислення жирних кислот (β-окислення); роль карнітину в транспорті жирних кислот в мітохондрії.
- •55. Окислення гліцеролу: ферментативні реакції, біоенергетика
- •56. Кетонові тіла. Реакції біосинтезу та утилізації кетонових тіл, фізіологічне значення.
- •57. Порушення обміну кетонових тіл за умов патології (цукровий діабет,голодування)
- •58. Біосинтез вищих жирних кислот: реакції біосинтезу насичених жирних кислот (пальмітату) та регуляція процесу.
- •1.Регуляція на рівні ацетил-КоА-карбоксилази.
- •2. Регуляція на рівні комплексу синтетази жирних кислот
- •59. Біосинтез моно- та поліненасичених жирних кислот в організмі людини
- •60. Біосинтез триацилгліцеролів та фосфогліцеридів
- •61. Метаболізм сфінголіпідів. Генетичні аномалії обміну сфінголіпідів – сфінголіпідози.
- •62. Біосинтез холестеролу: схема реакцій, регуляція синтезу холестеролу.
- •63. Шляхи біотрансформації холестерину: етерифікація; утворення жовчних кислот, стероїдних гормонів, вітаміну d3.
- •2. Біосинтез стероїдних гормонів
- •64. Циркуляторний транспорт та депонування ліпідів у жировій тканині. Ліпопротеїнліпаза ендотелію
- •65. Ліпопротеїни плазми крові: ліпідний та білковий (апопротеїни) склад. Гіперліпопротеїнемії
- •66. Патології ліпідного обміну: атеросклероз, ожиріння, цукровий діабет
- •67. Пул вільних амінокислот в організмі: шляхи надходження та використання вільних амінокислот в тканинах.
- •68. Трансамінування амінокислот: реакції та їх біохімічне значення, механізми дії амінотрансфераз.
- •1) Взаємодія амінокислоти, що втрачає аміногрупу, з піридоксальфосфатом з утворенням кетокислоти та піридоксамінфосфату:
- •2) Взаємодія а-кетокислоти, що акцептує аміногрупу, з піридоксамінфосфатом з утворенням нової амінокислоти та регенерацією піридоксальфосфату:
- •69. Пряме та непряме дезамінування вільних l-амінокислот в тканинах
- •70. Декарбоксилювання l-амінокислот в організмі людини. Фізіологічне значення утворених продуктів. Окислення біогенних амінів
- •1. Утворення фізіологічно активних сполук - гормонів, медіаторів, регуляторних факторів місцевої дії:
- •71. Шляхи утворення та знешкодження аміаку в організмі.
- •72. Біосинтез сечовини: послідовність ферментних реакцій біосинтезу, генетичні аномалії ферментів циклу сечовини
- •73. Загальні шляхи метаболізму вуглецевих скелетів амінокислот в організмі людини. Глюкогенні та кетогенні амінокислоти.
- •74. Біосинтез та біологічна роль креатину і креатинфосфату
- •75. Глутатіон: будова, біосинтез та біологічні функції глутатіону
- •76. Спеціалізовані шляхи метаболізму циклічних амінокислот – фенілаланіну, та тирозину
- •1. Шляхи метаболізму фенілаланіну
- •2. Шляхи метаболізму тирозину
- •2.3. Шлях синтезу тиреоїдних гормонів - реалізується в клітинах щитовидної залози і полягає в утворенні йодованих тиронінів.
- •77. Спадкові ензимопатії обміну циклічних амінокислот – фенілаланіну та тирозину
- •78. Метаболізм порфіринів: будова гему; схема реакцій біосинтезу протопорфірину IX та гему
- •3) Взаимодействие двух молекул δ -аминолевуленовой кислоты в реакции дегидратации с образованием порфобилиногена
- •4.1. Синтез із чотирьох молекул порфобіліногену уропорфіриногену ііі:
- •2)Білка уропорфіриноген ііі-косинтази.
8. Вітамін рр (нікотинова кислота, нікотинамід): будова, біологічні властивості, механізм дії
АНТИПЕЛЛАГРИЧЕСКИЙ
Название дано от итальянского выражения preventive pellagra – предотвращающий пеллагру.
Синтезируется в организме из триптофана – 60 мг триптофана равноценны примерно 1 мг никотинамида.
Суточная потребность 15-25 мг.
Строение
Витамин существует в виде никотиновой кислоты или никотинамида. Его коферментными формами являются никотинамидадениндинуклеотид (НАД) и фосфорилированная по 2'-атому рибозы форма – никотинамидадениндинуклеотидфосфат (НАДФ).

Биохимические функции
Перенос гидрид-ионов Н– (атом водорода и электрон) в окислительно-восстановительных реакциях:
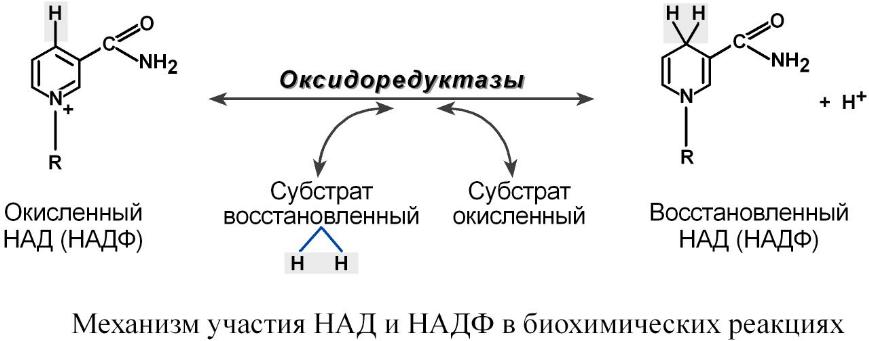
Благодаря переносу гидрид-иона витамин обеспечивает следующие задачи:
1. Синтез и окисление карбоновых кислот, аминокислот (глутамат), жиров (холестерол, жирные кислоты) и углеводов, так как НАД и НАДФ служат коферментами большинства дегидрогеназ.
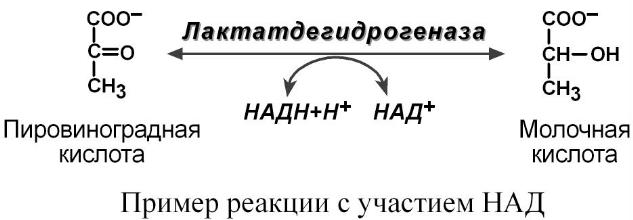
2. НАДН выполняет регулирующую функцию, поскольку является ингибитором некоторых реакций окисления, например, в цикле трикарбоновых кислот (изоцитратдегидрогеназа, альфа-кетоглутаратдегидрогеназа, малатдегидрогеназа)
3. Защита наследственной информации – НАД является субстратом поли-АДФ-рибозилирования в процессе сшивки хромосомных разрывов и репарации ДНК.
4. Защита от свободных радикалов – НАДФН является необходимым компонентом антиоксидантной системы клетки (см раздел "Окислительный стресс").
5. НАДФН участвует в реакциях синтеза тетрагидрофолиевой кислоты из фолиевой.
Гиповитаминоз
Причина. Пищевая недостаточность ниацина и триптофана.
Клиническая картина. Проявляется заболеванием пеллагра (итал.: pelle agra – шершавая кожа). Проявляется как синдром трех Д: деменция (нервные и психические расстройства, слабоумие), дерматиты (фотодерматиты), диарея (слабость, расстройство пищеварения, потеря аппетита). При отсутствии лечения заболевание кончается летально.
У детей при гиповитаминозе наблюдается замедление роста, похудание, анемия.
Антивитамины
Фтивазид, тубазид, ниазид – лекарства, используемые для лечения туберкулеза. По одной из гипотез, механизм действия ниазида – замена никотиновой кислоты в реакциях синтеза никотинамидаденин-динуклеотида (изо-НАД вместо НАД) и невозможность протекания окислительно-восстановительных реакций.
9. Вітамін в6 (піридоксин): будова, біологічні властивості, механізм дії
АНТИДЕРМАТИТНЫЙ
Суточная потребность
1,5-2,0 мг
Строение
Витамин существует в виде пиридоксина. Его коферментными формами являются пиридоксальфосфат и пиридоксаминфосфат.
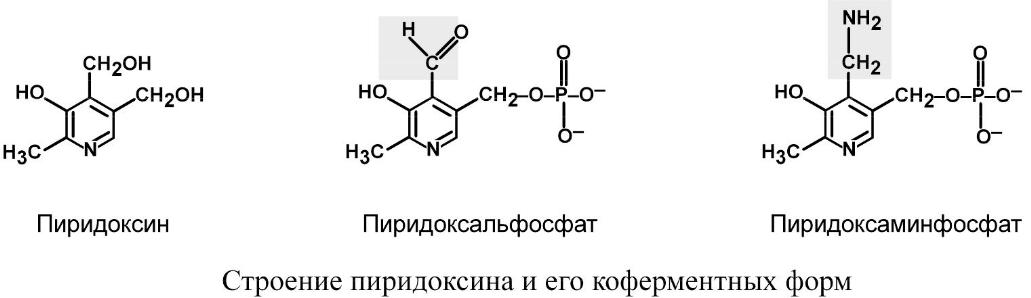
Биохимические функции
Коферментні функції.
Піридоксальфосфат входить до складу ферментів:
1. Амінотрансфераз, що каталізують оборотнє перенесення NH2-групи від амінокислот на α-кетокислоти.
2. Декарбоксилаз амінокислот, які забезпечують відщеплення від амінокислот карбоксильної групи у вигляді СО2.
3. Ізомераз амінокислот, за допомогою яких в організмі D-амінокислоти перетворюються на L-амінокислоти.
4. Синтази δ-амінолевуленової кислоти, що є регуляторним ферментом синтезу гему.
Некоферментні функції.
Піридоксальфосфат бере участь в процесі активного транспорту деяких амінокислот через клітинні мембрани, крім того йому властива функція регулятора конформаційного стану глікогенфосфорилази.
1. Является коферментом фосфорилазы гликогена (50% всего витамина находится в мышцах), участвует в синтезе гема, фосфолипидов и сфинголипидов.
2. Наиболее известная функция пиридоксиновых коферментов – перенос аминогрупп и карбоксильных групп в реакциях метаболизма аминокислот:
кофермент аминотрансфераз, переносящих аминогруппы между аминокислотами,
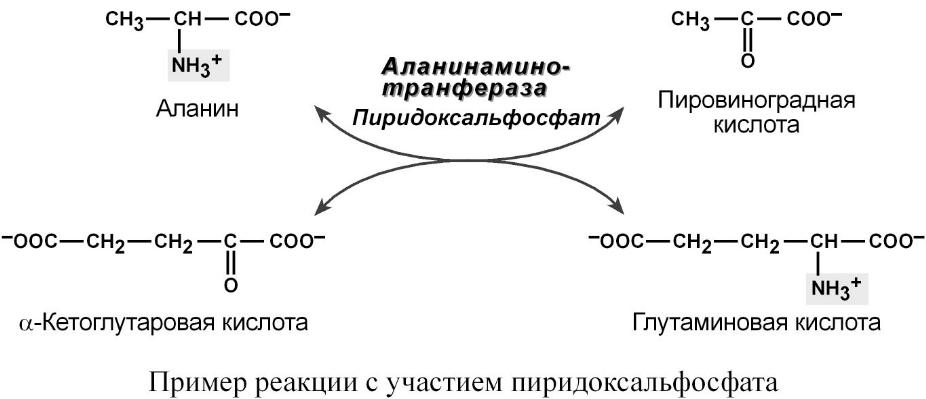
кофермент декарбоксилаз, участвующих в синтезе биогенных аминов из аминокислот, например, ГАМК (γ-аминомасляная кислота, греч.: γ – гамма) из глутаминовой килоты.
Гиповитаминоз
Причина. Пищевая недостаточность, хранение продуктов на свету и консервирование, использование ряда лекарств (антитуберкулезные средства, L-ДОФА, эстрогены в составе противозачаточных средств), беременность, алкоголизм.
Клиническая картина. Повышенная возбудимость ЦНС, эпилептиформные судороги (из-за недостатка синтеза ГАМК), полиневриты, пеллагроподобные дерматиты, эритемы и пигментация кожи, отеки, анемии.
Антивитамины: дезоксипиридоксин, циклосерин, изоникотиноилгидразид (изониазид), оказывающий антибактериальное действие на микобактерии туберкулеза.
