
- •1. Ферменти: визначення; властивості ферментів як біологічних каталізаторів
- •2. Класифікація та номенклатура ферментів, характеристика окремих класів ферментів
- •3. Будова та механізми дії ферментів. Активний та алостеричний (регуляторний) центри
- •4. Кофактори та коферменти. Будова та властивості коферментів; вітаміни як попередники в біосинтезі коферментів
- •5. Коферменти: типи реакцій, які каталізують окремі класи коферментів
- •6. Вітамін в1 (тіамін): будова, біологічні властивості, механізм дії
- •7. Вітамін в2 (рибофлавін): будова, біологічні властивості, механізм дії
- •8. Вітамін рр (нікотинова кислота, нікотинамід): будова, біологічні властивості, механізм дії
- •9. Вітамін в6 (піридоксин): будова, біологічні властивості, механізм дії
- •10. Вітамін в12 (кобаламін): біологічні властивості, механізм дії
- •11. Вітамін Вс (фолієва кислота): біологічні властивості, механізм дії.
- •12. Вітамін н (біотин): біологічні властивості, механізм дії
- •13. Вітамін в3 (пантотенова кислота): біологічні властивості, механізм дії
- •14. Вітамін с (аскорбінова кислота): будова, біологічні властивості, механізм дії
- •15. Вітамін р (флавоноїди): будова, біологічні властивості, механізм дії
- •16. Ізоферменти, особливості будови та функціонування, значення в діагностиці захворювань
- •17. Механізми дії та кінетика ферментативних реакцій: залежність швидкості реакції від концентрації субстрату, рН та температури
- •18. Активатори та інгібітори ферментів: приклади та механізми дії
- •19. Типи інгібування ферментів: зворотнє (конкурентне, неконкурентне) та незворотнє інгібування
- •20. Регуляція ферментативних процесів. Шляхи та механізми регуляції: алостеричні ферменти; ковалентна модифікація ферментів
- •21. Циклічні нуклеотиди (цАмф, цГмф) як регулятори ферментативних реакцій та біологічних функцій клітини
- •22. Ензимопатії – уроджені (спадкові) вади метаболізму вуглеводів, амінокислот, порфіринів, пуринів
- •23. Ензимодіагностика патологічних процесів та захворювань
- •24. Ензимотерапія – застосування ферментів, їх активаторів та інгібіторів в медицині
- •25. Принципи та методи виявлення ферментів у біооб'єктах. Одиниці виміру активності та кількості ферментів
- •26. Обмін речовин (метаболізм) - загальні закономірності протікання катаболічних та анаболічних процесів
- •27. Спільні стадії внутрішньоклітинного катаболізму біомолекул: білків, вуглеводів, ліпідів
- •28. Цикл трикарбонових кислот. Локалізація, послідовність ферментативних реакцій, значення в обміні речовин
- •29. Енергетичний баланс циклу трикарбонових кислот. Фізіологічне значення реакцій цтк
- •30. Реакції біологічного окислення; типи реакцій (дегідрогеназні, оксидазні, оксигеназні) та їх біологічне значення. Тканинне дихання
- •31. Ферменти біологічного окислення в мітохондріях: піридин-, флавін-залежні дегідрогенази, цитохроми
- •32. Послідовність компонентів дихального ланцюга мітохондрій. Молекулярні комплекси внутрішніх мембран мітохондрій.
- •33. Окисне фосфорилювання: пункти спряження транспорту електронів та фосфорилювання, коефіцієнт окисного фосфорилювання
- •34. Хеміосмотична теорія окисного фосфорилювання, атф-синтетаза мітохондрій.
- •35. Інгібітори транспорту електронів та роз’єднувачі окисного фосфорилювання
- •36. Мікросомальне окислення: цитохром р-450; молекулярна організація ланцюга переносу електронів.
- •37. Анаеробне окислення глюкози. Послідовність реакцій та ферменти гліколізу
- •2. Перетворення (ізомеризація) глюкоза-б-фосфату у фруктоза-6-фосфат (ферм. Фосфогексоізомеразою)
- •5. Взаємоперетворення двох фосфотріоз (доаф та г -3-ф ), що каталізується ферментом тріозофосфатізомеразою:
- •6.2. Перетворення 1,3-дифосфогліцерату на 3-фосфогліцерат (ферментом фосфогліцераткіназою)
- •38. Аеробне окислення глюкози. Етапи перетворення глюкози до со2 і н2о.
- •39. Окислювальне декарбоксилювання пірувату. Ферменти, коферменти та послідовність реакцій в мультиферментному комплексі
- •40. Порівняльна характеристика біоенергетики аеробного та анаеробного окислення глюкози, ефект Пастера.
- •41. Фосфоролітичний шлях розщеплення глікогену в печінці та м'язах. Регуляція активності глікогенфосфорилази.
- •42. Біосинтез глікогену: ферментативні реакції, фізіологічне значення. Регуляція активності глікогенсинтази.
- •43. Механізми реципрокної регуляції глікогенолізу та глікогенезу за рахунок каскадного цАмф-залежного фосфорилювання ферментних білків.
- •44. Роль адреналіну, глюкагону та інсуліну в гормональній регуляції обміну глікогену в м'язах та печінці.
- •45. Генетичні порушення метаболізму глікогену (глікогенози, аглікогенози).
- •1. Піруват у фосфоенолпіруват. – у дві стадії,
- •2. Фруктозо-1,6-дифосф. У фруктозо-6-фосф.:
- •3. Глюкозо-6-фосф. У глюкозу:
- •47. Глюкозо-лактатний (цикл Корі) та глюкозо-аланіновий цикли.
- •48. Глюкоза крові (глюкоземія): нормоглікемія, гіпо- та гіперглікемії, глюкозурія.
- •49. Гормональна регуляція концентрації та обміну глюкози крові.
- •50. Пентозофосфатний шлях окислення глюкози: схема процесу та біологічне значення
- •2.6 Ізомеризація 5 фрукт.-6-фосф. (ферм. Фосфогексоізомераза).
- •51. Метаболічні шляхи перетворення фруктози та галактози; спадкові ензимопатії їх обміну.
- •52. Катаболізм триацилгліцеролів в адипоцитах жирової тканини: послідовність реакцій, механізми регуляції активності тригліцеридліпази.
- •53. Нейрогуморальна регуляція ліполізу за участю адреналіну, норадреналіну, глюкагону та інсуліну
- •54. Реакції окислення жирних кислот (β-окислення); роль карнітину в транспорті жирних кислот в мітохондрії.
- •55. Окислення гліцеролу: ферментативні реакції, біоенергетика
- •56. Кетонові тіла. Реакції біосинтезу та утилізації кетонових тіл, фізіологічне значення.
- •57. Порушення обміну кетонових тіл за умов патології (цукровий діабет,голодування)
- •58. Біосинтез вищих жирних кислот: реакції біосинтезу насичених жирних кислот (пальмітату) та регуляція процесу.
- •1.Регуляція на рівні ацетил-КоА-карбоксилази.
- •2. Регуляція на рівні комплексу синтетази жирних кислот
- •59. Біосинтез моно- та поліненасичених жирних кислот в організмі людини
- •60. Біосинтез триацилгліцеролів та фосфогліцеридів
- •61. Метаболізм сфінголіпідів. Генетичні аномалії обміну сфінголіпідів – сфінголіпідози.
- •62. Біосинтез холестеролу: схема реакцій, регуляція синтезу холестеролу.
- •63. Шляхи біотрансформації холестерину: етерифікація; утворення жовчних кислот, стероїдних гормонів, вітаміну d3.
- •2. Біосинтез стероїдних гормонів
- •64. Циркуляторний транспорт та депонування ліпідів у жировій тканині. Ліпопротеїнліпаза ендотелію
- •65. Ліпопротеїни плазми крові: ліпідний та білковий (апопротеїни) склад. Гіперліпопротеїнемії
- •66. Патології ліпідного обміну: атеросклероз, ожиріння, цукровий діабет
- •67. Пул вільних амінокислот в організмі: шляхи надходження та використання вільних амінокислот в тканинах.
- •68. Трансамінування амінокислот: реакції та їх біохімічне значення, механізми дії амінотрансфераз.
- •1) Взаємодія амінокислоти, що втрачає аміногрупу, з піридоксальфосфатом з утворенням кетокислоти та піридоксамінфосфату:
- •2) Взаємодія а-кетокислоти, що акцептує аміногрупу, з піридоксамінфосфатом з утворенням нової амінокислоти та регенерацією піридоксальфосфату:
- •69. Пряме та непряме дезамінування вільних l-амінокислот в тканинах
- •70. Декарбоксилювання l-амінокислот в організмі людини. Фізіологічне значення утворених продуктів. Окислення біогенних амінів
- •1. Утворення фізіологічно активних сполук - гормонів, медіаторів, регуляторних факторів місцевої дії:
- •71. Шляхи утворення та знешкодження аміаку в організмі.
- •72. Біосинтез сечовини: послідовність ферментних реакцій біосинтезу, генетичні аномалії ферментів циклу сечовини
- •73. Загальні шляхи метаболізму вуглецевих скелетів амінокислот в організмі людини. Глюкогенні та кетогенні амінокислоти.
- •74. Біосинтез та біологічна роль креатину і креатинфосфату
- •75. Глутатіон: будова, біосинтез та біологічні функції глутатіону
- •76. Спеціалізовані шляхи метаболізму циклічних амінокислот – фенілаланіну, та тирозину
- •1. Шляхи метаболізму фенілаланіну
- •2. Шляхи метаболізму тирозину
- •2.3. Шлях синтезу тиреоїдних гормонів - реалізується в клітинах щитовидної залози і полягає в утворенні йодованих тиронінів.
- •77. Спадкові ензимопатії обміну циклічних амінокислот – фенілаланіну та тирозину
- •78. Метаболізм порфіринів: будова гему; схема реакцій біосинтезу протопорфірину IX та гему
- •3) Взаимодействие двух молекул δ -аминолевуленовой кислоты в реакции дегидратации с образованием порфобилиногена
- •4.1. Синтез із чотирьох молекул порфобіліногену уропорфіриногену ііі:
- •2)Білка уропорфіриноген ііі-косинтази.
6. Вітамін в1 (тіамін): будова, біологічні властивості, механізм дії
Вітамін В1 (тіамін, антиневритний)
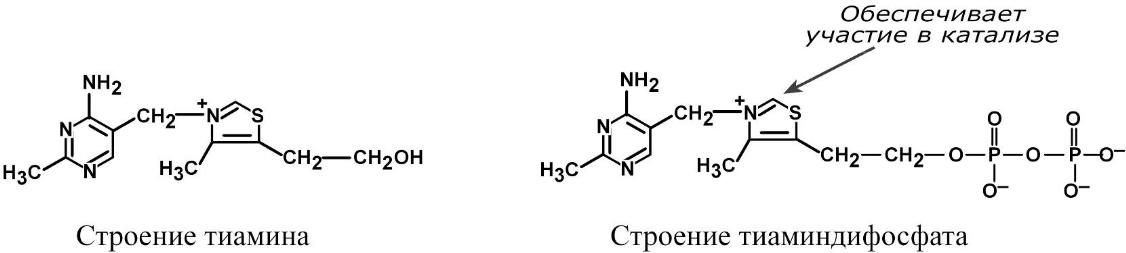
Тіамін складається з двох гетероциклічних кілець – амінопіримідинового і тіазолового.Тіамін добре зберігається в кислому середовищі і витримує нагрівання до високої температури. У лужному середовищі він швидко руйнується. Вітамін присутній в різних органах і тканинах як у формі вільного тіаміну, так і у формі його фосфорних ефірів: тіамінмонофосфат (ТМФ), тіаміндифосфата (ТДФ, синоніми:тіамінпірофосфат, ТПФ, кокарбоксилаза) і тіамінтрифосфата (ТТФ). Основною коферментною формою є ТДФ.
Коферментні функції ТДФ.
1.Входить до складу мультиферментних комплексів дегідрогеназ α-кетокислот (пірувату та α-кетоглутарату) та забезпечує реакції їх окисного декарбоксилування.
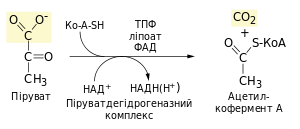
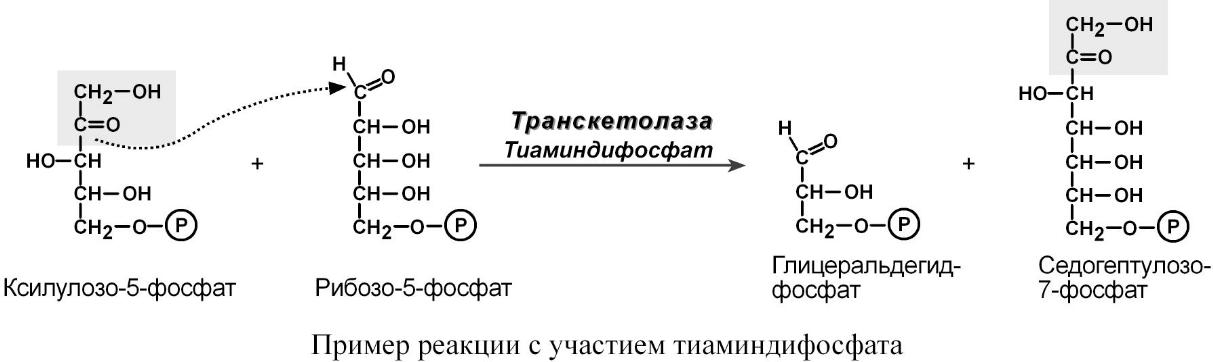
2. Є коферментом транскетолаз неокислювальної фази пентозофосфатного циклу і забезпечує перенесення глікоальдегідних груп.
Некоферментні функції пов'язані з ТТФ, який ще недостатньо вивчений, але його функції пов’язують з участю в утворенні сигналів в цнс.
Недостатність в їжі тіаміну призводить до значного накопичення піровиноградної і α-кетоглутарової кислот і патологічних змін в нервовій, серцево-судинній та травній системах, супроводжуючись загальним виснаженням організму. Хвороба бері-бері виникає при значному дефіциті тіаміну і характеризується вкрай важким перебігом.
Болезнь "бери-бери" или "ножные кандалы" – нарушение метаболизма пищеварительной, сердечно-сосудистой и нервной систем из-за недостаточного энергетического и пластического обмена.
Со стороны нервной ткани наблюдаются:
полиневриты: снижение периферической чувствительности, утрата некоторых рфлексов, боли по ходу нервов,
энцефалопатия: синдром Вернике – сильная спутанность сознания, нарушение координации, галлюцинации, нарушение зрительной функции, синдром Корсакова – ретроградная амнезия, неспособность усваивать новую информацию при относительном сохронанении информации о прошлом, болтливость.
Со стороны сердечно-сосудистой системы отмечается нарушение сердечного ритма, боли в сердце и увеличение его размеров.
В желудочно-кишечном тракте нарушается секреторная и моторная функция, возни кает атония кишечника и запоры, исчезает аппетит, уменьшается кислотность желудочного сока.
Антивитамины В1
В кишечнике имеется бактериальная тиаминаза, разрушающая тиамин. Также этот фермент активен в сырой рыбе, устрицах.
Добова потреба в тіаміні: 1,1 –1,5 мг.
7. Вітамін в2 (рибофлавін): будова, біологічні властивості, механізм дії
В состав рибофлавина входит флавин – изоаллоксазиновое кольцо с заместителями (азотистое основание) и спирт рибитол. Коферментные формы витамина дополнительно содержат либо только фосфорную кислоту – флавинмононуклеотид (ФМН), либо фосфорную кислоту, дополнительно связанную с АМФ -флавинадениндинуклеотид.
(flavus - жовтий)
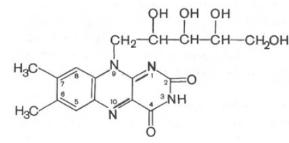
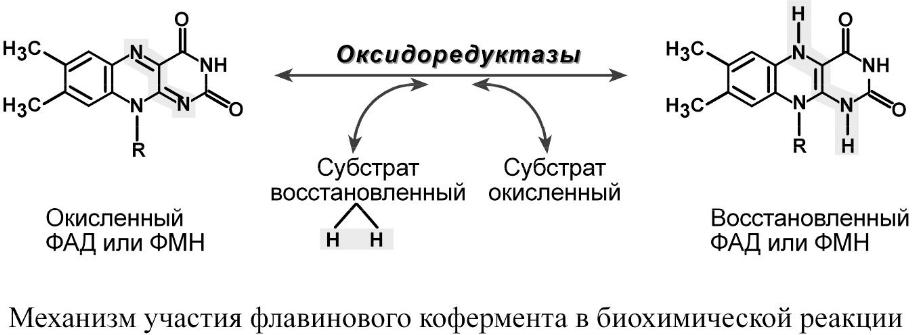
Кофермент оксидоредуктаз – обеспечивает перенос 2 атомов водорода в окислительно-восстановительных реакциях.
Витамин содержат:
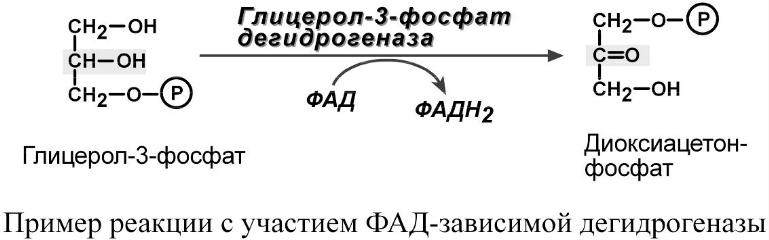
1. Дегидрогеназы энергетического обмена – пируватдегидрогеназа, α-кетоглутаратдегидрогеназа, сукцинатдегидрогеназа, ацил-SКоА-дегидрогеназа, митохондриальная глицерол-3-фосфатдегидрогеназа.
2. Оксидазы, окисляющие субстраты с участием молекулярного кислорода. Например, реакции обезвреживания биогенных аминов (гистамина, серотонина, дофамина).
Коферментні функції.
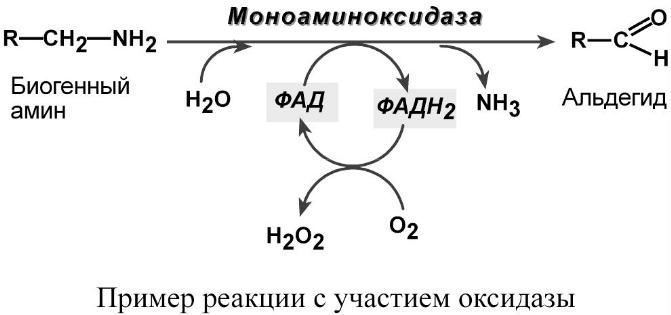
1. ФМН і ФАД – коферменти оксидаз, що переносять електрони і протони з
окислюваного субстрата на кисень. Такими ферментами є оксидази D- і L-амінокислот,
ксантиноксидаза та ін.
2. ФМН і ФАД – проміжні переносники електронів і протонів в дихальному ланцюгу: ФМН входить до складу I-го коплексу, а ФАД – до складу II-го.
3. ФАД – входить до складу мікросомальних ланцюгів окислення ксенобіотиків.
4. ФАД – кофермент піруват- і α-кетоглутаратдегідрогеназ.
5. ФАД – бере участь в реакціях окислення жирних кислот (він є коферментом ацил-
КоА-дегідрогенази) в мітохондріях.
Гиповитаминоз
Причина. Пищевая недостаточность, хранение пищевых продуктов на свету, фототерапия, алкоголизм и нарушения ЖКТ.
Клиническая картина. В первую очередь страдают высокоаэробные ткани – эпителий кожи и слизистых. Проявляется как сухость ротовой полости, губ и роговицы; хейлоз, т.е. трещины в уголках рта и на губах ("заеды"), глоссит (фуксиновый язык), шелушение кожи в районе носогубного треугольника, мошонки, ушей и шеи, конъюнктивит и блефарит.
Сухость конъюнктивы и ее воспаление ведут к компенсаторному увеличению кровотока в этой зоне и улучшению снабжения ее кислородом, что проявляется как васкуляризация роговицы и последующее ее помутнение.
Антивитамины В2
1. Акрихин (атебрин) – ингибирует функцию рибофлавина у простейших. Используется при лечении малярии, кожного лейшманиоза, трихомониаза, гельминтозов (лямблиоз, тенидоз).
2. Мегафен – тормозит образование ФАД в нервной ткани, используется как седативное средство.
3. Токсофлавин – конкурентный ингибитор флавиновых дегидрогеназ.
Добова потреба: 1-3 мг.
