
- •1. Ферменти: визначення; властивості ферментів як біологічних каталізаторів
- •2. Класифікація та номенклатура ферментів, характеристика окремих класів ферментів
- •3. Будова та механізми дії ферментів. Активний та алостеричний (регуляторний) центри
- •4. Кофактори та коферменти. Будова та властивості коферментів; вітаміни як попередники в біосинтезі коферментів
- •5. Коферменти: типи реакцій, які каталізують окремі класи коферментів
- •6. Вітамін в1 (тіамін): будова, біологічні властивості, механізм дії
- •7. Вітамін в2 (рибофлавін): будова, біологічні властивості, механізм дії
- •8. Вітамін рр (нікотинова кислота, нікотинамід): будова, біологічні властивості, механізм дії
- •9. Вітамін в6 (піридоксин): будова, біологічні властивості, механізм дії
- •10. Вітамін в12 (кобаламін): біологічні властивості, механізм дії
- •11. Вітамін Вс (фолієва кислота): біологічні властивості, механізм дії.
- •12. Вітамін н (біотин): біологічні властивості, механізм дії
- •13. Вітамін в3 (пантотенова кислота): біологічні властивості, механізм дії
- •14. Вітамін с (аскорбінова кислота): будова, біологічні властивості, механізм дії
- •15. Вітамін р (флавоноїди): будова, біологічні властивості, механізм дії
- •16. Ізоферменти, особливості будови та функціонування, значення в діагностиці захворювань
- •17. Механізми дії та кінетика ферментативних реакцій: залежність швидкості реакції від концентрації субстрату, рН та температури
- •18. Активатори та інгібітори ферментів: приклади та механізми дії
- •19. Типи інгібування ферментів: зворотнє (конкурентне, неконкурентне) та незворотнє інгібування
- •20. Регуляція ферментативних процесів. Шляхи та механізми регуляції: алостеричні ферменти; ковалентна модифікація ферментів
- •21. Циклічні нуклеотиди (цАмф, цГмф) як регулятори ферментативних реакцій та біологічних функцій клітини
- •22. Ензимопатії – уроджені (спадкові) вади метаболізму вуглеводів, амінокислот, порфіринів, пуринів
- •23. Ензимодіагностика патологічних процесів та захворювань
- •24. Ензимотерапія – застосування ферментів, їх активаторів та інгібіторів в медицині
- •25. Принципи та методи виявлення ферментів у біооб'єктах. Одиниці виміру активності та кількості ферментів
- •26. Обмін речовин (метаболізм) - загальні закономірності протікання катаболічних та анаболічних процесів
- •27. Спільні стадії внутрішньоклітинного катаболізму біомолекул: білків, вуглеводів, ліпідів
- •28. Цикл трикарбонових кислот. Локалізація, послідовність ферментативних реакцій, значення в обміні речовин
- •29. Енергетичний баланс циклу трикарбонових кислот. Фізіологічне значення реакцій цтк
- •30. Реакції біологічного окислення; типи реакцій (дегідрогеназні, оксидазні, оксигеназні) та їх біологічне значення. Тканинне дихання
- •31. Ферменти біологічного окислення в мітохондріях: піридин-, флавін-залежні дегідрогенази, цитохроми
- •32. Послідовність компонентів дихального ланцюга мітохондрій. Молекулярні комплекси внутрішніх мембран мітохондрій.
- •33. Окисне фосфорилювання: пункти спряження транспорту електронів та фосфорилювання, коефіцієнт окисного фосфорилювання
- •34. Хеміосмотична теорія окисного фосфорилювання, атф-синтетаза мітохондрій.
- •35. Інгібітори транспорту електронів та роз’єднувачі окисного фосфорилювання
- •36. Мікросомальне окислення: цитохром р-450; молекулярна організація ланцюга переносу електронів.
- •37. Анаеробне окислення глюкози. Послідовність реакцій та ферменти гліколізу
- •2. Перетворення (ізомеризація) глюкоза-б-фосфату у фруктоза-6-фосфат (ферм. Фосфогексоізомеразою)
- •5. Взаємоперетворення двох фосфотріоз (доаф та г -3-ф ), що каталізується ферментом тріозофосфатізомеразою:
- •6.2. Перетворення 1,3-дифосфогліцерату на 3-фосфогліцерат (ферментом фосфогліцераткіназою)
- •38. Аеробне окислення глюкози. Етапи перетворення глюкози до со2 і н2о.
- •39. Окислювальне декарбоксилювання пірувату. Ферменти, коферменти та послідовність реакцій в мультиферментному комплексі
- •40. Порівняльна характеристика біоенергетики аеробного та анаеробного окислення глюкози, ефект Пастера.
- •41. Фосфоролітичний шлях розщеплення глікогену в печінці та м'язах. Регуляція активності глікогенфосфорилази.
- •42. Біосинтез глікогену: ферментативні реакції, фізіологічне значення. Регуляція активності глікогенсинтази.
- •43. Механізми реципрокної регуляції глікогенолізу та глікогенезу за рахунок каскадного цАмф-залежного фосфорилювання ферментних білків.
- •44. Роль адреналіну, глюкагону та інсуліну в гормональній регуляції обміну глікогену в м'язах та печінці.
- •45. Генетичні порушення метаболізму глікогену (глікогенози, аглікогенози).
- •1. Піруват у фосфоенолпіруват. – у дві стадії,
- •2. Фруктозо-1,6-дифосф. У фруктозо-6-фосф.:
- •3. Глюкозо-6-фосф. У глюкозу:
- •47. Глюкозо-лактатний (цикл Корі) та глюкозо-аланіновий цикли.
- •48. Глюкоза крові (глюкоземія): нормоглікемія, гіпо- та гіперглікемії, глюкозурія.
- •49. Гормональна регуляція концентрації та обміну глюкози крові.
- •50. Пентозофосфатний шлях окислення глюкози: схема процесу та біологічне значення
- •2.6 Ізомеризація 5 фрукт.-6-фосф. (ферм. Фосфогексоізомераза).
- •51. Метаболічні шляхи перетворення фруктози та галактози; спадкові ензимопатії їх обміну.
- •52. Катаболізм триацилгліцеролів в адипоцитах жирової тканини: послідовність реакцій, механізми регуляції активності тригліцеридліпази.
- •53. Нейрогуморальна регуляція ліполізу за участю адреналіну, норадреналіну, глюкагону та інсуліну
- •54. Реакції окислення жирних кислот (β-окислення); роль карнітину в транспорті жирних кислот в мітохондрії.
- •55. Окислення гліцеролу: ферментативні реакції, біоенергетика
- •56. Кетонові тіла. Реакції біосинтезу та утилізації кетонових тіл, фізіологічне значення.
- •57. Порушення обміну кетонових тіл за умов патології (цукровий діабет,голодування)
- •58. Біосинтез вищих жирних кислот: реакції біосинтезу насичених жирних кислот (пальмітату) та регуляція процесу.
- •1.Регуляція на рівні ацетил-КоА-карбоксилази.
- •2. Регуляція на рівні комплексу синтетази жирних кислот
- •59. Біосинтез моно- та поліненасичених жирних кислот в організмі людини
- •60. Біосинтез триацилгліцеролів та фосфогліцеридів
- •61. Метаболізм сфінголіпідів. Генетичні аномалії обміну сфінголіпідів – сфінголіпідози.
- •62. Біосинтез холестеролу: схема реакцій, регуляція синтезу холестеролу.
- •63. Шляхи біотрансформації холестерину: етерифікація; утворення жовчних кислот, стероїдних гормонів, вітаміну d3.
- •2. Біосинтез стероїдних гормонів
- •64. Циркуляторний транспорт та депонування ліпідів у жировій тканині. Ліпопротеїнліпаза ендотелію
- •65. Ліпопротеїни плазми крові: ліпідний та білковий (апопротеїни) склад. Гіперліпопротеїнемії
- •66. Патології ліпідного обміну: атеросклероз, ожиріння, цукровий діабет
- •67. Пул вільних амінокислот в організмі: шляхи надходження та використання вільних амінокислот в тканинах.
- •68. Трансамінування амінокислот: реакції та їх біохімічне значення, механізми дії амінотрансфераз.
- •1) Взаємодія амінокислоти, що втрачає аміногрупу, з піридоксальфосфатом з утворенням кетокислоти та піридоксамінфосфату:
- •2) Взаємодія а-кетокислоти, що акцептує аміногрупу, з піридоксамінфосфатом з утворенням нової амінокислоти та регенерацією піридоксальфосфату:
- •69. Пряме та непряме дезамінування вільних l-амінокислот в тканинах
- •70. Декарбоксилювання l-амінокислот в організмі людини. Фізіологічне значення утворених продуктів. Окислення біогенних амінів
- •1. Утворення фізіологічно активних сполук - гормонів, медіаторів, регуляторних факторів місцевої дії:
- •71. Шляхи утворення та знешкодження аміаку в організмі.
- •72. Біосинтез сечовини: послідовність ферментних реакцій біосинтезу, генетичні аномалії ферментів циклу сечовини
- •73. Загальні шляхи метаболізму вуглецевих скелетів амінокислот в організмі людини. Глюкогенні та кетогенні амінокислоти.
- •74. Біосинтез та біологічна роль креатину і креатинфосфату
- •75. Глутатіон: будова, біосинтез та біологічні функції глутатіону
- •76. Спеціалізовані шляхи метаболізму циклічних амінокислот – фенілаланіну, та тирозину
- •1. Шляхи метаболізму фенілаланіну
- •2. Шляхи метаболізму тирозину
- •2.3. Шлях синтезу тиреоїдних гормонів - реалізується в клітинах щитовидної залози і полягає в утворенні йодованих тиронінів.
- •77. Спадкові ензимопатії обміну циклічних амінокислот – фенілаланіну та тирозину
- •78. Метаболізм порфіринів: будова гему; схема реакцій біосинтезу протопорфірину IX та гему
- •3) Взаимодействие двух молекул δ -аминолевуленовой кислоты в реакции дегидратации с образованием порфобилиногена
- •4.1. Синтез із чотирьох молекул порфобіліногену уропорфіриногену ііі:
- •2)Білка уропорфіриноген ііі-косинтази.
Учітеся, брати мої! Думайте, читайте, І чужому научайтесь, − Свого не цурайтесь
ПІДСУМКОВИЙ МОДУЛЬНИЙ КОНТРОЛЬ
Модуль 2. Загальні закономірності метаболізму. Метаболізм вуглеводів, ліпідів, амінокислот та його регуляція.
Перелік питань для підсумкового модульного контролю.
1. Ферменти: визначення; властивості ферментів як біологічних каталізаторів
1. Ферменты - это белковые катализаторы, ускоряющие химические реакции в живых клетках. Они обладают всеми свойствами, характерными для белков, и определенными особенностями строения, обусловливающими их каталитические свойства. Ферменты, кроме того, подчиняются общим законам катализа и обладают свойствами, характерными для небиолоrических катализаторов: ускоряют энергетически возможные реакции, сохраняют энергию химической системы постоянной, не расходуются в процессе реакции.
2. Для ферментов характерны:
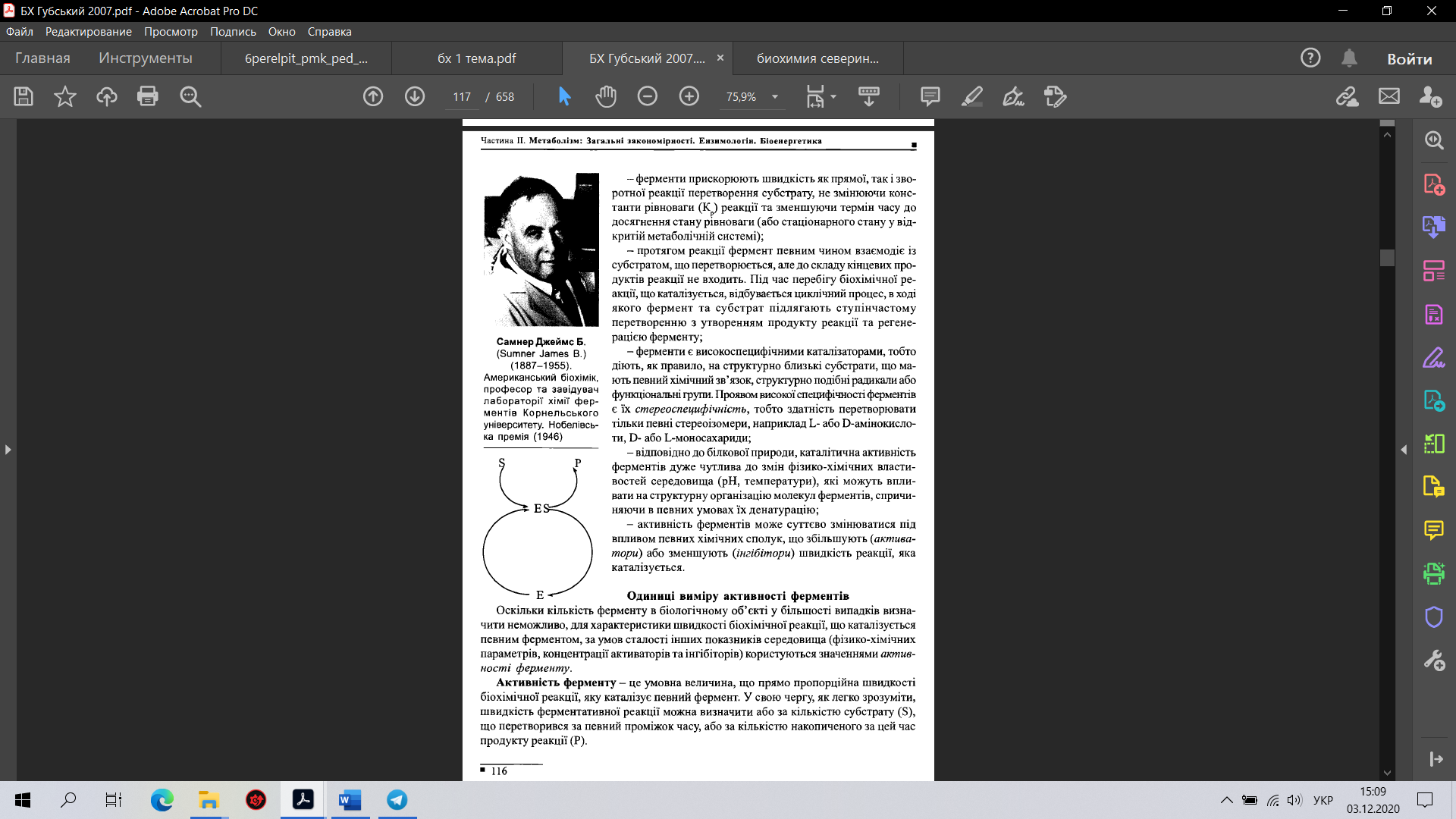
специфичность. Биологическая функция фермента, как и любого белка, обусловлена наличием в его структуре активного центра, с которым взаимодействует определенный лиганд. Лиганд, взаимодействующий с активным центром фермента, называется субстратом.
каталитическая эффективность. Большинство катализируемых ферментами реакций высокоэффективны, они протекают в 10^8-10^14 раз быстрее, чем некатализируемые реакции. Каждая молекула фермента способна за секунду трансформировать от 100 до 1000 молекул субстрата в продукт.
конформационная лабильность. Каталитическая эффективность фермента, как и любой белковой молекулы, зависит от его конформации и, в частности, от конформации активного центра. В клетках имеются вещества, которые могут вызывать незначительные изменения конформации молекулы фермента за счет разрыва одних и образования других слабых связей: это может вызывать как повышение, так и снижение активности фермента.
3. Активность ферментов может регулироваться. Действие ферментов в клетке, как правило, строго упорядочено: продукт одной ферментативной реакции является субстратом другой; таким образом образуются метаболические пути. Среди множества ферментов практически каждого метаболического пути имеются ключевые, или регуляторные, ферl',1енты, активность которых может изменяться в зависимости от потребности клет.ки в конечном продукте метаболического пути.
4. Оптимальные условия протекания ферментативных реакций: температура 37-38 град.; нормальное атмосферное давление, рН 6,9-7,7, характерное для большинства тканей. В отличие от этого для эффективного химического катализа часто требуются высокие температура и давление, а также экстремальные значения рН.
2. Класифікація та номенклатура ферментів, характеристика окремих класів ферментів
Номенклатура ферментів. У даний час використовують дві назви ферментів: систематичну та тривіальну (або робочу).
Систематична назва дається лише добре вивченим ферментам і складається з назви субстрату хімічної реакції, на яку діє фермент, назви типу хімічного перетворення та закінчення – аза. Наприклад, систематична назва ферменту лактатдегідрогенази записується таким чином: L-Лактат:НАД+-оксидоредуктаза, де L-Лактат – це субстрат, тип каталізованої реакції – окиснювально-відновна в присутності кофермента НАД+.
Тривіальна назва складається з назви субстрату, назви каталізованої реакції та закінчення – аза. Наприклад: лактат + дегідрогенізація + аза → лактатдегідрогеназа.
Збереглися й інші робочі назви ферментів. Вони не дають докладної характеристики їх дії, але введені давно і міцно вкоренилися, наприклад, пепсин, трипсин, хімотрипсин, уреаза тощо.
Класифікація ферментів. Основою для створення класифікації ферментів і їх позначення служать три принципи, а саме: хімічна природа фермента; хімічна природа субстрату та тип каталізованої реакції, який є специфічним для дії будь-якого ферменту. Отже, всі ферменти поділяють на 6 класів (табл. 1).
Таблиця 1. Характеристика класів ферментів
Номер класу |
Назва класу |
Тип каталізованої реакції |
Приклади |
Коферменти |
1 |
Оксидо-редуктази |
Окиснювально-відновні реакції різних типів |
Лактатдегідрогеназа, цитохромоксидаза, алкогольдегідрогеназа |
НАД+, НАДФ+, ФАД, ФМН, убіхінон, металопорфірини, глутатіон, ліпоєва кислота |
2 |
Трансферази |
Перенесення різних хімічних груп (карбоксильних, метиль-них, аміно-, сульфогруп від одного субстрату до іншого |
Аспартатамінотранс-фераза, аланінаміно-трансфераза |
ПАЛФ, ПАМФ, КоА, УДФ, ЦДФ, ТГФК, метоксикобаламін |
3 |
Гідролази |
Гідроліз – розрив зв’язків у субстратах з приєднанням води |
Кисла та лужна фосфатази, пепсин, трипсин, ліпаза |
- |
4 |
Ліази |
Розщеплення зв'язків у субстратах негідролітичним шляхом, утворення подвійних зв’язків, приєднання хімічних груп при подвійних зв’язках |
Дезамінази, дегідратази, альдолаза |
ПАЛФ, КоА, ТДФ, Дезоксіаденозилкобаламін |
5 |
Ізомерази |
Ізомерні перетворення в межах однієї молекули |
Рацемаза, глюкозо-6-фосфатізомераза, фосфогліцератмутаза |
ПАЛФ, дезоксіаденозил-кобаламін, глутатіон |
6 |
Лігази |
Приєднання молекул одна до одної з використанням енергії АТФ або інших |
Аспарагінсинтетаза, глутамінсинтетаза, ацетил-КоА- |
УДФ, ЦДФ, ТГФК, карбоксибіотин |
Оксидоредуктази. До класу оксидоредуктаз відносять ферменти, що каталізують окисно-відновні реакції. Систематична назва цього класу ферментів будується за формулою «донор:акцептор-оксидоредуктаза». За тривіальною номенклатурою оксидоредуктази, що відщеплюють атоми водню або електрони від субстрату окиснення і передають їх на будь-який акцептор, крім кисню або пероксиду водню, називаються дегідрогеназами. Субстратами оксидоредуктаз можуть бути спирти, кислоти, альдегіди, кетони, NH2-, NH-, SH-групи, гем та його похідні тощо.
Розрізняють наступні основні оксидоредуктази: оксидази, які каталізують перенесення протонів (електронів) безпосередньо на молекулярний кисень; дегідрогенази – ті, що забезпечують відщеплення протонів; цитохроми, які каталізують перенесення тільки електронів. До цього класу відносять також пероксидази, які переносять атоми водню на пероксид водню; оксидоредуктази, яким властива відновна дія, називають редуктазами.
Трансферази. До класу трансфераз належать ферменти, що каталізують реакції міжмолекулярного перенесення різних атомів, груп атомів і радикалів: ті, що переносять СН3- групи, називають метилтрансферазами, переносники NH2-груп отримали назву амінотрансфераз, розрізняють трансферази, що каталізують перенесення одновуглецевих, ацильних, глікозильних, альдегідних або кетонних, нуклеотидних залишків, азотистих груп, залишків фосфатної та сульфатної кислот тощо. До трансфераз належать також кінази, зокрема протеїнкінази – ферменти, що каталізують фосфорилування субстратів та інших білків за рахунок фосфатного залишку АТФ. Систематичну назву формують за формулою «донор:акцептор–транспортована група-трансфераза».
Трансферази беруть участь у реакціях взаємоперетворень різних речовин, знешкодженні природних та чужорідних сполук. Деякі трансферази використовують у діагностиці захворювань, наприклад, аспартатамінотрансферазу – для діагностики інфаркту міокарда, а аланінамінотрансферазу – гострих гепатитів тощо.
Гідролази. До цього класу належить велика група ферментів, які каталізують розщеплення внутрішніх молекулярних зв’язків органічних речовин за участі молекули води. Це естерази – ферменти, що каталізують реакції гідролізу та синтезу складних ефірів; глікозидази, які пришвидшують розрив глікозидних зв’язків; фосфатази й пептидогідролази, які каталізують гідроліз фосфоангідридних і пептидних зв’язків; амідази, які пришвидшують розрив амідних зв’язків тощо. Систематичну назву складають за формулою «субстрат–гідролаза».
До гідролаз належать також ферменти травного тракту (ліпази, протеази, глікозидази тощо). Гідролази містяться у лізосомах та інших органоїдах клітин, сприяють розпаду біомакромолекул на прості речовини.
Ліази. До класу ліаз відносять ферменти, які каталізують розрив зв’язків С-О, С-С, С-N тощо, а також зворотні реакції відщеплення різних груп від субстратів негідролітичним шляхом. Ці реакції супроводжуються утворенням подвійного зв’язку або приєднанням додаткової групи до місця розриву подвійного зв’язку.
До цього класу відносять декарбоксилази (декарбоксилування амінокислот та альфа-кетокислот); гідроліази, а за тривіальною номенклатурою – дегідратази (наприклад, карбангідраза розщеплює карбонатну кислоту на СО2 і Н2О), альдолази – ферменти, що каталізують розрив гексозофосфатів на дві тріози (наприклад, фруктозо-1,6-дифосфат на гліцеральдегід-3-фосфат і діоксіацетонфосфат). Систематичну назву складають за формулою «субстрат–від’єднана чи приєднана група».
Ізомерази. До класу ізомераз відносять ферменти, які каталізують взаємне перетворення оптичних і геометричних ізомерів. Систематичну назву складають з урахуванням типу реакції: «субстрат-цис-транс-ізомераза». Якщо ізомеризація включає внутрішньомолекулярне перенесення групи, то фермент отримує назву «мутаза».
До цього ж класу відносять рацемази й епімерази, які діють на аміно- та оксикислоти, вуглеводи та їх похідні; внутрішньомолекулярні оксидоредуктази, які каталізують взаємоперетворення альдоз і кетоз; внутрішньомолекулярні трансферази, які переносять ацильні, фосфорильні та інші групи тощо.
Ізомерази відіграють важливу роль у відновленні біологічної активності молекул, у переключенні використання метаболітів на різних шляхах обміну.
Лігази (синтетази). До класу лігаз відносять ферменти, які каталізують синтез органічних речовин із двох вихідних молекул із використанням енергії розпаду АТФ (або ГТФ, УТФ). Дія цих ферментів спричинює утворення нових зв’язків. Систематичну назву складають за формулою «Х:У лігаза», де Х і У позначають вихідні речовини. Як приклад можна назвати L-глутамат: аміаклігазу (рекомендована скорочена назва «глутамінсинтетаза»), за участю якої із глутамінової кислоти й аміаку в присутності АТФ синтезується глутамін. Іншу назву – синтетази – ці ферменти отримали завдяки тому, що вони є каталізаторами біосинтетичних процесів. Прикладом можуть бути: аміноацил-тРНК-синтетаза (каталізує приєднання амінокислоти до молекули тРНК у процесі біосинтезу білків) та ацетил-КоА-синтетаза (каталізує конденсацію ацетатної кислоти і КоА), карбоксилази (каталізують зв’язування СО2 з кетокислотами).
