
Bykov-_gistologia_obschaya
.pdfВместе с тем, в действительности, активные процессы эндоцитоза и экзоцитоза не приводят к существенным изменениям площади поверхности плазмолеммы, так как они уравновешиваются формированием экзоцитозных и эндоцитозных пузырьков, соответственно, компенсирующим происходящую потерю мембраны или ее увеличение за счет противоположно направленного процесса. Эти явления отражают постоянно происходящий в клетке круговорот мембран, который получил название "мембранного конвейера".
Мембранные рецепторы являются преимущественно гликопротеинами, которые расположены на поверхности плазмолеммы клеток и обладают способностью высокоспецифически связываться со своими лигандами. Они выполняют ряд функций:
(1)регулируют проницаемость плазмолеммы, изменяя конформацию белков и ионных каналов;
(2)регулируют поступление некоторых молекул в клетку;
(3)действуют как датчики, превращая внеклеточные сигналы во внутриклеточные;
(4)связывают молекулы внеклеточного матрикса с цитоскелетом, эти рецепторы, называемые интегринами, играют важную роль в формировании контактов между клетками и клеткой и компонентами межклеточного вещества.
Рецепторы, связанные с каналами, взаимодействуют с сигнальной молекулой (нейромедиатора), которая временно открывает или закрывает воротный механизм, в результате чего инициируется или блокируется транспорт ионов через канал.
Каталитические рецепторы включают внеклеточную часть (собственно рецептор) и цитоплазматическую часть, которая функционирует как протеинкиназа (посредством таких рецепторов на клетки воз-действуют инсулин и некоторые факторы роста).
Рецепторы, связанные с G-белками - трансмембранные белки, ас-
социированные с ионным каналом или ферментом, - состоят из рецептора, взаимодействующего с сигнальной молекулой (первый посредник), и G-белка (гуанозин трифосфат-связывающего регуляторного белка), включающего несколько компонентов), который передает сигнал на связанный с мембраной фермент (аденилат циклазу) или ионный канал, вследствие чего активируется второй внутриклеточный посредник - чаще всего циклический АМФ (цАМФ) или Са2+. Около 80% всех гормонов и нейромедиаторов действуют через рецепторы, связанные с эффекторными механизмами посредством G-белков.
В составе плазмолеммы находятся интегрины, называемые клеточными адгезионными молекулами (KAM) - трансмембранные белки, слу-
- 41 -
жащие рецепторами для внеклеточных фибриллярных макромолекул фибронектина и ламинина (см. рис. 10-9). Фибронектин связывается с клетками
имолекулами внеклеточного матрикса (коллагеном, гепарином, фибрином). Таким образом, фибронектин играет роль адгезионного мостика между клеткой
икомпонентами межклеточного вещества. Между тем, внутриклеточная часть молекулы интегрина через ряд друих белков (талин, винкулин и α-актинин) связана с цитоскелетом.
Поверхностный аппарат клетки выделяется некоторыми авторами. которые рассматривают его как структурно и функционально единое образование, состоящее из трех компонентов: (1) надмембранного комплекса (гликокаликса), (2) плазмолеммы и (3) подмембранного комплекса (см. рис. 3- 17). Первые два компонента описаны выше. Подмембранный комплекс образован специализированной периферической частью цитоплазмы, прилежащей к плазмолемме (кортикальный слой) и содержащей элементы цитоскелета (см. ниже), преимущественно актиновые микрофиламенты. Более глубоко располагаются промежуточные филаменты и микротрубочки. Благодаря сокращению сети микрофиламентов, связанных с белками плазмолеммы, происходят изменения формы клетки и ее отдельных участков, формирование псевдоподий, выростов, перемещение клетки в пространстве.
СИНТЕТИЧЕСКИЙ АППАРАТ КЛЕТКИ
Синтетический аппарат клетки включает органелльг, участвующие в синтезе различных веществ, которые могут в дальнейшем использоваться самой клеткой или выделяться ею во внеклеточное пространство. Деятельность синтетического аппарата клетки, располагающегося в ее цитоплазме, контролируется ядром благодаря активности находящихся в нем генов. В синтетический аппарат входят рибосомы, эндоплазматическая сеть (ЭПС) и комплекс Гольджи.
Рибосомы
Рибосомы - мелкие (диаметр - 15-30 нм) плотные немембранньге органеллы, обеспечивающие синтез белка путем соединения аминокислот в попипептидные цепочки. Информация о синтезе приносится к рибосомам информационной РНК (иРНК), которая образуется в ядре в ходе считывания (транскрипции) фрагментов генетической информации с ДНК. Синтетически активная клетка содержит несколько миллионов рибосом (например, в клетке печени их число составляет 107), на которые приходится около 5% ее сухой массы.
- 42 -
Каждая рибосома состоит из двух асимметричных субъединиц: малой, связывающей РНК, и большой, катализирующей образование пептидных цепей (рис. 3-6). По форме малая субъединица напоминает телефонную трубку, большая - ковш. Субъединицы образованы рибосомальными РНК (рРНК), на которые приходится около 50% их массы, и особыми белками (до 80 различных видов). Первые образуются в ядрышке, белки же синтезируются в цитоплазме, после чего транспортируются в ядро, где связываются с рРНК. В дальнейшем субъединицы по-отдельности через ядерные поры направляются из ядра в цитоплазму, где они участвуют в синтезе белка.
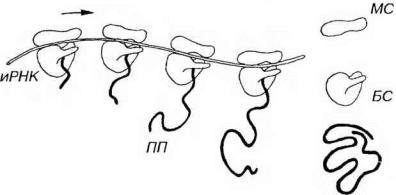
Рис. 3-6. Синтез белка на полирибосоме. Молекула синтезируемого полипептида (ПП) удлиняется по мере движения рибосом (Р), образующих полирибосому, по иРНК (направление показано стрелкой). По завершении синтеза ПП отделяется от Р, которые диссоциирует на две субъединицы - малую (МС) и большую (БС).
Рибосомы могут встречаться в цитоплазме поодиночке (в этом случае они функционально неактивны) или формировать скопления, которые называются полирибосомами (полисомами). В последних отдельные рибосомы (в количестве 3-30) удерживаются общей нитью иРНК толщиной 1.5 нм (см. рис. 3-6). Информация, переносимая иРНК, кодирует последовательность аминокислот в белке соответствующей последовательностью нуклеотидов. Рибосомы переводят (транслируют) эту генетическую информацию в реальную последовательность аминокислот в ходе белкового синтеза.
Функционально неактивные (нетранслирующие) рибосомы постоянно обмениваются своими субъединицами; их сборка происходит в начале синтеза белка, а по завершении синтеза одного полипептида они вновь обратимо диссоциируют.
- 43 -
Синтез белка рибосомой (см. рис. 3-6) начинается со связывания малой субъединицы с участком иРНК; далее рибосома передвигается вдоль цепи иРНК, причем на каждом этапе происходит специфическое присоединение к рибосоме молекулы транспортной РНК (тРНК), антикодон которой комплементарен соответствующему кодону иРНК. В полипептид включается около 20 аминокислот в 1 секунду; белковая молекула среднего размера синтезируется за 20-60 с. Когда образование белковой цепочки завершается, субъединицы диссоциируют, освобождаясь от иРНК. Пока продолжается синтез белка данной рибосомой, новая рибосома занимает освобождающееся на иРНК место. По этой причине активно транслируемая иРНК находится в полисомах. Средняя продолжительность существования синтезированной белковой молекулы варьирует от нескольких минут до нескольких месяцев и даже лет, составляя в среднем около 2 сут.
Белки, которые после синтеза остаются в гиалоплазме (цитоплазматическом матриксе) клетки и далее используются ею, обычно синтезируются на свободных полисомах. Полисомы, которые своими большими субъединицами прикреплены к мембранам ЭПС, синтезируют белки, накапливающиеся в просвете цистерн ЭПС и в дальнейшем либо секретируемые клеткой, либо запасаемые ею внутри гранул (например, лизосомальные ферменты). На полисомах, связанных с мембранами ЭПС, синтезируется также большая часть интегральных мембранных белков. Будет ли белок синтезироваться на ЭПС или на свободных полисомах, зависит от характера начально образуемого отдела полипептидной цепи (сигнальной последовательности или пептида).
Присутствие значительного числа рибосом в цитоплазме клеток, активно синтезирующих белок, придает ей при исследовании на светооптическом уровне базофилию.
Эндоплазматическая сеть
Эндоплазматическая сеть (ЭПС) - органелла, обеспечивающая синтез углеводов, липидов и белков, а также начальные посттрансляционные изменения последних. Она имеет мембранное строение и состоит из системы уплощенных, удлиненных, трубчатых и везикулярных образований. Название органеллы обусловлено характером связи этих элементов друг с другом, образующих в цитоплазме непрерывную трехмерную сеть, элементы которой лишь на отдельных срезах могут иметь вид изолированных структур. Мембрана ЭПС тоньше, чем плазмолемма и содержит более высокую концентрацию белка, что связано с наличи-
- 44 -
ем в ней многочисленных ферментных систем. Степень развития ЭПС и особенности ее строения варьируют в различных клетках и зависят от их функции. Выделяют две разновидности ЭПС: гранулярную ЭПС (грЭПС) и гладкую, или агранулярную ЭПС (аЭПС), которые связаны друг с другом в области перехода, называемой переходной (транзиторной) ЭПС (рис. 3-7).
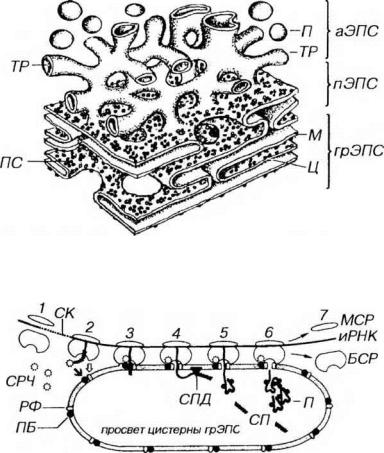
Рис. 3-7. Эндоплазматическая сеть. грЭПС: ПС - полисомы, М - мембрана, Ц - цистерны; аЭПС: ТР - трубочка, П - пузырьки; пЭПС - переходная ЭПС.
Рис. 3-8. Синтез белка на гранулярной эндоплазматической сети. БСР - большая субъединица рибосомы, МСР - малая субъединица рибосомы, РФ - рибофорины, СРЧ - сигнал-распознающая частица, ПБ - причальный белок, СК - сигнальные кодоны (иРНК), СП - сигнальный пептид, СПД - сигнальная пептидаза, П - пептид (продукт синтеза). Светлая стрелка - связывание БСР с РФ, темная стрелка - связывание СРЧ с ПБ.
- 45 -
Гранулярная ЭПС обеспечивает (1) биосинтез всех мембранных белков и белков, предназначенных для экспорта из клетки, и (2) начальное гликозилирование и посттрансляционные изменения белковых молекул. Гранулярная ЭПС образована уплощенными мембранными цистернами и трубочками, на наружной поверхности которых располагаются рибосомы и полисомы, придающие мембранам зернистый (гранулярный) вид (см. рис. 3-7 и 3-8), что и отражено в названии органеллы. Мембраны грЭПС содержат особые белки, которые обеспечивают (1) связывание рибосом и (2) уплощение цистерн. Полость грЭПС содержит рыхлый материал умеренной плотности (продукты синтеза) и сообщается с перинуклеарным пространством (см. ниже). Благодаря грЭПС происходит отделение (сегрегация) вновь синтезированных белковых молекул от шалоплазмы.
Синтез белка на грЭПС начинается на свободных полисомах, которые в дальнейшем связываются с мембранами ЭПС (см. рис. 3-8). На первом этапе взаимодейстия иРНК с рибосомами происходит образование особого сигнального пептида (длиной 20-25 аминокислот), связывающегося с рибонуклеопротеидным комплексом - сигнал-распознающею частицей (СРЧ). Присоединение СРЧ к сигнальному пептиду угнетает дальнейший синтез белка до тех пор, пока комплекс СРЧ-полисома не свяжется со специфическим рецептором на мембране ЭПС - причальным белком (docking protein в англоязычной литературе). После связывания с рецептором СРЧ отделяется от полисом, что разблокирует синтез белковой молекулы. В мембране грЭПС имеются интегральные рецепторные белки рибофорины, обеспечивающие прикрепление больших субъединиц рибосом. Эти белки не диффундируют в область аЭПС и формируют гидрофобные каналы в мембране, служащие для проникновения вновь синтезированной белковой цепочки в просвет грЭПС, что, наряду с рибофоринами, способствует удержанию рибосом на поверхности мембран грЭПС.
В просвете грЭПС сигнальный пептид отщепляется особым ферментом сигнальной пептидазой, которая располагается на внутренней поверхности мембраны. В ходе продолжающейся трансляции внутри цистерны грЭПС накапливается белок, который приобретает вторичную и третичную структуру, а также подвергается начальным посттрансляционным изменениям - гидроксилированию, сульфатированию и фосфорилированию. Наиболее важным из этих изменений является гликозилирование - присоединение к белкам олигосахаридов с образованием гликопротеинов, которое происходит перед секрецией или транспортом большинства белков к другим участкам внутри клетки (комплексу Гольджи, лизосомам или плазмолемме). В отличие от них, растворимые бел-
- 46 -
ки гаалоплазмы не гликозилированы. Гликозилирование обеспечивается связанным с мембраной ферментом гликозилтрансферазой, переносящим олигосахарид.
Хотя грЭПС присутствует во всех клетках (за исключением спермиев), степень ее развития существенно варьирует. Она особенно хорошо развита в клетках, специализирующихся на белковом синтезе, например, в эпителиальных железистых клетках ацинусов поджелудочной железы (вырабатывающих пищеварительные ферменты), фибробластах (синтезирующих коллаген и ряд других белков), плазматических клетках (продуцирующих иммуноглобулины). Для вех этих клеток характерна выраженная базофилия цитоплазмы в области расположения элементов грЭПС. В нейронах отдельным компактным скоплениям цистерн грЭПС на светооптическом уровне соответствуют очерченные участки базофилии цитоплазмы, которые в совокупности называются хроматофильной субстанцией или тельцами Ниссля.
Агранулярная (гладкая) ЭПС представляет собой трехмерную замкнутую сеть мембранных анастомозирующих трубочек, канальцев, цистерн и пузырьков диаметром 20-100 нм, на поверхности которых рибосомы отсутствуют (см. рис. 3-7), что определило ее название. Соответственно, на мембранах аЭПС отсутствуют рецепторы, связывающие субъединицы рибосом (рибофорины). Предполагают, что аЭПС образуется в результате формирования выростов грЭПС, мембрана которых утрачивает рибосомы.
Функции аЭПС включают: (I) синтез липидов, в том числе мембранных (ферменты липидною синтеза располагаются на наружной - обращенной в сторону гаалоплазмы - поверхности мембраны аЭПС), (1) синтез гликогена, (3) синтез холестерина, (4) детоксикацию эндогенных и экзогенных веществ, (5) накопление ионов Са2+, (6) восстановление кариолеммы в телофазе митоза (эта функция оспаривается авторами, считающими, что кариолемма восстанавливается за счет мембранных пузырьков, на которые она ранее распалась). Помимо указанных основных функций, в некоторых типах клеток аЭПС выполняет ряд дополнительных - например, в мегакариоцитах (гигантских клетках костного мозга) ее элементы образуют демаркационные каналы, разделяющие формирующиеся тромбоциты.
Способность аЭПС к накоплению ионов Са2+ обусловлена наличием: (1)
кальциевого насоса в ее мембране, который обеспечивает транспорт этих ионов из гиалоплазмы внутрь цистерн аЭПС; (2) кальций-связывающих белков (кальсеквестрина в мышечных клетках, кальрети-
- 47 -
кулина - преимущественно в немьшечных и др.), которые в просвете цистерн образуют комплекс с ионами Са2+ и (3) кальциевых каналов в мембране аЭПС, которые осуществляют выведение Са2+ в гиалоплазму. Механизмы действия кальциевых каналов неодинаковы в клетках разных типов. Функция накопления ионов Са2+ особенно выражена в мышечных клетках, в которых специализированная аЭПС (именуемая саркоплазматической сетью) обеспечивает мышечное сокращение путем накопления и выделения значительных количеств ионов Са2+, связывающихся с особыми белками.
Обычно аЭПС в цитоплазме занимает меньший объем, чем грЭПС, однако она очень хорошо развита в клетках, синтезирующих стероиды, триглицериды и холестерин. Так, аЭПС занимает значительную часть объема цитоплазмы в клетках, которые активно продуцируют стероидные гормоны (клетки коркового вещества надпочечника, интерстициальные гландулоциты яичка (клетки Лейдига), клетки желтого тела яичника (лютеоциты) и др. Она также хорошо развита в клетках печени (гепатоцитах), где ее ферменты участвуют в процессах окисления, конъюгации и метилирования, которые обеспечивают нейтрализацию и детоксикацию ряда гормонов и вредных веществ (алкоголя, инсектицидов и др.).
Переходная (транзиторная) ЭПС - участок перехода грЭПС в аЭПС у формирующейся поверхности комплекса Гольджи. В области переходной ЭПС трубочки распадаются на отдельные фратенты, образующие окаймленные транспортные пузырьки, которые переносят материал из ЭПС в комплекс Гольджи (рис. 3-9).
Комплекс ГОЛЬДЖИ
Комплекс Гольджи - сложно организованная мембранная органелла, образованная тремя основными элементами - (1) стопкой уплощенных мешочков (цистерн), (2) пузырьками и (3) вакуолями, или секреторными пузырьками (см. рис. 3-1 и 3-9). Комплекс этих элементов называется диктиосомой (от греч. с11к1уоп - сеть); в некоторых клетках имеются множественные диктиосомы (до нескольких сотен). В специализированных секреторных клетках комплекс Гольджи располагается надъядерно под апикальной частью клетки, через которую происходит выделение секрета механизмом экзоцитоза. Нередко он лежит у ядра вблизи центриолей, в некоторых клетках его компоненты рассеяны по всей цитоплазме.
1. Цистерны имеют вид изогнутых дисков ("блюдец") диаметром 0.5-5 мкм и образуют стопку из 3-30 элементов, разделенных простран-
- 48 -
ством 15-30 нм; выпуклой стороной стопка обычно обращена к ядру, вогнутой - к плазмолемме. Каждая группа цистерн внутри стопки отличается особым составом ферментов, определяющим характер реакций процессинга белков. Периферические отделы цистерн несколько расширены, от них отщепляются пузырьки и вакуоли. Механизм, удерживающий стопку в виде единого образования, неизвестен. При наличии в клетке множественных диктиосом их цистерны связаны друг с другом системой анастомозирующих и ветвящихся трубочек.
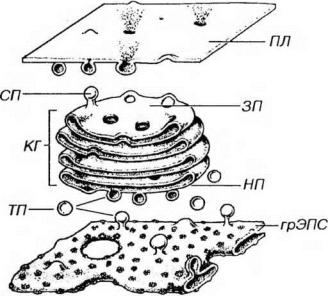
Рис. 3-9. Синтетический аппарат клетки: грЭПС продуцирует белки, которые переносятся к незрелой поверхности (НП) комплекса Гольджи (КГ). От зрелой поверхности (ЗП) отделяются секреторные пузырьки (СП), содержимое которых выделяется за пределы клетки при слиянии мембраны СП с плазмолеммой (ПЛ)
2.Пузырьки - сферические окруженные мембраной элементы диаметром 40-80 нм с содержимым умеренной плотности; образуются путем отщепления от цистерн.
3.Вакуоли - крупные (диаметр - 0.1-1.0 мкм), окруженные мембраной сферические образования, отделяющиеся от цистерны на зрелой поверхности комплекса Гольджи (см. ниже) в некоторых железистых клетках. Они содержат секреторный продукт умеренной плотности, находящийся в процессе конденсации (конденсирующие вакуоли).
- 49 -
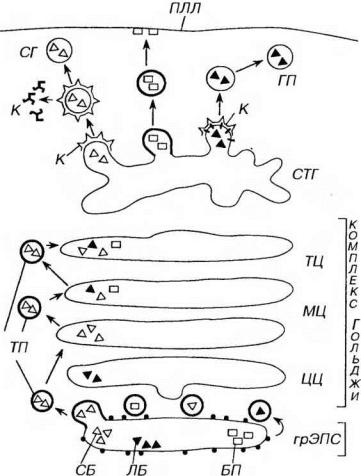
Рис. 3-10. Синтетический аппарат клетки (схема). ГрЭПС (синтез и начальный процессинг белков): СБ - секреторные белки, ЛБ - лизосомальные белки, БП - белки плазмолеммы; комплекс Гольджи (процессинг белков): ТП - транспортные пузырьки, ЦЦ - цисцистерны (комплекса Гольджи), МЦ - медиальные цистерны, ТЦ - трансцистерны, СТГ - сеть транс-Гольджи (сортировка белков), К - клатрин, СГ - секреторная гранула, ПЛ - первичная лизосома, ПЛЛ - плазмолемма, К - клатрин.
Полярность комплекса Гольджи. Комплекс Гольджи представляет собой поляризованную структуру, в которой выделяют две поверхности, обладающие структурными и функциональными различиями:
(а) цис- (от лат. а я - по эту сторону), незрелую, формирующуюся -
выпуклой формы, обращенную к ЭПС и связанную с системой мелких (транспортных) пузырьков, отщепляющихся от ЭПС;
- 50 -
