
Bykov-_gistologia_obschaya
.pdfНаконец, в самые последние годы сформировалось и получило мощное развитие новое направление биоинженерии, использующее знания, накопленные в области гистологии и цитологии в целях медицины - тканевая инженерия. Задачей этого быстро совершенствующегося направления является выращивание в искусственных условиях клеток, тканей и органов человека для последующей трансплантации и замещения поврежденных в результате травмы или заболевания. Полученные результаты и имеющиеся тенденции развития методов тканевой инженерии свидетельствуют о большой перспективности этого направления для практической медицины.
- 11 -

Глава 2
МЕТОДЫ ЦИТОЛОГИЧЕСКИХ И ГИСТОЛОГИЧЕСКИХ ИССЛЕДОВАНИЙ
ОБЩИЕ СВЕДЕНИЯ
Гистология и цитология располагают разнообразным арсеналом как классических, так и современных методов, направленных на изучение строения и функций клеток, тканей и органов. Цитологические и гистологические методы исследования получают все большее распространение и в клинической диагностике различных заболеваний. В этой связи вопросы взятия, обработки и изучения материала для цитологического и гистологического исследования, рассматриваемые ниже, имеют не только теоретическое, но и сугубо прикладное, клиническое, значение. В последние годы особую роль в раскрытии закономерностей деятельности органов, тканей и клеток играют новые морфофункпиональные методы, использующие достижения современной биохимии, физики, иммунологии и молекулярной биологии - цито- и гистохимические, иммуноцито- и гистохимические, авторадиографические, метод гибридизации in situ и др. Использование методов электронной микроскопии позволяет с высоким разрешением выявить тонкие структурные детали на различных уровнях - от клеточного до макромолекулярного. Указанные современные методы из области научных исследований активно проникают в практическую клиническую диагностику.
Размеры объектов и их деталей, изучаемые с использованием цитологических и гистологических методов, обычно столь малы, что невидимы невооруженным глазом. Они составляют преимущественно микрометры (мкм) в световой микроскопии и нанометры (нм) в электронной микроскопии. Широко используемая ранее единица ангстрем (А), равная 10-1нм, в настоящее время более не применяется.
Соотношения между величинами линейных единиц измерения, наиболее часто используемых в гистологии и цитологии:
1 |
миллиметр (1 мм) |
= 10-3 |
м |
= 103 |
мкм |
= 106 |
нм |
= 10-7 |
А |
1 |
микрометр (1 мкм) = 10-6 |
м |
= 10-3 |
мм |
= 103 |
нм |
= 104 |
А |
|
1 |
нанометр (1 нм) |
= 10-9 |
м |
= 10-6 |
мм |
= 10-3 |
мкм |
= 10 |
А |
1 |
ангстрем (1 А) |
= 10-10 м |
= 10-7 |
мм |
= 10-4 |
мкм |
= 10-1 |
нм |
|
- 12 -
МЕТОДЫ ИЗУЧЕНИЯ ОГАНОВ, ТКАНЕЙ И КЛЕТОК ПОД СВЕТОВЫМ МИКРОСКОПОМ
ГИСТОЛОГИЧЕСКИЕ И ЦИТОЛОГИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ
Взятие материала для гистологического исследования производится путем биопсии (от греч. bios - жизнь и opsis - зрение) - извлечения кусочка изучаемого органа (биоптата) из живого организма в целях прижизненной диагностики. Биоптат часто получают из внутренних органов при эндоскопии (от греч. endo - внутри, skopeo - смотреть) - исследовании полых органов с помощью гибких трубчатых приборов, снабженных освещением, оптическими системами и дополнительными приспособлениями (в частности, для взятия цитологического и гистологического материала). Материал для гистологического исследования в целях посмертной диагностики получают также при патологоанатомическом вскрытии - аутопсии (от греч. autos - сам и opsis - зрение, т.е. увиденное собственными глазами). В экспериментальных исследованиях получают ткани и органы лабораторных животных (целиком или в виде фрагментов). После взятия материала его подвергают специальной обработке для подготовки к последующему микроскопическому исследованию.
Подготовка материала к гистологическому исследованию. Основным методом в гистологических исследованиях является изучение окрашенных срезов различных тканей и органов. Традиционный способ подготовки материала для получения постоянного гистологического препарата включает:
(1) фиксацию материала, (2) проводку (обезвоживание), (3) заливку (уплотнение), (4) приготовление гистологических срезов (резку), (5) окрашивание срезов, (б) заключение срезов.
1. Фиксация гистологического материала (от лат. fixatio - закрепление)
осуществляется для "закрепления" его прижизненного строения. Она предотвращает разложение извлеченных из организма тканей под действием собственных ферментов (процесс аутолиза - от греч. autos - сам и lysis - распад), а также ферментов микроорганизмов и способствует сохранению целостности клеточных и тканевых структур. Воздействуя на ткани, фиксатор (например, формалин, спирт, пикриновая кислота или различные сложные смеси веществ), вызывает необратимую коагуляцию белков и быструю гибель клеток. Наиболее часто используют иммерсионную фиксацию - погружение (иммерсию - от лат. immersio - погружение) кусочка органа в раствор фиксатора; в экспериментальных условиях фиксатор нередко вводят через сосудистую систему (перфузионная фиксация - от лат. perfusio - вливание).
- 13 -
Хотя исследования фиксированного материала проводятся не на живых, а на мертвых тканях и клетках, при оптимальной фиксации они сохраняют морфологические особенности, свойственные живым объектам. Благодаря этому на основании анализа фиксированного материала можно делать заключения о прижизненном строении клеток и тканей. При фиксации материала, как и на всех дальнейших этапах его подготовки к исследованию, возможно появление артефактов.
Артефакты (от лат. arte - искусство и factum - продукт) - признаки, возникающие в структуре клеток и тканей в результате вмешательства исследователя на различных этапах обработки материала и отсутствующие в них прижизненно. При анализе конкретного объекта предпочтительно использование методов, дающих минимально выраженные артефакты. Типичным артефактом фиксации, в особенности, в спиртовых растворах, служит сжатие клеток и тканей.
2.Проводка (обезвоживание) материала осуществляется путем последовательного помещения кусочка в спирты возрастающих концентраций для удаления из него воды. Она необходима для выполнения следующего этана обработки материала - его заливки.
3.Заливка (уплотнение) материала достигается путем пропитывания обезвоженного кусочка затвердевающими средами: расплавленным парафином, целлоидином или специальной пластической массой. В результате заливки после охлаждения парафина или полимеризации пластмассы кусочек ткани (блок) становится достаточно плотным для получения тонких срезов при резке.
4.Приготовление гистологических срезов (резка) осуществляется на специальном приборе (микротоме) с помощью особых стальных ножей - бритв (рис. 2-1). При этом обычно получают срезы залитого в парафин или другую среду материала толщиной 5-7 мкм (в оптимальном варианте - серийные, т.е. следующие один за другим в виде непрерывной ленты).
Резка замороженного материала (затвердевшего при быстром охлаждении углекислотой или погружением в жидкий азот) позволяет получить тонкие срезы, минуя этап заливки. Она производится на замораживающем микротоме (микротоме, снабженном замораживающим устройством) или в криостате (специальном холодильном шкафу с помещенным в него микротомом). Благодаря своей скорости этот метод используется для экспресс-диагностики (в частности, в ходе выполнения хирургических операций, когда дальнейший характер вмешатель-
- 14 -
ства может определяться поставленным гистологическим диагнозом). Он применяется также в тех случаях, когда фиксация тканей нежелательна, например, при гистохимических и иммуногистохимических исследованиях (см. ниже). При проведении этих исследований важно, что нефиксированный материал, замороженный в жидком азоте, может храниться в нем неопределенно долго без изменения содержания, распределения и активности всех биологических веществ.
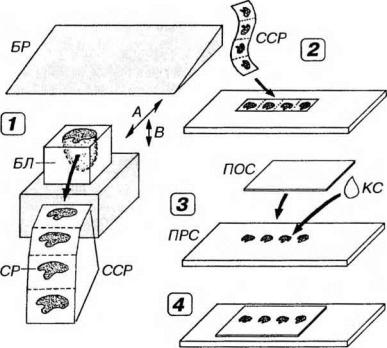
Рис. 2-1. Приготовление постоянного гистологического препарата из кусочка ткани, залитого в затвердевающую среду. Фиксированный и залитый в парафин, целлоидин или пластмассу кусочек ткани - блок (БЛ) - режут с помощью стальной бритвы (БР) на специальном приборе - микротоме (1). Для получения среза (СР) по оси А в различных конструкциях микротомов перемещается либо БР, либо БЛ, тогда как второй элемент остается неподвижным. Толщина СР определяется величиной шага взаимного смещения БЛ и БР по оси В. СР в виде серии (ССР) далее монтируют на предметное стекло (ПРС), подвергают депарафинированию (или удалению пластмассы) и окрашивают (2). Далее СР обезвоживают, просветляют, заключают в прозрачную консервирующую среду (КС) - бальзам или синтетическую смолу - и закрывают сверху покровным стеклом (ПОС) - (3). В результате получают постоянный гистологический препарат (4).
- 15 -
5. Окрашивание срезов обычно производится после их монтирования (приклеивания) на предметное стекло и удаления из них парафина (депарафинирования). Окрашивание позволяет выявить различные структурные компоненты тканей и клеток благодаря их неодинаковому сродству к гистологическим красителям.
Гистологические красители разделяются на две главные группы - основные и кислые.
Основные красители (например, гематоксилин, толуидиноный и метиленовый синий, азур II) активно связываются со структурами, содержащими кислоты (например, ДНК и РНК) и несущими отрицательный заряд. Способность окрашиваться основными красителями называется базофилией (от греч. basis - основание и philia - любовь), а структуры, связывающие эти красители - базофильными. Базофилией в клетке обладает ядро (вследствие высокого содержания ДНК и РНК), а также цитоплазма - при высоком содержании в ней рибосом или гранулярной (шероховатой) эндоплазматической сети (грЭПС). Базофильно может окрашиваться межклеточное вещество некоторых тканей (например, хрящевой).
Метахромазия (от греч. meta - изменение и chroma - краска) - изменение цвета отдельных основных красителей, (например, толуидинового синего, азура II или тионина) при их связывании с некоторыми структурами, обладающими специфическими химическими свойствами (обычно высокой концентрацией сульфатированных гликозаминогликанов). Способностью окрашиваться метахроматически обладают гранулы Гмзофильных лейкоцитов и тучных клеток, а также основное вещество хряща. Указанные красители окрашивают другие базофильные структуры в тех же тканях в обычный свойственный им цвет (ортохроматически - от греч. orthos - правильный и chroma - краска).
Кислые красители (например, эозин, эритрозин, оранж G, лихтгрюн) связываются с различными структурами, несущими положительный заряд. Способность окрашиваться кислыми красителями называется оксифилией, или ацидофилией (от греч. oxys или лат. acidus - кислый и греч. pliilia - любовь), а структуры, связывающие эти красители - оксифильными, или ацидофильными. Оксифилия свойственна цитоплазме клеток (в особенности, при высоком содержании в ней митохондрий и некоторых белковых секреторных гранул), эритроцитам (благодаря высокой концентрации в них гемоглобина). Оксифильно окрашивается цитоплазма мышечных клеток сердца (кардиомиоцитов), мышечных волокон скелетной мускулатуры, некоторые компоненты межклеточного вещества (например, коллагеновые волокна).
- 16 -
Комбинированное окрашивание препаратов основано на использовании как основных, так и кислых красителей, обладающих контрастирующими цветами. Наиболее распространенная общеобзорная окраска гистологических препаратов сочетает гематоксилин (основной краситель) с эозином (кислым красителем).
Избирательное (элективное, специальное) окрашивание препаратов, в отличие от общеобзорных методов, выявляет не общую морфологическую картину, а какие-то конкретные структуры, обладающие высоким сродством к определенным красителям. Так. для избирательного выявления в тканях эластических элементов (волокон, мембран) при-меняют окраску орсеином, жировые клетки и липидные включения в различных клетках окрашивают Суданом 111 или четырехокисью осмия; ретикулярные волокна, нервные и некоторые эндокринные клетки - импрегнацией (от лат. impregnatio - пропитывание) солями серебра. Способы избирательного выявления отдельных тканевых и клеточных структур тесно смыкаются с цито- и гистохимическими методами, обладающими более высокой специфичностью выявления конкретных веществ (см. ниже).
6. Заключение (монтирование) срезов в прозрачную застывающую консервирующую среду - смолу хвойных деревьев (бальзам) или синтетические среды - осуществляется после их обезвоживания и просветления. На постоянном гистологическом препарате срез ткани рас-полагается на предметным стекле, сверху закрыт покровным стеклом (см. рис. 2-1) и окружен заливочной средой, обладающей коэффициентом преломления световых лучей, близким к таковому у стекла.
Взятие материала для диагностического цитологического исследования обычно осуществляется путем получения мазка, соскоба, отпечатка или смыва с поверхности доступных слизистых оболочек (например, полости рта или влагалища) и кожи, а при использовании современных клинических методов эндоскопии - и с поверхности глубоко лежащих слизистых оболочек (например, пищевода, желудка, мочевого пузыря). Материал может быть получен также методом понкоигольной аспирационной биопсии - путем пункции тонкой иглой п отсасывания (аспирации - от лат. ad - к и spirare - дуть) клеточного субстрата из определенного органа или его участка (например, щитовидной железы или лимфатического узла). В некоторых случаях пользуется толстой иглой (например, для получения костного мозга).
Подготовка материала к цитологическому исследованию включает:
его нанесение тонким слоем на предметное стекло, фиксацию, окрашивание и заключение (при необходимости приготовле-
- 17 -
ния постоянного препарата). Указанные этапы аналогичны таковым при приготовлении гистологического препарата (см. выше), однако благодаря тонкости мазка обычно требуют значительно меньше времени.
ЦИТОХИМИЧЕСКИЕ И ГИСТОХИМИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ
Цито- и гистохимические методы исследования направлены на выявление в клетках и тканях конкретных химических веществ (на-пример, железа, кальция, белков, липидов, нуклеиновых кислот, гликогена, ферментов) или химических групп (например, альдегидных, сульфгидрильных, аминогрупп). Они основаны на специфическом связывании красителей с определенными химическими соединениями (например, РНК и ДНК) или образовании окрашенных продуктов из неокрашенных в участке расположения искомого вещества (например, фермента) в результате гистохимической реакции его выявления. Материал, предназначенный для изучения цито- и гистохимическими методами, следует фиксировать способом, максимально сохраняющими выявляемое вещество; предпочтительно в этих целях использовать замороженный нефиксированный материал. Методами цито- и гистохимии изучают распределение и оценивают содержание в клетках и неклеточных компонентах тканей веществ, относящихся к различным группам - ДНК и РНК, белков, аминокислот, липидов, углеводов, минеральных веществ, оценивают активность ферментов.
ШИКили (PAS)-реакция - пример одного из наиболее широко используемых гистохимических методов. Название метода происходит от сокращения терминов Шиффа (реактив) - Иодная Кислота (по англ. Periodic Acid Schiff). Метод используется для выявления соединений, богатых углеводными группами - гликогена, гликопротеинов, мукопротеииов, протеогликанов и др. Он основан на окислении йодной кислотой гидроксильных групп сахаров до альдегидных, с которыми связывается бесцветный реактив Шиффа (содержащий фуксин), превращаясь в стабильное соединение красного цвета.
ИММУНОЦИТОХИМИЧЕСКИЕ И ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ
Иммуноцитохимические и иммуногистохимические методы
обеспечивают наиболее специфическое выявление веществ в клетках и тканях. Они основаны на обработке мазков или срезов маркированны-
- 18 -
ми специфическими антителами к выявляемому веществу, которое служит антигеном. При использовании прямого метода происходит реакция специфического связывания маркированных антител непосредственно с искомым веществом (рис. 2-2). При непрямом (более чувствительном) методе немаркированные первичные антитела взаимодействуют с искомым антигеном, а далее их выявляют с помощью вторичных меченых антител (для которых первичные служат антигенами). Маркировка антител производится путем их конъюгации с флюоресцентными красителями (родамином, флюоресцентом), ферментами (пероксидазой хрена, щелочной фосфатазой, которые далее выявляются цитохимически) или электронно-плотными частицами (ферритином, коллоидным золотом).
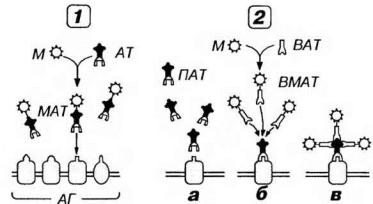
Рис. 2-2. Иммуноцитохимическое выявление веществ в клетках и тканях. 1 - прямой метод: специфические антитела (АТ) к исследуемому веществу - антигену (АГ) - конъюгируют с маркером (М), получая маркированные АТ (МАТ), которые специфически связываются с искомым АГ. 2 - непрямой метод: (а) клетки (ткань) обрабатывают первичными (немечеными) АТ (ПАТ), ПАТ специфически связываются с АГ, после чего клетки обрабатывают вторичными мечеными АТ (ВМАТ), полученными путем конъюгации вторичных (немеченых) АТ (ВАТ) с М (б). Поскольку для ВАТ роль АГ играют ПАТ, они специфически связываются с ними (в), тем самым косвенно выявляя и искомый АГ. Чувствительность непрямого метода выше, чем прямого, так как он обеспечивает связывание большего количества маркера с выявляемым веществом.
Очевидно, что фиксация и проводка материала должны обеспечить сохранность искомого вещества. С помощью описанных методов производится идентификация клеток различных типов по их маркерным признакам, изучаются синтетические и секреторные процессы, выявляются гормоны и их рецепторы.
- 19 -
МЕТОД ГИБРИДИЗАЦИИ IN SITU
Метод гибридизации in situ позволяет выявить определенную последовательность нуклеотидов в молекуле РНК или ДНК и благодаря этому изучить локализацию генов и продуктов их транскрипции. Он основан на специфическом связывании (гибридизации) участков ДНК или РНК с соответствующими маркированными фрагментами РНК или ДНК (зондами), которые содержат последовательности нуклеотидов, комплементарные искомым.
МЕТОД АВТОРАДИОГРАФИИ
Метод авторадиографии (или радиоавтографии) основан на выявлении локализации в тканях введенных в них веществ, меченных радиоактивными изотопами. Меченое вещество вводится непосредственно в организм экспериментального животного или в инкубационную среду in vitro, в которую помешают свеж удалённый кусочек ткани (в последнем варианте допустимо использование тканей человека). Срезы материала, содержащего меченое вещество, в темноте покрывают фотоэмульсией, которая после определенной экспозиции оказывается засвеченной в участках расположения радиоактивного изотопа. При проявке эмульсии серебро, выпавшее в таких участках, имеет вид зерен (треков - от англ. track - след). Полученный препарат (радиоавтограф) окрашивается и имеет вид обычного гистологического среза, однако содержащиеся в его определенных участках зерна серебра выявляют
локализацию меченого вещества. В качестве изотопов наиболее часто используют 3Н, 14С, 32Р, 35S, 127J, 131J.
Авторадиография позволяет проследить ход включения меченого предшественника в макромолекулы и транспорт последних в клетках и тканях. Этим методом получены основополагающие данные о процессах синтеза и секреции различных веществ, локализации рецепторов, делении клеток и кинетике клеточных популяций.
СПЕЦИАЛЬНЫЕ МЕТОДЫ ОКРАШИВАНИЯ НЕФИКСИРОВАННЫХ ТКАНЕЙ
Витальная окраска. Некоторые красители (например, трипановый синий, литиевый кармин, тушь) не являются токсическими по отношению к живым клеткам и не разрушаются ими. Они представляют собой не истинные растворы, а взвесь частиц. При их введении в организм (чаще всего в кровь) эти красители активно захватываются фагоцитирующими клетками и накапливаются в них, тем самым маркируя эти клетки.
- 20 -
