
Bykov-_gistologia_obschaya
.pdfпептидных цепочек длиной 8-11 аминокислот, определяющих специфичность реакции антигена с антителом;
3)синтез гликопротеиновых молекул главного комплекса гистосовместимости, или МНС (от англ. Major Histocompatibility Complex),
называемого у человека также системой HLA (от англ. Human Leukocyte Antigens - антигены лейкоцитов человека); связывание синтезированных молекул МНС с эпитопами антигенов;
4)транспорт комплексов молекулы МНС/эпитоп антигена на поверхность АПК, где они представляются распознающим их лимфоцитам;
5)экспрессию на поверхности клетки (наряду с комплексом молекулы МНС/антиген) ряда добавочных (костимулирующих) молекул, усиливающих процесс взаимодействия с лимфоцитами; наиболее важной из них является В7;
6)секрецию растворимых медиаторов (преимущественно ИЛ-1), которые вызывают активацию лимфоцитов.
Синтез молекул МНС, процессинг и представление антигенов
Молекулы МНС I класса синтезируются в грЭПС (рис. 8-1), где они формируют комплексы с антигенами, являющимися эндогенно синтезированными молекулами (например, вирусными белками в инфицироваиных клетках или белками опухолевых клеток). Эти антигены, находящиеся в гиалоплазме, предварительно подвергаются расщеплению на короткие пептидные фрагменты (8-11 аминокислот) в особом протеолитическом АТФ-зависимом крупном белковом комплексе - протеасоме. Затем они транспортируются в просвет грЭПС с помощью специальных переносчиков в мембране - TAP-белков (от англ. Transporter for Antigen Presentation -
переносчик для представления антигена), где связываются с молекулами МНС I класса. Образованные комплексы транспортируется через комплекс Гольджи к плазмолемме и экспрессируются на ее поверхности.
- 221 -
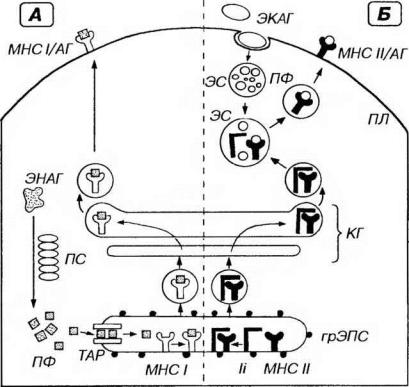
Рис. 8-1. Пути процессинга и представления антигенов. Антигены (АГ) - эндогенные (ЭНАГ) или экзогенные (ЭКАГ) - в цитоплазме АПК подвергаются процессингу, связываются с молекулами главного комплекса гистосовместимости (МНС) и экспрессируются на плазмолемме (ПЛ) в виде комплекса МНС/АГ. А. ЭНАГ в гиалоплазме расщепляются в протеасоме (ПС) на пептидные фрагменты (ПФ), которые с помощью TAP-белков (ТАР) переносятся в просвет грЭПС. Здесь они связываются с молекулами МНС I класса (МНС I), образуя комплексы МНС 1/АГ, транспортируемые через комплекс Гольджи (КГ) к ПЛ. Б. ЭКАГ захватываются механизмом эндоцитоза и подвергаются процессингу в эндосомах (ЭС) или лизосомах до ПФ. В грЭПС молекулы МНС II класса (МНС II) и инвариантные цепи (li) связываются с образованием комплекса МНС II/ li, который через КГ направляется к ЭС, содержащим ПФ. Комплекс МНС ll/li в ЭС диссоциирует, освобождая МНС II, связывающиеся с ПФ в комплекс МНС ll/АГ, который переносится к ПЛ.
Распределение молекул МНС I класса. Молекулы МНС I класса обнаруживаются на поверхности всех клеток и тромбоцитов (благодаря чему распознающие их цитотоксические лимфоциты имеют возможность уничтожения любых зараженных или опухолевых клеток).
- 222 -
Молекулы МНС II класса также образуются в грЭПС (см. рис. 8-1), где они формируют комплекс с так называемой инвариантной пептидной цепью (Ii). Предполагают, что она (1) препятствует связыванию молекул МНС II класса с эндогенными пептидами, (2) является переносчиком молекул МНС II класса и
(3) содержит кодирующие сигналы для последующего направления образованного комплекса в эндосому. Комплекс молекулы МНС II класса/цепь Ii через сеть транс-Гольджи в транспортных пузырьках направляется к эндосоме, содержащей экзогенные (например, бактериальные) антигены, предварительно подвергнутые процессингу. Пузырьки сливаются с эндосомой, внутри которой цепь Ii отсоединяется от молекул МНС II класса. Последние тут же образуют комплекс с антигенными пептидами, далее транспортируемый на поверхность клетки.
Распределение молекул МНС II класса. Гликопротеины МНС II класса экспрессируются на "профессиональных" АПК (макрофагах, дендритных АПК и В-лимфоцитах), что обеспечивает их взаимодействие с Т-хелперами (см. ниже). Изредка их экспрессия может индуцироваться на клетках других типов ("непрофессиональных" АПК).
Способность молекул МНС образовывать комплексы с антигенными пептидами различается у отдельных людей, что может оказывать влияние на особенности их иммунных реакций, в частности, на устойчивость к инфекциям.
Миграция дендритных АПК и их взаимодействия с другими клетками
1.Дендритные АПК, захватившие антиген, мигрируют из тканей в лимфатические капилляры, а оттуда - в Т-зависимые зоны регионарных лимфатических узлов, где они окончательно созревают и приобретают способность к представлению антигенов (в комплексе с молекулами МНС) лимфоцитам.
2.При встрече с Т-лимфоцитом, обладающим рецепторами к соответствующему антигену, дендритная АПК контактно взаимодействует с ним, активируя его и инициируя развитие иммунной реакции. Характер этой реакции зависит от природы молекул МНС, связанных с антигеном. Антигены, образующие комплекс с молекулами МНС I класса, распознаются лимфоцитами
споверхностными маркерами CD8 (см. ниже), а антигены, связанные с белками МНС II класса - лимфоцитами с фенотипом CD4 Особенности архитектоники лимфоидной ткани
- 223 -
и путей циркуляции лимфоцитов обеспечивают максимальное количество контактов лимфоцитов с потенциальным антигеном на поверхности АПК. Более того, установлено, что дендритные АПК вырабатывают хемокин, привлекающий Т-лимфоциты.
Полноценная функция дендритных АПК способствует эффективному и своевременному распознаванию микробных и опухолевых антигенов, что препятствует развитию инфекций и новообразований. Последние часто протекают на фоне сниженной активности АПК, поэтому стимуляция функции АПК рассматривается как перспективный метод иммунотерапии таких заболеваний.
Т-ЛИМФОЦИТЫ
Функции Т-лимфоцитов:
1)распознавание антигенных детерминант (эпитопов) - обеспечивается благодаря наличию на их плазмолемме Т-клеточных рецепторов (ТКР);
2)элиминация антигенов - осуществляется сенсибилизированными лимфоцитами (киллерами);
3)регуляция иммунного ответа - обеспечивается специальными субпопуляциями клеток, активирующих и угнетающих иммунные реакции;
4)регуляция гемопоэза (путем выделения гемопоэтических факторов);
5)регуляция пролиферации нелимфоидных клеток, участие в поддержании структурного гомеостаза (путем секреции цитокинов).
Цитофизиология Т-лимфоцитов и их участие в иммунных реакциях
Развитие Т-лимфоцитов в тимусе
Т-лимфоциты развиваются в пишу се (откуда и произошло их название) из предшественников (претимоцитов), поступающих в него из красного костного мозга. В тимусе Т-лимфониты (тимоциты) пролиферируют и дифференцируются, приобретая: (1) специфические Т-клеточные рецепторы (ТКР), распознающие разнообразные антигены; (2) поверхностные маркеры, которые характерны для субпопуляций лимфоцитов с определенными функциями.
- 224 -
Т-клеточные рецепторы обладают исключительным разнообразием, которое обусловлено относительной нестабильностью генома лимфоидных клеток-предшественников, в результате которой происходит постоянная перестройка (реаранжировка) их генетического аппарата, кодирующего специфичность ТКР (порядка 109 вариантов).
Поверхностные функциональные маркеры в соответствии с принятой международной номенклатурой обозначаются аббревиатурой CD (от англ. Cluster of Differentiation - группа дифференцировки) с добавлением цифровых и буквенных символов. С ТКР в мембране всех Т-лимфоцитов связан молекулярный комплекс CD3, который обеспечивает передачу сигнала в цитоплазму лимфоцита с ТКР после его взаимодействия с антигеном.
Незрелые Т-клетки составляют лишь несколько процентов от общего числа клеток тимуса и характеризуются фенотипом CD4- CD8-. Созревая, они превращаются в клетки с ТКР и поверхностным маркером CD4 или CD8. Такие клетки, наиболее многочисленные в тимусе, занимают его кору, в которой они подвергаются положительной и отрицательной селекции.
Процесс отбора (селекции) Т-лимфоцитов внутри тимуса приводит к гибели большей части (более 90%) образовавшихся в нем клеток механизмом апоптоза. При этом погибают тимоциты, не обладающие необходимыми рецепторами (и поэтому бесполезные) или имеющие рецепторы к антигенам собственного организма (и поэтому опасные).
Миграция Т-лимфоцитов из тимуса и их циркуляция в организме
Прошедшие селекцию Т-лимфоциты из тимуса поступают в кровь, где они составляют 70-80% всех лимфоцитов и циркулируют в ней в течение различного времени. Покидая сосудистое русло через стенку его особого участка (посткапиллярных венул с высоким эндотелием), они заселяют так называемые Т-зависимые зоны периферических органов иммунной системы - лимфатических узлов, селезенки, миндалин, аппендикса, пейеровых бляшек и др. (см. главу "Иммунная система" в курсе частной гистологии), откуда через лимфу могут вновь попадать в кровь. Лимфоцита из сосудистого русла направляются также в ткани органов, не относящихся к иммунной системе. При этом они мигрируют через стенку мелких кровеносных сосудов (посткапиллярных венул) с обычным (плоским) эндотелием. До встречи с антигенами лимфоциты называют "наивными" (не имевшими "опыта" взаимодействия с антигеном), или виргильными (девственными, от лат. virgo - дева).
- 225 -
Взаимодействие Т-лимфоцитов с антигенами и их участие в иммунных реакциях
Т-лимфоциты способны взаимодействовать с антигеном (соответствующим по специфичности их ТКР) только, если он представлен им особыми АПК, в которых он ранее был подвергнут процессингу. В результате взаимодействия с антигеном Т-лимфоциты активируются, пролиферируют (экспансия клона), секретируют разнообразные цитокины (лимфокины), вновь поступают в кровь, а из нее - повторно в ткани (процесс рециркуляции), где они и осуществляют свои защитные функции. Часть лимфоцитов превращается в долгоживущие Т-клетки памяти (с фенотипом CD45RO+), которые сохраняют в течение всего времени своего существования усиленную экспрессию ТКР и ряда маркеров, что определяет их высокую чувствительность к повторному воздействию данного антигена. Рециркулирующие Т-лимфоциты живут до 4-6 мес., Т-клетки памяти сохраняются преимущественно в лимфоидных органах в течение многих лет. Специфика участия Т-лимфоцитов в различных защитных реакциях обусловлена их принадлежностью к одной из функциональных групп (субпопуляций).
Основные субпопуляции Т-лимфоцитов включают: Тх - Т-хелперы (от англ. help - помогать). Тс - Т-супрессоры (от англ. suppress - подавлять), Тк - Т- киллеры (Т-нитотокснческие лимфоциты), Тгзт - Т-клетки ГЗТ (гиперчувствительности замедленного типа) и Тп - Т- клетки памяти.
Функциональные группы Т-лимфоцитов объединяют 1) регуляторные клетки, влияющие на межклеточные взаимодействия (Тх и Тс), 2) эффекторные клетки, непосредственно осуществляющие защитные реакции (Тк и Тгзт), и 3) клетки памяти, сохраняющие иммунологическую "память" о первичном контакте с антигеном (Тп).
Активация Т-лимфоцитов требует распознавания ими, как минимум, двух сигналов:
1)эпитопа антигена в комплексе с молекулами МНС на плазмолемме АПК. Этот комплекс распознается с помощью ТКР и CD4или С08-компонента на мембране Т-лимфоцитов;
2)цитокинов или их комбинаций.
Рестрикция по МНС (от лат. restrictio - ограничение) - способность определенных субпопуляций Т-лимфоцитов взаимодействовать лишь с собственными клетками, экспрессирующими молекулы МНС, свойственные данному организму - важное условие процесса их активации.
- 226 -
Молекулы CD4 и CD8 служат дополнительными рецепторами (корецепторами) молекул МНС I и II классов, соответственно. Благодаря потребности в комбинированном активационном сигнале предотвращаются возможные реакции как на антиген, который не подвергся необходимому процессингу и представлению, так и на собственные антигены.
Адгезионные молекулы (лиганды) на поверхности Т-лимфоцитов путем своих взаимодействий с добавочными костимулирующими молекулами на поверхности АПК обеспечивают более эффективную активацию Т-лимфоцитов.
Нарушения взаимодействия комплекса МНС/антиген с ТКР, связанные с молекулярными дефектами экспрессии ТКР, дефицитом молекул МНС и коактивационных сигналов обусловливают развитие иммунодефицитных состояний различной тяжести.
Т-хелперы (Тх) играют основную роль в деятельности иммунной системы - распознавании антигена, запуске реакций клеточного и гуморального иммунитета, регуляции взаимодействий Т-лимфоцитов друг с другом и между Т- и В-лимфоцитами, продукции лимфокинов. Основная их функция - стимулирующее (хелперное) влияние на эффекторные клетки. Они экспрессируют на своей поверхности ТКР и молекулу CD4.
Распознавание антигенов и активация Тх. Распознавание комплекса молекулы МНС II класса/антиген, который находится на поверхности АПК (дендритной АПК, макрофага или В-лимфоцита), осуществляется посредством ТКР и CD4 на мембране Тх (рис. 8-2). АПК при этом выделяет ИЛ-1, воздействующий на Тх. Активация Тх, развивающаяся в результате этих сигналов, представляет собой закономерную последовательность, которая включает: (1) активацию фосфолипазы с образованием инозитолтрифосфата и диацилглицерола, (2) повышение уровня внутриклеточного кальция, (3) включение каскада внутриклеточных протеинкиназ, (4) усиление транскрипции генов, кодирующих продукты активации (цитокины и их рецепторы) и (5) пролиферацию соответствующего клона Тх.
Активированные Тх (а) экспрессируют ряд костимулирующих молекул (которые усиливают взаимодействия между клетками) и (б) выделяют лимфокины, регулирующие деятельность макрофагов, Т- и В-клеток.
- 227 -
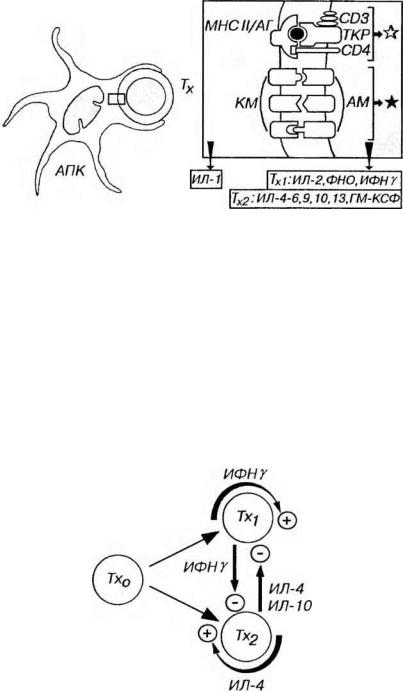
Рис. 8-2. Распознавание антигенов и активация Тх при его взаимодействии с АПК. Эпитоп антигена (АГ) в комплексе с молекулами МНС II класса (МНС II), который находится на поверхности дендритной АПК, распознается посредством ТКР и СD4 на мембране Тх, что обеспечивает главный активационный сигнал (обозначен светлой звездочкой). При этом АПК воздействует на Тх путем выделения ИЛ-1. Более эффективная активация Тх достигается добавочным сигналом (черная звездочка) в результате взаимодействия костимулирующих молекул (КМ) на поверхности АПК с адгезионными молекулами (АМ) на плазмолемме Т-лимфоцитов. При активации Тх выделяют ряд цитокинов, состав которых различается у Тх1, и Тх2.
Рис. 8-3. Развитие Тх и взаимодействие их подклассов. Тх1, и Тх2 развиваются из общего предшественника (Тх0), причем направление развития определяется многочисленными факторами (см. текст). Цитокины, выделяемые Тх каждого подкласса, усиливают образование клеток своего подкласса (стрелки со знаком "+") и угнетают развитие и активность клеток другого подкласса (стрелки со знаком "-").
- 228 -
Подклассы Тх (Тх1 и Тх2) различаются характером цитокинов (лимфокинов), секретируемых при активации, экспрессией некоторых костимулнрующих адгезивных молекул, а также функциональной ролью в различных звеньях иммунитета. Поддержание баланса между подклассами Тх определяет течение и исход инфекционных и аутоиммунных заболеваний (см. ниже). Оно осуществляется благодаря тому, что клетки каждого подкласса:
(1) усиливают дифференцировку "наивных” Т-клеток в данный (свой) подкласс Тх. Основными аутокринными факторами роста служат ИФНγ (для Тх1,) и ИЛ-4 (для Тх2).
(2) угнетают развитие и активность клеток другого подкласса (рис. 8-3). Так, ИФНγ (вырабатываемый Тх,), ингибирует образование Тх2, а ИЛ-4 и (или) ИЛ-10 (продуцируемые Тх2) - тормозят образование Тх,.
Тх1 отвечают преимущественно за реакции клеточного иммунитета и воспаления, частично - за некоторые реакции гуморального иммунитета (связанные с деятельностью фагоцитов). Они выделяют ИЛ-2, ИФНγ, ФНО и экспрессируют рецепторы к ИЛ-2. ИФНγ стимулирует, главным образом, макрофаги; ИЛ-2 усиливает пролиферацию Т-лимфоцитов (Тх и Тк), активирует NК-клетки, Т- и В-лимфоциты. Последние под влиянием ИФНγ переключаются на продукцию комплемент-связывающих и опсонизирующих антител (класса IgG), которые усиливают реакции фагоцитоза. ФНО и ИФНγ, привлекая и активируя гранулоциты, способствуют развитию воспалительных реакций.
Тх2 - стимулируют реакции гуморального иммунитета, участвуют в ряде регуляторных механизмов. Они выделяют ИЛ-4, -5, -6, -9, -10, -13, ГМ-КСФ. За счет действия указанных лимфокинов происходит активация В-лимфоцитов. усиливается их пролиферация и дифференцировка в плазматические клетки, вырабатывающие IgM, IgA, IgB (не связывающие комплемент), а также IgЕ (что стимулирует развитие ал¬ергических реакций). ИЛ-5 усиливает рост и активность эозинофилов, комбинация ИЛ-4 + ИЛ-10 - тучных клеток и базофилов, Регуляторная функция Тх2 связана с тем, что ряд секретируемых ими цитокинов обладает противовоспалительной активностью. Вследствие этого Тх2 угнетают реакции острого и хронического воспаления, включая ГЗТ. Во многих случаях это предотвращает нежелательное повреждение тканей, однако чрезмерная активность Тх2 связана с пониженным иммунитетом по отношению к внутриклеточным микроорганизмам.
Соотношение между Тх1 и Тх2 определяет характер течения и исход различных инфекций (вызванных вирусами, бактериями, гриба-
- 229 -
ми, простейшими и гельминтами), а также аллергических и аутоиммунных заболеваний. Так, при большинстве изученных инфекций человека преобладание Tx1 способствует высокой эффективности клеточных защитных реакций, а нарастание содержания Тх2 часто указывает на неблагоприятное течение заболевания.
Развитие Tx1 и Тх2 осуществляется из общего предшественника (Тх0), причем на его преимущественное направление (поляризацию) влияют многочисленные факторы: (1) концентрация и химическая природа антигена, (2) пути его введения, (3) костимулирующие адгезивные сигналы, полученных от АПК, (4) воздействие цитокинов, выделяемых рядом клеток микроокружения - макрофагами, лимфоцитами, тучными клетками, базофилами и эозинофилами,
(5) генетическая предрасположенность индивидуума.
Относительное содержание Тх в крови в норме у здорового человека составляет около 2/3 циркулирующих Т-лимфоцитов.
Снижение содержания Тх отмечается при различных врожденных и приобретенных иммунодефицитных состояниях. В частности, оно может быть результатом повреждающего действия ВИЧ (проникающего в эти клетки путем прикрепления к молекуле CD4) и характерным признаком СПИДа. Именно внутри Тх образуются более 99% из 1010 новых вирусных частиц, появляющихся в организме ВИЧ-инфицированного ежедневно. Причины возникновения дефицита Тх остается окончательно не выясненными; предполагаемые механизмы включают: 1) непосредственное разрушение Тх вирусом, 2) индукцию вирусом апоптоза Тх, 3) разрушение инфицированных Тх цитотоксическими лимфоцитами. Следствием потери значительной части Тх служит иммунная недостаточность, проявляющаяся в развитии тяжелых инфекций, в частности, вызываемых условно-патогенными микроорганизмами, которые практически безвредны для здорового человека, опухолей (например, саркомы Капоши), неврологических расстройств.
Т-супрессоры (Тс) распознают эпитопы антигенов в комбинации с продуктами системы МНС 1 класса. На их поверхности имеются ТКР и молекулы CD8. Клетками-мишенями Тс являются В-лимфоциты, Тх и Тк (см. ниже). Функция Тс заключается в угнетении активности иммунных реакций путем непосредственного контактного воздействия на указанные клетки или секреции угнетающих (супрессорных) факторов. Тс подавляют развитие аутоиммунных реакций. В последние годы высказывается мнение, согласно которому роль Тс могут играть Тх1 и Тх2, которые вырабатывают ряд цитокинов, способных угнетать активность лимфоцитов и макрофагов.
- 230 -
