- •1Техническая термодинамика
- •Тема 1. Основные термодинамические понятия и законы
- •1.1.Предмет и метод технической термодинамики
- •1.2.Термодинамическая система
- •1.3.Термодинамическое состояние и термодинамический процесс
- •1.4.Термические и калорические параметры состояния
- •1.4.1.Термические параметры состояния
- •1.4.2.Калорические параметры состояния
- •1.6.Уравнение состояния
- •1.7.Работа изменения объёма газа
- •Тема 2. Теплоёмкость газов
- •2.1.Массовая, объёмная и мольная удельные теплоёмкости
- •2.2.Средняя и истинная теплоёмкости
- •2.3.Теплоёмкости при постоянном объёме и давлении
- •2.4. Таблицы теплоёмкости
- •2.5.Теплоёмкость смеси рабочих тел (газовой смеси)
- •Тема 3. Первый закон термодинамики
- •3.1.Сущность первого закона термодинамики
- •3.2. Аналитическое выражение первого закона термодинамики для цикла и разомкнутого процесса
- •3.3. Уравнение первого закона термодинамики для движущегося рабочего тела
- •Тема 4. Термодинамические процессы
- •4.1.Схема анализа изменения состояния рабочего тела
- •4.2.Термодинамические процессы: изохорный, изобарный, изотермический, адиабатный, политропный
- •4.2.4.Адиабатный процесс
- •4.2.5. Политропный процесс
- •Тема 5. Второй закон термодинамики
- •5.1.Сущность и формулировки второго закона термодинамики
- •5.2.Обратимые и необратимые процессы
- •5.3.Круговые термодинамические процессы или циклы
- •5.4.Термический коэффициент полезного действия
- •5.5.Аналитическое выражение второго закона термодинамики
- •5.5.1.Цикл Карно
- •5.5.2.Соотношения, связанные с циклом Карно
- •5.6.Изменение энтропии в обратимых и необратимых процессах
- •Тема 6.Водяной пар
- •6.1.Основные понятия и определения
- •6.2.Схема парогенератора
- •6.3.Процесс парообразования в pv-координатах
- •6.4.Таблицы водяного пара
- •6.6.Процессы водяного пара на is-диаграмме
- •Тема 7. Тепловые двигатели
- •7.1.Классификация и принцип действия поршневых двигателей внутреннего сгорания
- •7.2.Цикл д. В. С. С подводом тепла при постоянном объёме (цикл Отто)
- •7.3.Цикл д. В. С. С подводом тепла при постоянном давлении (цикл Дизеля)
- •Тема 8. Паросиловые установки
- •8.1.Принципиальная схема паросиловой установки
- •8.2.Цикл Ренкина
- •8.3.Влияние параметров пара на термический к. П. Д. Цикла Ренкина
- •8.4.Пути повышения экономичности паросиловых установок
- •Тема 9. Теплопроводность
- •9.1.Основные понятия и определения
- •9.2.Закон Фурье
- •9.3.Коэффициент теплопроводности
- •9.4.Дифференциальное уравнение теплопроводности в плоской стенке при граничных условиях первого рода
- •9.4.1.Дифференциальное уравнение теплопроводности
- •9.4.2.Краевые условия
- •9.4.3.Теплопроводность через плоскую стенку при граничных условиях первого рода
1.4.2.Калорические параметры состояния
К калорическим параметрам состояния относятся, как уже отмечалось, внутренняя энергия U, энтальпия H и энтропия S. Своим названием эти параметры обязаны тому, что ранее измерялись в калориях.
Внутренняя энергия. Любая
термодинамическая система в каждом
состоянии обладает запасом полной
энергии E,
которая состоит из внутренней энергии
U, зависящей от
внутреннего состояния тела, и внешней
энергии
![]() ,
связанной с движением тела как целого
и положением его в каком-либо внешнем
поле сил (например в поле сил тяжести),
т. е.
,
связанной с движением тела как целого
и положением его в каком-либо внешнем
поле сил (например в поле сил тяжести),
т. е.
|
Если тело не движется, а влиянием внешнего поля сил можно пренебречь, то полная энергия будет представлять собой только внутреннюю энергию.
Любая термодинамическая система (рабочее тело) обладает запасом внутренней энергии, которая состоит из энергии хаотического (теплового) движения и взаимодействия молекул. Поскольку внутренняя энергия рабочего тела зависит от его массы, обычно интересуются значением внутренней энергии, отнесенной к 1 кг массы тела, т.е. удельной внутренней энергией
|
В общем случае удельная кинетическая энергия теплового движения состоит из удельной кинетической энергии поступательного, вращательного и колебательного движений молекул, зависящей только от температуры рабочего тела, и удельной потенциальной энергии взаимодействия молекул между собой, которая, в свою очередь, зависит от среднего расстояния между молекулами, т. е. от занимаемого рабочим телом объёма. Следовательно, в общем случае удельная внутренняя энергия рабочего тела зависит от его температуры Т и удельного объема v являясь однозначной функцией этих параметров состояния: u = f(T,v) или
|
Таким образом, важнейшим свойством
удельной внутренней энергии рабочего
тела является то, что она представляет
собой однозначную функцию состояния
тела, определяемого любой парой его
основных параметров (
![]() ,
,
![]() ,
,
![]() ),
и сама может служить параметром состояния.
Из этого свойства следует, что изменение
удельной внутренней энергии не зависит
от характера процесса, а определяется
лишь начальным и конечным состояниями
рабочего тела. Следовательно, бесконечно
малое приращение удельной внутренней
энергии является полным дифференциалом
du.
),
и сама может служить параметром состояния.
Из этого свойства следует, что изменение
удельной внутренней энергии не зависит
от характера процесса, а определяется
лишь начальным и конечным состояниями
рабочего тела. Следовательно, бесконечно
малое приращение удельной внутренней
энергии является полным дифференциалом
du.
В идеальном газе силы взаимодействия
между молекулами отсутствуют и удельная
потенциальная энергия его равна нулю.
Поэтому удельная внутренняя энергия
идеального газа состоит только из
удельной кинетической энергии движения
молекул
![]() и
определяется его температурой:
и
определяется его температурой:
![]() ,
или
,
или
|
В замкнутом (круговом) процессе, в котором начальное и конечное состояния совпадают, изменение удельной внутренней энергии равно нулю.
Определять абсолютное значение удельной внутренней энергии в большинстве технических расчетов не требуется, так как обычно необходимо знать только ее изменение. Поэтому условно приписывают некоторому состоянию рабочего тела нулевое значение удельной внутренней энергии, а все расчеты ведут относительно этого значения.
Энтальпия. Рассмотрим полную энергию
газа, находящегося под давлением
,
создаваемым грузом массой
![]() (рис.
1.1). В этом случае полная энергия
(рис.
1.1). В этом случае полная энергия
![]() системы
состоит из внутренней энергии газа
системы
состоит из внутренней энергии газа
![]() и
потенциальной энергии груза, равной
и
потенциальной энергии груза, равной
![]() ,
где
,
где
![]() -
площадь поперечного сечения поршня. Т.
е.
-
площадь поперечного сечения поршня. Т.
е.
![]() .
Величина
.
Величина
![]() ,
зависящая от сил, действующих на поршень,
получила название потенциальной
энергии давления.
,
зависящая от сил, действующих на поршень,
получила название потенциальной
энергии давления.
|
Рис. 1.1. К определению энтальпии газа |
h=u+Pv. |
Следовательно, удельная энтальпия,
будучи зависимой от параметров состояния
![]() ,
и
,
также является параметром состояния.
Поэтому изменение ∆h, как
и изменение ∆, не зависит
от характера процесса, а определяется
только начальным и конечным состояниями,
т. е.
,
и
,
также является параметром состояния.
Поэтому изменение ∆h, как
и изменение ∆, не зависит
от характера процесса, а определяется
только начальным и конечным состояниями,
т. е.
h2-h1 = u2 +P2v2 – u1-P1v1 |
Как однозначная функция состояния удельная энтальпия может быть представлена в виде функции любой пары основных параметров состояния.
Удельная энтальпия идеального газа, как и его удельная внутренняя энергия, является функцией только температуры. Действительно:
h= u + Pv = u(T) + RT. |
Удельная энтальпия, как и удельная внутренняя энергия, выражается в джоулях на килограмм (Дж/кг).
Энтропия. Кроме рассмотренных
параметров, в термодинамике широко
используется еще один калорический
параметр состояния — энтропия
![]() ,
введенный Клаузиусом в 1865 г. при анализе
круговых процессов.
,
введенный Клаузиусом в 1865 г. при анализе
круговых процессов.
Энтропия — параметр состояния,
дифференциал которого равен отношению
бесконечно малого количества теплоты
![]() в
элементарном обратимом процессе к
абсолютной температуре
,
постоянной на бесконечно малом участке
процесса, т.е.
в
элементарном обратимом процессе к
абсолютной температуре
,
постоянной на бесконечно малом участке
процесса, т.е.
|
Если количество теплоты отнести к 1 кг
вещества (![]() ),
то получим удельную энтропию
),
то получим удельную энтропию
|
которая выражается в джоулях на килограмм-кельвин [Дж/(кг • К)].
1.5.Законы идеальных газов
1.5.1.Закон Бойля-Мариота
Бойль в 1662 году и Мариот в 1676 году
обнаружили, что при
![]()
![]() .
.
1.5.2.Закон Гей-Люссака
Гей-Люссак в 1802 году опытным путём
установил, что при
![]() , v/T
= const.
, v/T
= const.
1.5.3.Закон Авогадро
В 1811 году Авогадро выдвинул гипотезу:
одинаковые объёмы различных газов при
одинаковых физических условиях содержат
одинаковые количества молекул. Эта
гипотеза, став после её доказательства
законом, приводит к одному важному
следствию, согласно которому при
одинаковых физических условиях для
любых газов произведение молекулярной
массы газа на его удельный объём есть
величина постоянная, т. е.
![]() .
.
Напомним, что молекулярной массой называется количество вещества в граммах, численно равное его молекулярной массе. Например, молекулярная масса углерода равна 12 граммам, а кислорода - 32 граммам.
Произведение
![]() представляет
собой объём одного моля газа, который
при нормальных физических условиях
равен 22,4 м3.
представляет
собой объём одного моля газа, который
при нормальных физических условиях
равен 22,4 м3.
Отметим, что нормальным физическим условиям соответствуют 760 мм рт. ст. и 00С, а нормальным техническим условиям - 735 мм рт. ст. и 100С.

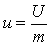 .
.
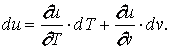 .
.