
- •1Техническая термодинамика
- •Тема 1. Основные термодинамические понятия и законы
- •1.1.Предмет и метод технической термодинамики
- •1.2.Термодинамическая система
- •1.3.Термодинамическое состояние и термодинамический процесс
- •1.4.Термические и калорические параметры состояния
- •1.4.1.Термические параметры состояния
- •1.4.2.Калорические параметры состояния
- •1.6.Уравнение состояния
- •1.7.Работа изменения объёма газа
- •Тема 2. Теплоёмкость газов
- •2.1.Массовая, объёмная и мольная удельные теплоёмкости
- •2.2.Средняя и истинная теплоёмкости
- •2.3.Теплоёмкости при постоянном объёме и давлении
- •2.4. Таблицы теплоёмкости
- •2.5.Теплоёмкость смеси рабочих тел (газовой смеси)
- •Тема 3. Первый закон термодинамики
- •3.1.Сущность первого закона термодинамики
- •3.2. Аналитическое выражение первого закона термодинамики для цикла и разомкнутого процесса
- •3.3. Уравнение первого закона термодинамики для движущегося рабочего тела
- •Тема 4. Термодинамические процессы
- •4.1.Схема анализа изменения состояния рабочего тела
- •4.2.Термодинамические процессы: изохорный, изобарный, изотермический, адиабатный, политропный
- •4.2.4.Адиабатный процесс
- •4.2.5. Политропный процесс
- •Тема 5. Второй закон термодинамики
- •5.1.Сущность и формулировки второго закона термодинамики
- •5.2.Обратимые и необратимые процессы
- •5.3.Круговые термодинамические процессы или циклы
- •5.4.Термический коэффициент полезного действия
- •5.5.Аналитическое выражение второго закона термодинамики
- •5.5.1.Цикл Карно
- •5.5.2.Соотношения, связанные с циклом Карно
- •5.6.Изменение энтропии в обратимых и необратимых процессах
- •Тема 6.Водяной пар
- •6.1.Основные понятия и определения
- •6.2.Схема парогенератора
- •6.3.Процесс парообразования в pv-координатах
- •6.4.Таблицы водяного пара
- •6.6.Процессы водяного пара на is-диаграмме
- •Тема 7. Тепловые двигатели
- •7.1.Классификация и принцип действия поршневых двигателей внутреннего сгорания
- •7.2.Цикл д. В. С. С подводом тепла при постоянном объёме (цикл Отто)
- •7.3.Цикл д. В. С. С подводом тепла при постоянном давлении (цикл Дизеля)
- •Тема 8. Паросиловые установки
- •8.1.Принципиальная схема паросиловой установки
- •8.2.Цикл Ренкина
- •8.3.Влияние параметров пара на термический к. П. Д. Цикла Ренкина
- •8.4.Пути повышения экономичности паросиловых установок
- •Тема 9. Теплопроводность
- •9.1.Основные понятия и определения
- •9.2.Закон Фурье
- •9.3.Коэффициент теплопроводности
- •9.4.Дифференциальное уравнение теплопроводности в плоской стенке при граничных условиях первого рода
- •9.4.1.Дифференциальное уравнение теплопроводности
- •9.4.2.Краевые условия
- •9.4.3.Теплопроводность через плоскую стенку при граничных условиях первого рода
4.2.4.Адиабатный процесс
Адиабатный процесс – это процесс, при котором рабочее тело не обменивается теплотой с окружающей средой (dq=0). Для получения графика процесса в p-v координатах выполним некоторые преобразования.
В соответствии с первым законом термодинамики dq=cv·dT+p·dv=c·dT, где с – теплоёмкость термодинамического процесса. Тогда можно записать, что
|
(4.15) |
Продифференцируем уравнение состояния идеального газа и запишем
|
(4.16) |
Так как R=cp-cv, то выражение (4.15) можно переписать с учётом (4.16) следующим образом:
|
(4.17) |
Выполним преобразования выражения (4.17).
|
|
|
|
|
(4.18) |
Разделим выражение (4.18) на (cv-c)·p·v и получим:
|
(4.19) |
Обозначим
 ,
тогда
,
тогда
|
|
|
|
|
|
|
|
|
|
Следовательно
|
(4.20) |
В адиабатном процессе dq=0, то есть
c·dT=0. Поэтому c=0. Значит в
адиабатном процессе
 .
Эту величину принято обозначать буквой
.
Эту величину принято обозначать буквой
![]() и
называть показателем адиабаты.
и
называть показателем адиабаты.
Поэтому в p-v координатах адиабатный процесс изображается неравнобокой гиперболой vk·p=const (рис. 4.4). Так как k>1, то адиабата проходит круче гиперболы. Адиабатный процесс может протекать как с увеличением объёма (процесс 1-2), так и с уменьшением объёма (процесс 1-2’).
|
|
Рис. 4.4. График адиабатного процесса в p-v координатах |
|
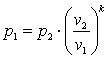 ,
,  ,
,
 .
.
Приращение внутренней энергии газа ![]() .
.
Так как
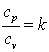 ,
а
,
а
![]() ,
то
,
то
 ,
а
,
а
 .
Поэтому
.
Поэтому
|
(4.21) |
Работа газа в адиабатном процессе выполняется за счёт его внутренней энергии. Так как в адиабатном процессе отсутствует обмен теплотой с окружающей средой, то в соответствии с первым законом термодинамики имеем l+Δu=0 или l=-Δu. Поэтому
|
|
|
(4.22) |
Изменение энтальпии газа в адиабатном процессе может быть определено исходя из следующих соображений:
|
|
Так как
 ,
то в итоге получим
,
то в итоге получим
|
(4.23) |
Энтропия газа в адиабатном процессе не изменяется, так как dq=0. Поэтому в T-s координатах адиабатный процесс изображается прямой линией, параллельной оси температур.
4.2.5. Политропный процесс
Политропным процессом называется любой произвольный процесс изменения состояния рабочего тела, происходящий при постоянной теплоёмкости сп.
В политропном процессе dq=cп·dT.
Для получения графика политропного
процесса в p-v координатах будем
придерживаться тех же рассуждений, что
и при получении графика адиабатного
процесса. Заменим в соотношениях,
полученных при изучении адиабатного
процесса, обозначение теплоёмкости с
на сп и обнаружим, что
p·vn=const, а
 .
В дальнейшем всё, что написано об
адиабатном процессе, можно распространить
на описание политропного процесса,
заменяя в выражениях k на n.
.
В дальнейшем всё, что написано об
адиабатном процессе, можно распространить
на описание политропного процесса,
заменяя в выражениях k на n.
Покажем, что адиабатный процесс делит все процессы на две группы: на процессы, в которых теплоёмкость больше нуля, и на процессы, в которых теплоёмкость меньше нуля.
Так как , то можно записать
![]() ;
;
![]() ;
;
![]() ;
;
 .
.
Из последнего выражения видно, что при n>k cп>0, а при k>n>1 cп<0.
В заключение отметим, что все рассмотренные ранее процессы – это частные случаи политропного процесса.
При n=k имеем адиабатный процесс.
При n=0 имеем р1·v10=р2·v20, то есть изобарный процесс (p1=p2).
При n=1 имеем р1·v1= р2·v2, то есть изотермический процесс.
При n=∞ имеем
![]() или
или
 ,
что равносильно
,
что равносильно
![]() или
или
![]() ,
то есть изохорный процесс.
,
то есть изохорный процесс.











