
2039
.pdf
30. Оптическая сила тонкой линзы |
D = ( |
n |
−1) ( |
1 |
+ |
1 |
), |
|||
n |
R |
1 |
R |
2 |
||||||
|
|
|
|
|
||||||
|
0 |
|
|
|
|
|
||||
где n – показатель преломления вещества внутри линзы; n0 – показатель преломления вещества, окружающего линзу; R1 и R2 – радиусы кривизны поверхностей, ограничивающих линзу.
D = D1 + D2 + … .
cos θ = ncυ , где θ – угол между направлениями распространения излучения и вектором скорости υ частицы; n – показатель преломления среды.
33. Закон Брюстера tg αБ = n2−1 ,
где αБ – угол Брюстера – угол падения, при котором электромагнитная волна, отражённая от диэлектрика, полностью поляризована.
34. Закон изменения интенсивности поляризованного света I,
проходящего через анализатор при вращении его главной
плоскости, (закон Малюса) |
I = I cos2 |
φ, |
|
0 |
|
где I0 – интенсивность плоскополяризованного света, падающего на анализатор; φ – угол между плоскостью поляризации падающего света и главной плоскостью анализатора.
35. |
Взаимосвязь разности фаз δ и разности хода |
δ = |
2 π |
, |
||
|
|
|
||||
λ |
|
|||||
где |
= L2 – L1 – оптическая разность хода; L1 = n1·l1; |
L2 |
= |
n2·l2 – |
||
оптические длины пути в однородных средах с показателями преломления n1 и n2; l1 и l2 – геометрические длины пути.
36. Условия максимального усиления колебаний:
разность фаз δ = ±2π∙m; разность хода = m λ ,
где λ − длина волны; m − порядок (номер) максимума или минимума. 37. Условия максимального ослабления колебаний:
|
разность фаз δ=±(2∙m+1)π; |
|||
|
|
λ |
||
|
разность хода |
Δ=(2 m +1) 2 ; m N. |
||
38. |
Координаты максимумов при интерференции волн от двух |
|||
источников |
ym =±m |
Lλ |
, |
|
|
||||
|
|
|
d |
|
где |
m – порядок максимума; L – расстояние от источников до экрана; |
|||
d – расстояние между источниками. |
|
|
|
|
30

39.Разность хода волн, отражённых от плёнки,
= 2 d √n2−n1 sin2 α + g λ20 ,
где d и n – толщина и показатель преломления плёнки; α – угол падения; n1 – показатель преломления среды, из которой волна падает на плёнку; g – число отражений от более плотной среды; λ0 – длина волны в вакууме. (Если g – число чётное, то слагаемое, содержащее λ0/2, можно отбросить).
|
|
|
|
|
40. Радиусы зон Френеля |
rm ≈ √m λ |
r0 b |
, |
|
r0 + b |
||||
где m – номер зоны; λ – длина волны; r0 – радиус сферической волновой поверхности; b – кратчайшее расстояние от волновой поверхности до точки, где рассматривается результат дифракции.
41.Условие минимумов при дифракции на щели а sin φ=±m λ ,
где а – ширина щели; φ – угол дифракции (угол между нормалью к решётке и направлением на минимум m-го порядка; m = 1, 2, 3, …).
42.Условие главных максимумов при дифракции на решётке
d sinφ = ±m λ ,
где d – период дифракционной решётки; φ – угол между направлением луча, падающего на решётку, и направлением на максимум m-го порядка (угол дифракции); m = 0, 1, 2, 3, …
43. Разрешающая сила дифракционной решётки |
R =m N , |
|||||||
где m – порядок максимума; N – общее число штрихов решётки. |
|
|||||||
44. Акустические величины и их единицы: |
|
N зв |
|
|||||
Интенсивность звука I |
|
W |
I = |
|
||||
= |
|
(определение) или |
|
, |
где |
|||
S t |
||||||||
S |
||||||||
I – интенсивность, Вт/м2; |
W – энергия звуковой |
волны, |
Дж; |
|||||
S – площадь поверхности, |
перпендикулярной распространению |
|||||||
волны, м2; Nзв – мощность источника звука, Вт; t – время, с. |
|
|||||||
Уровень интенсивности |
L=lg I /I 0 , где L – уровень интенсивно- |
|||||||
сти, Б; I – интенсивность звука Вт/м2; I0 = 10-12 Вт/м2 – порог слышимости; 1Б = 10 дБ. Уровню интенсивности L = 1 дБ на частоте звука 1 кГц соответствует уровень громкости L* = 1 фон.
45. Фотометрические величины и единицы:
Световой поток Ф = Jω, где Ф – световой поток; J – сила света; ω – телесный угол; [Ф] = лм; [J ]=кд; [ω] = ср.
31

Яркость B = J /σ┴ (определение), где J – сила света; σ┴=S cosφ;
σ – площадь проекции светящейся поверхности на плоскость, перпендикулярную направлению наблюдения; S – площадь светящейся поверхности; φ – угол между нормалью к светящейся
поверхности и направлением наблюдения; |
[В] = кд/м2 . |
||||||
Светимость R = Физл /Sизл (определение), |
где [R] = лм/м2; Физл – |
||||||
поток света, излучаемого с поверхности площадью Sизл . |
|
||||||
Взаимосвязь светимости и яркости: R = π B . |
|
||||||
Освещённость E= |
Фпад |
(определение); |
E= |
J cosα |
|
(закон), |
|
r2 |
|||||||
|
|||||||
|
S |
|
|
||||
где S – площадь поверхности, на которую направлен поток света Фпад; J – сила света; r – расстояние от источника до поверхности, на
которую падает свет; α – угол падения света; |
[Е ]= лк. |
|
|
|
||
|
4. КВАНТОВАЯ ФИЗИКА |
|
|
|
||
|
Основные законы и соотношения величин |
|
|
|
||
|
квантовой физики |
|
c |
|||
1. |
Энергия кванта излучения |
ε = h ν , или |
ε = h |
|||
|
, |
|||||
λ |
||||||
где |
h – постоянная Планка; ν – частота электромагнитного излучения; с – |
|||||
скорость света; λ – длина электромагнитной волны. |
|
|
|
|||
2. |
Импульс фотона |
p = ε/c, или p = h/λ . |
||||
3.Уравнение Эйнштейна для внешнего фотоэффекта hν=Aв+Ке ,
Aв – работа выхода электрона из вещества; Ке – кинетическая энергия фотоэлектрона (электрона, вылетевшего в результате фотоэффекта).
4. Изменение длины волны электромагнитного излучения при
рассеянии его свободными электронами или нуклонами
(эффект Комптона) Δλ = λ'–λ= |
h |
(1−cosθ), или |
Δλ = |
2 h |
sin2 θ |
, |
|
me c |
me c |
||||||
|
|
|
2 |
|
где θ – угол рассеяния; me – масса электрона; λ' – длина волны рассеянного излучения.
p = cI (1+ ρ),
где I = W пад /(S t) – интенсивность падающего излучения (облучённость поверхности), с – скорость света в вакууме; S – площадь поверхности; t – время; ρ – коэффициент отражения.
32
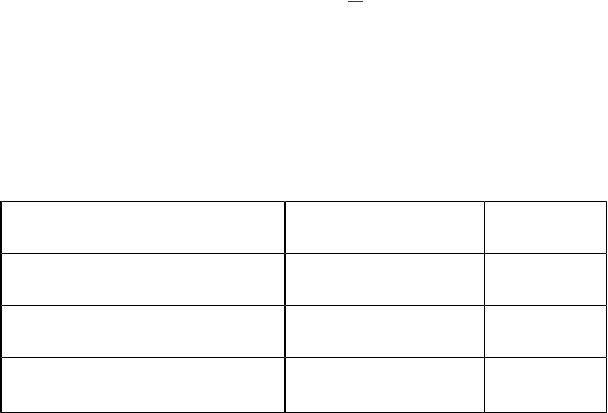
6.Первый постулат Бора (правило квантования момента импульса
электрона в атоме) |
Le = n· , =h/(2π); n = 1, 2, 3,… , ∞ . |
|
7. Второй постулат Бора (правило частот) |
h ν = Ei−E f , |
|
где Ei и Ef – энергии атома в начальном и конечном состояниях.
8.Сериальные формулы для спектров водорода и спектров
водородоподобных ионов: |
1 |
=Rλ( |
1 |
− |
1 |
) |
и |
1 |
=Rλ Z 2( |
1 |
− |
1 |
), |
λ |
|
|
λ |
|
|
||||||||
|
|
n2f |
ni2 |
|
|
n2f |
ni2 |
||||||
где λ – длина волны излучения при переходе с уровня ni на уровень nf (ni > nf); Rλ – постоянная Ридберга; Z – порядковый номер элемента в таблице Д.И. Менделеева.
9.Энергия атома водорода и водородоподобных ионов
W n=hc Rλ Z2 /n2 , где n – номер энергетического уровня; с – скорость света в вакууме.
10.Сериальная формула для характеристического рентгенов-
ского излучения |
1 |
=Rλ(Z −σ)2 ( |
1 |
− |
1 |
), |
λ |
|
|
||||
|
|
n2f |
ni2 |
|||
где σ – постоянная экранирования; ni и nf -- номера электронных оболочек, переход между которыми сопровождается излучением рент-
λ.
11.Граница сплошного спектра тормозного рентгеновскогоh cгеновского кванта с энергией ε h
излучения |
νгр=e U уск /h, |
где νгр – наибольшая частота |
излучения; е – заряд электрона; Uуск – |
ускоряющее напряжение. |
|
Определяющие формулы и единицы величин в теории теплового излучения
Таблица 6
Энергетическая светимость |
|
R |
= |
W изл |
|
|
Вт |
||||||
|
|
S t |
|
|
|
м2 |
|||||||
Спектральная плотность |
r ν= |
dR |
, |
|
или r λ |
= |
dR |
Вт |
|||||
энергетической светимости |
d ν |
|
d λ |
м3 |
|||||||||
|
|
|
|
|
|
|
|
|
|
||||
Интегральная поглощательная |
|
aТ = |
|
R |
|
|
1 |
||||||
способность |
|
|
R |
ч.т |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||
Спектральная поглощательная |
aλ = |
|
d W λ погл |
|
|
1 |
|||||||
способность |
|
|
|
|
|||||||||
|
d W λ пад |
|
|
||||||||||
33

12. Энергия теплового излучения Wизл = R∙S∙t,
где R – энергетическая светимость тела, излучающего за счёт своей внутренней энергии; S – площадь излучающей поверхности; t – время.
13. Первый закон Вина (закон смещения) |
λm = |
b1 |
, |
|
T |
||||
|
|
|
где λm – длина волны, на которую приходится максимум распределения по спектру энергии теплового излучения при температуре Т; b1 – постоянная Вина, b1 = 2,898∙10-3 м∙К .
14. Второй закон Вина rλ,m = b2∙Т 5, где rλ,m – максимальная спектральная плотность энергетической светимости чёрного тела при температуре Т; b2 = 1,30∙10-5 Вт∙м-3∙К-5 .
15. Зависимость энергетической светимости от температуры
(закон Стефана – Больцмана) |
R=a σ T 4 |
, |
|
T |
|
где aT – интегральная поглощательная способность тела (степень черноты); σ – постоянная Стефана – Больцмана.
16. Длина волны де Бройля |
|
|
|
|
|
λБ |
= |
h |
, |
||
|
|
|
|
p |
|||||||
|
|
|
|
|
|
m υ |
|
|
|
|
|
где h – постоянная Планка; р – импульс частицы; p = |
|
|
|
. |
|
||||||
√ |
|
|
|
||||||||
1−υ2/c2 |
|
||||||||||
17. Соотношения неопределённостей5: |
|
|
|
|
|
|
|
|
|
|
|
px ∙ x ≥ /2 и |
|
E ∙ t ≥ /2, |
|||||||||
где рх = m·Δυx – неопределённость импульса частицы, Δυx и |
|
|
x |
– |
|||||||
неопределённости скорости и координаты; |
Е и |
t – неопределён- |
|||||||||
ности энергии и времени соответственно; |
= |
h |
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
2π |
|
|
|
|
|
|
|
|
|
18.Стационарное одномерное уравнение Шрёдингера для
частицы в потенциальном поле |
d 2 ψ |
+ |
2 m |
(W + Π( x)) ψ=0 , |
|
dx2 |
|
2 |
|
где ψ – волновая функция; m – масса частицы; W и П – полная и потенциальная энергии частицы.
19. |
Вероятность нахождения частицы |
x2 |
|
в интервале координат от х1 до х2 |
|||
Р = ∫ ψ(x) 2 dx , |
|||
где |
ψ(x) 2 – квадрат модуля волновой функции. |
x1 |
|
|
|||
5 В учебной литературе встречаются варианты записи правой части соотношений неопределённостей, отличающиеся множителем при постоянной Планка.
34
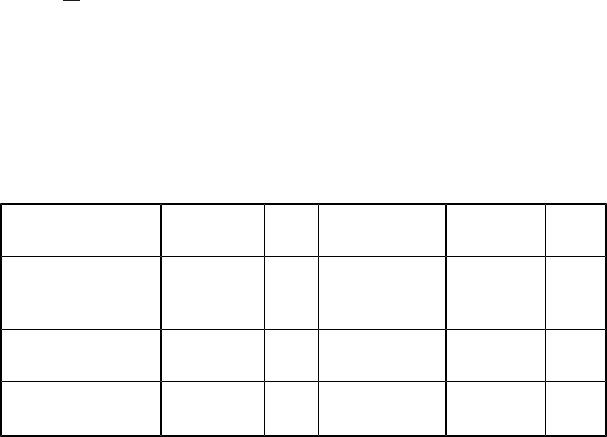
20. Собственная энергия и собственная волновая функция
частицы в прямоугольной потенциальной яме с бесконечно
высокими стенками |
W |
|
= |
h2 |
n2 |
и |
ψn( x) = Asin |
π x n |
, |
|
|
||||||||
|
|
||||||||
|
|
n |
|
8m ℓ2 |
|
|
ℓ |
||
где m – масса частицы; ℓ – |
ширина ямы; x – координата частицы; |
||||||||
n = 1, 2, 3, ... – главное квантовое число (номер уровня энергии);
2 |
|
A = √ℓ |
– постоянная, определяемая из условия нормировки. |
21. Изменение орбитального квантового числа ℓ при излучении или поглощении фотона атомом (правило отбора) Δℓ = ±1.
Определяющие формулы и единицы величин в физике атомного ядра
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 7 |
Вероятность |
P = |
|
N |
|
– |
Удельная |
am = |
A |
|
Бк/кг |
||
распада ядра |
|
N 0 |
активность |
m |
|
|||||||
|
|
|
|
|
|
|
|
|||||
Активность |
A = dN |
|
|
|
Объёмная |
aV |
|
A |
|
|
||
образца |
|
Бк |
= |
|
Бк/м3 |
|||||||
V |
|
|||||||||||
(скорость распада) |
|
|
dt |
|
|
|
активность |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Поглощённая доза |
D = |
W изл |
Гр |
m |
|||
Мощность |
|
dD |
|
|
|
||
поглощённой дозы |
Ď = dt |
Гр/c |
|
Эквивалентная |
Н =ОБЭ D |
Зв |
||
доза |
|
|
|
|
Удельная |
ε = Есв |
Дж |
||
энергия связи |
св |
Аат |
|
нуклон |
|
||||
Основные законы и соотношения величин ядерной физики
22. Закон радиоактивности N =N 0 e−λ t ,
где N0 – начальное число радиоактивных атомов; N – их число в момент времени t; λ – постоянная величина, характеризующая скорость распада атомов данного изотопа (постоянная распада),
λ = ln 2 ; T½ – период полураспада – время, за которое количество
T 1/2
радиоактивных атомов уменьшается вдвое.
23. Число ядер, распавшихся за данный промежуток времени
времени N = N0 – N, или N = Р ·N0, где Р – вероятность распада отдельного ядра; N0 – начальное
число радиоактивных ядер.
35
24. Зависимость активности от времени |
A=λ N e−λt =A e−λt . |
||
|
|
0 |
0 |
25. |
Условие радиоактивного равновесия А = А' , или |
λ·N = λ'·N' , |
|
где λ и λ' − постоянные распада; Т и Т' – периоды полураспада; N и N' |
|||
− числа ядер материнского и дочернего изотопов соответственно. |
|||
26. |
Энергия связи атомного ядра |
|
Wсв = m∙c2, |
где |
m = Z mp +( А−Z ) mn−mя – дефект массы; Z – номер элемента |
||
в периодической таблице (число протонов в ядре, зарядовое число); A – относительная атомная масса (число нуклонов в ядре, массовое число); mp – масса протона; mn – масса нейтрона; с – скорость света в вакууме; mя – масса ядра.
27.Формула для практических расчётов энергии связи ядра
W св=931,494 [Z mН +( А−Z ) mn−mат],
где Wсв – энергия связи, МэВ; mН – масса атома водорода, а.е.м.; mn – масса нейтрона, а.е.м; mат – масса атома, а.е.м. (см. прил. 6).
28. Законы сохранения, используемые при идентификации
продуктов ядерных реакций:
а) |
зарядового числа |
Z1+ Z2 = Z3+ Z4; |
б) |
числа нуклонов (массового числа) |
А1+ А2 = А3+ А4; |
в) |
релятивистской полной энергии |
E1+ E2 = E3+ E4; |
г) |
импульса |
р1+ р2 = р3+ р4 , |
где величины в левой части каждого из приведённых уравнений характеризуют частицы до реакции, в правой части – после реакции.
29. |
Энергетический эффект ядерной реакции |
Qр = mр∙c2, |
|
где Qр |
– освобождаемая энергия; mр – разность масс частиц до и |
||
после реакции; с – скорость света в вакууме. |
|
||
30. |
Формула для практических расчётов энергии ядерной реакции |
||
|
Qр |
|
Qр = 931,494·Δmр, |
где |
– энергия, освобождаемая в результате реакции, МэВ; |
||
mр – |
разность масс частиц, участвующих в реакции, до и после |
||
реакции, а.е.м. |
|
||
36
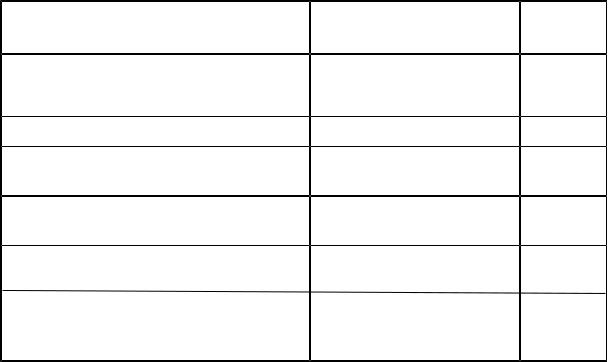
5. СТАТИСТИЧЕСКАЯ ФИЗИКА И ТЕРМОДИНАМИКА
Определяющие формулы и единицы величин в молекулярно-кинетической теории и термодинамике
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 8 |
||||
Концентрация молекул |
|
n = |
N |
|
|
|
|
|
|
|
м−3 |
|||||
|
V |
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
υкв =√ |
|
|
|
|
|
|
|
|
|
|
||||
Средняя квадратическая |
|
υ2 |
|
|
|
м/c |
||||||||||
скорость молекул |
υкв=(υ12 + υ22 + ...+ υN2 )/ N |
|
|
|||||||||||||
|
|
|
|
|
||||||||||||
Внутренняя энергия идеального газа |
|
U = ε N |
|
|
|
Дж |
||||||||||
Теплоёмкость тела |
|
Cт = |
δ Q |
|
|
|
Дж |
|||||||||
|
|
|
|
|
|
dT |
|
|
|
К |
||||||
Молярная теплоёмкость |
|
C = |
|
|
δ Q |
|
|
|
|
Дж |
|
|||||
|
ν dT |
|
моль К |
|||||||||||||
|
|
|
|
|
||||||||||||
Удельная теплоёмкость |
|
c = |
|
δ Q |
|
|
|
|
Дж |
|
||||||
|
m dT |
|
|
кг К |
||||||||||||
|
|
|
|
|
||||||||||||
|
dS = |
δ Q |
|
|
S=∫ |
δ Q |
|
|
Дж |
|||||||
|
|
|
|
|
|
|
|
|||||||||
Изменение энтропии |
T => |
|
|
T |
|
|
К |
|||||||||
Основные законы и соотношения величин
вМКТ и термодинамике
1.Уравнение молекулярно-кинетической теории (МКТ)
идеального газа |
|
|
p = 1 n m0 υ2 , или |
p = |
2 |
n εпост , |
|
|
|
||||
|
|
|
3 |
3 |
|
|
где p – давление газа; m0 – масса одной молекулы; |
υ2 – средний |
|||||
квадрат скорости; |
ε |
пост |
= m υ2 /2 – средняя кинетическая энергия |
|||
|
|
0 |
|
|
|
|
поступательного движения молекул; n – концентрация молекул.
2. Распределение молекул по скоростям (распределение Максвелла
для модулей скоростей) |
2 |
m |
3/ 2 |
− |
m0 υ2 |
|
|
|
|||
|
|
|
|
||||||||
|
|
0 |
|
|
2kT |
|
|
|
|||
f (υ) = 4πυ ( |
2 π kT ) e |
, |
|
||||||||
|
|
|
|
|
|
||||||
где f (υ) = |
dN υ |
– функция распределения, |
а |
f (υ) d |
υ = |
|
dN υ |
– |
|||
N d υ |
|
N |
|||||||||
|
|
|
|
|
|
|
|
|
|
||
относительное число молекул, скорости которых находятся в промежутке от υ до υ + dυ.
37
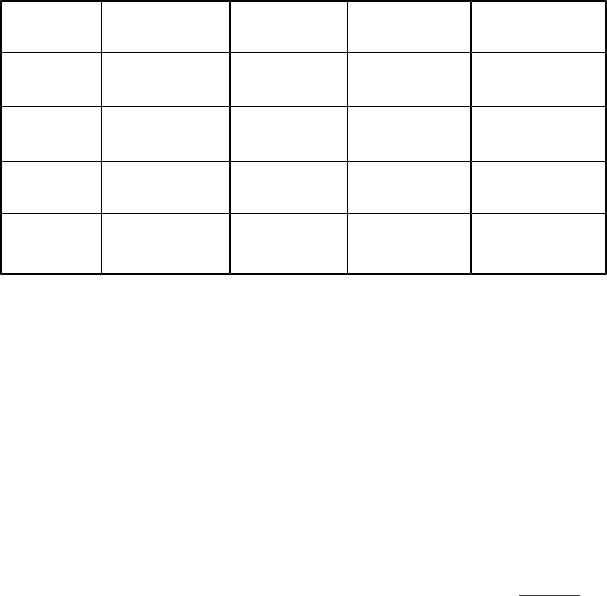
|
|
|
|
|
|
|
|
|
|
|
|
3. Скорости молекул в газе: |
υкв=√ |
3 RT |
, |
υ =√ |
8 RT |
, |
в = |
2 RT |
, |
||
M |
πM |
M |
|||||||||
где υкв=√ |
υ2 |
– средняя |
квадратичная |
скорость; |
υ |
– средняя |
|||||
арифметическая скорость; υв – наиболее вероятная скорость; R – молярная газовая постоянная; М – молярная масса; T – температура.
4. Длина свободного пробега молекул в газе |
l = |
|
|
1 |
|
|
|
, |
|||||||||||
√ |
|
π d2 n |
|||||||||||||||||
2 |
|||||||||||||||||||
где d – эффективный диаметр молекул. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
5. Уравнения переноса |
|
|
|
|
|
|
|
Таблица 9 |
|||||||||||
|
Диффузия |
|
Теплопро- |
Динамическая |
Электро- |
|
|
|
|
||||||||||
|
|
водность |
вязкость |
|
проводность |
|
|
||||||||||||
|
|
|
|
|
|
|
|||||||||||||
|
|
d ρ |
dT |
du |
|
|
|
|
|
|
d φ |
|
|
|
|||||
Уравнение |
m = D |
|
S t |
Q = λdx S t |
F = ηdx |
S |
I = γ |
|
|
|
|
S |
|||||||
dx |
dx |
|
|||||||||||||||||
Что |
Масса |
|
Внутренняя |
Импульс |
|
Электрический |
|||||||||||||
переносится вещества |
|
энергия |
|
заряд |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
Условие |
Градиент |
|
Градиент |
Градиент |
|
Градиент |
|
|
|
|
|||||||||
плотности |
|
температуры |
скорости |
|
потенциала |
|
|
||||||||||||
|
|
|
|
|
|||||||||||||||
Коэффи- |
D = ⅓υl |
λ=⅓cV ρ υ η=⅓ρ υl |
γ=½ |
q02 |
|
|
n |
l |
|||||||||||
циент |
m0 υ |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
6. Уравнение состояния идеального газа |
|
p V = νR T , |
|||||||||||||||||
где р, V и T – параметры состояния: давление, объём и температура |
|||||||||||||||||||
соответственно; R – молярная газовая постоянная, ν – количество |
|||||||||||||||||||
вещества, |
ν=N / N A , |
или |
ν=m/M ; |
N – число молекул газа; NA – |
|||||||||||||||
постоянная Авогадро (число молекул, которое содержит вещество в количестве ν = 1 моль); m – масса газа; М – молярная масса.
7. |
Молярная масса смеси газов |
M см = mсм / νсм , |
|
где |
νсм = ν1 + ν2 + ... . – количество вещества смеси. |
||
8. |
Давление смеси газов (закон Дальтона) |
pсм= p1 + p2 + ... , |
|
где |
p1, р2, … – парциальные давления, т. е. |
давления, оказываемые |
|
каждым из компонентов смеси, если ему предоставить весь объём.
p = p0 exp(− m0 g h ), kT
где р – атмосферное давление на высоте h; p0 – давление у поверхности планеты (h0 = 0); m0 – масса молекулы газа; g – ускорение свободного падения; k – постоянная Больцмана; T – температура.
38
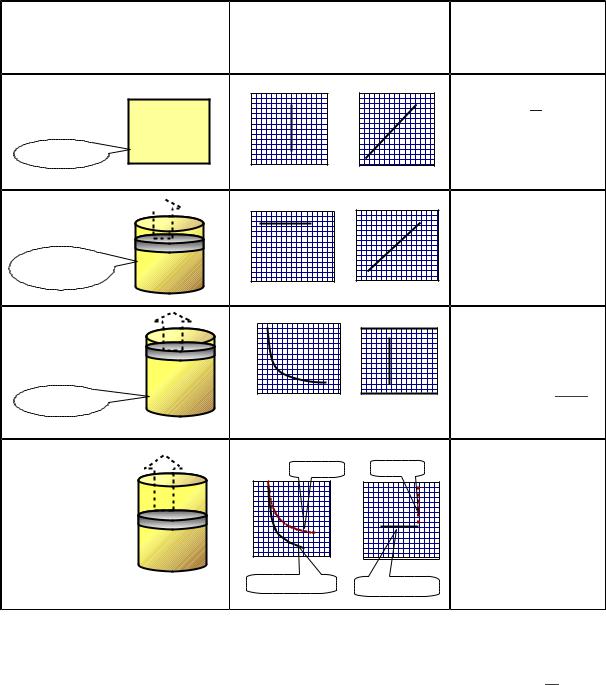
10. Уравнения изопроцеcсов в газах; молярная теплоёмкость и
работа газа
Процесс, уравнение, условия протекания
Изохорный
p = const·T V = const; ν = const
Q =Δ U
Изобарный 

 A
A
V = const·T
Q =Δ U + A |
p = const; |
|
ν = const |
||
|
A |
|
Изотермический |
||
p∙V = const |
Т = const; |
|
|
||
Q = A |
ν = const |
|
Адиабатный |
A |
|
|
||
p∙V γ = const. |
S = const; |
|
Q = 0 |
||
ν = const |
||
A =− U
|
|
|
|
|
|
Таблица 10 |
||
Диаграммы процесса |
|
Молярная |
||||||
|
теплоёмкость; |
|||||||
в различных координатах |
||||||||
работа |
газа |
|||||||
|
|
|
|
|||||
p |
|
p |
|
C |
|
= i |
R; |
|
|
|
|
|
V |
||||
|
|
|
2 |
|
||||
0 |
V |
0 |
T |
|
|
A = 0 |
||
|
|
|
|
|||||
p |
|
V |
|
Cp = CV + R; |
||||
|
|
|
||||||
|
|
|
|
|
|
|
||
|
|
|
|
A = p ·ΔV, |
||||
0 |
V |
0 |
T |
или A = ν∙R∙ T |
||||
|
|
|
|
|||||
p |
|
S |
|
CT = ± ∞; |
||||
|
|
|
|
|||||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
V кон |
|
0 |
V |
0 |
T |
A=ν RT ln V нач |
||||
p |
T=const |
S T=const |
|
CS = 0 ; |
||||
|
|
|
|
|
|
|
|
|
|
|
|
A = – U, |
|||||
|
|
|
||||||
|
|
|
||||||
0 |
V |
0 |
T или A = – ν∙CV·ΔТ |
|||||
Q=0; S=const |
Q=0; S=const |
|
|
|
|
|||
11. Средняя кинетическая энергия молекулы идеального газа
ε= 2i k T ,
где i = iпост + iвр + 2iкол – число степеней свободы, равное сумме степеней свободы поступательного, вращательного и колебательного
движений молекулы. При низких температурах (Т < 1 кК), когда
iкол = 0, тогда i = iпост + iвр, i = 5 для двухатомных молекул и, если молекула газа состоит из трёх и более атомов, i = 6.
39
