2039
.pdf


|
|
|
|
Вариант 1 |
|
|
|
|
|
Вариант 2 |
|
|
||
|
|
|
|
Одноатомный газ |
|
|
|
Двухатомный газ |
||||||
р |
|
|
|
ν = 0,030 моль |
|
р |
|
|
|
ν = 4,0 ммоль |
||||
МПа |
|
b |
|
|
c |
МПа |
|
|
|
|
|
|
||
|
|
|
|
|
a |
|
|
|
|
|
b |
|||
0,4 |
|
|
|
|
|
|
4 |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
0,3 |
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
0,2 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
0,1 |
a |
|
|
d |
|
|
1 |
d |
|
|
|
|
|
c |
|
|
|
|
|
|
|
|
|
||||||
0 |
|
400 |
800 |
1200 |
Т, К |
|
0 |
20 |
40 |
60 V, см3 |
||||
|
|
|
|
Вариант 3 |
|
|
|
|
|
|
Вариант 4 |
|
|
|
|||
р |
|
|
|
Трёхатомный газ |
|
|
p |
|
|
Одноатомный газ |
|
||||||
|
|
|
|
|
105 Па |
|
ν = 0,025 моль |
|
|||||||||
МПа |
|
|
|
ν = 12 ммоль |
|
|
|
|
|||||||||
0,4 |
a |
|
b |
|
|
|
4 |
|
b |
|
|
c |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
0,3 |
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
0,2 |
|
d |
|
|
|
|
|
|
|
c |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
0,1 |
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
a |
|
|
d |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
0 |
100 |
200 |
|
300 |
V, см3 |
0 |
|
1 |
2 |
3 |
|
V, л |
|||||
|
|
|
|
|
|
|
Вариант 5 |
|
|
|
|
|
|
|
|
|
Вариант 6 |
|
|
|
|
||||||
|
|
p |
|
|
|
|
Одноатомный газ |
|
|
|
|
|
|
|
Двухатомный газ |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
Вариант 7 |
|
|
|
|
|
V |
|
|
Вариант 8 |
|
|
|
|
|
|
||||||
|
105 Па |
|
|
|
Тb= Tc = 1200 К |
|
|
|
|
|
р |
а |
= 0,36 МПа |
|
|
|
|
||||||||||
|
b |
|
|
рл |
|
|
|
|
|
|
|
|
d |
||||||||||||||
|
p |
Трёхатомный газ |
|
|
|
|
|
Одноатомный газa |
|
|
|||||||||||||||||
|
|
|
|
|
|
|
Vd = 1,8 л |
|
|
|
|
МПа4 |
|
|
ν = 12 ммоль |
|
|
|
|
|
|||||||
105 Па |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
4 |
|
|
|
|
|
a |
|
b |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
3 |
a |
b |
|
|
|
|
|
|
|
|
|
||||
3 |
|
|
|
|
Вариант 9 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
0,4 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
3 |
|
|
|
|
|
|
|
|
|
|
Вариант 10 |
|
|
|
|
|
|
||||||||||
2 |
|
|
|
|
Двухатомный газ |
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
p |
|
|
|
|
c |
|
|
|
|
0,3 |
|
|
|
Одноатомный газ |
|
|
|
|
||||||||
|
|
|
|
ν = 32 ммоль |
|
|
|
|
|
|
|
|
c |
||||||||||||||
2 |
5 |
|
|
|
|
|
|
|
|
р |
|
1 |
|
b |
Тd = 300 К |
|
|
||||||||||
101Па |
ba |
|
|
d |
|
c |
|
МПа0,2 |
|
Тa = |
|
|
|
|
|||||||||||||
14 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
d |
c |
|
|
|
|
0,1 |
a |
0,4 |
0,8 |
1,2 |
|
|
b |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
Т, кK |
||||||||||||
3 0 |
2 |
4 |
6 |
V, л |
|
0,4 |
|
|
d |
|
|
|
|
|
|
|
|
c |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
0 |
|
0,4 |
|
0,8 |
1,2 |
|
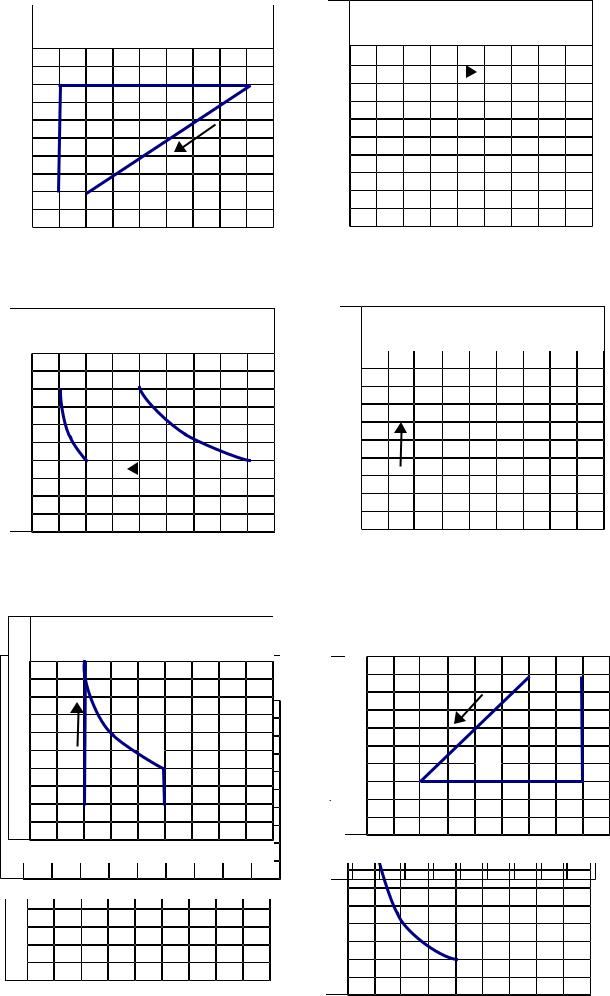
Рис. |
50 – 55 |
0,3 |
0 |
|
1 |
|
|
|
2 |
3 |
|
V, л |
|
|||||||
|
|
T, кК |
|
|
|
|
|
|
|
|
|||||||||||||||||
2 |
|
a |
|
|
|
|
|
d |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
1 |
|
|
|
|
|
|
146 |
0,2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
0,1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
d |
|
|
|
|
c |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
0 |
1 |
|
2 |
3 |
V, л |
|
|
|
|
|
1 |
|
2 |
|
3 |
|
V, л |
||||||||
|
|
|
|
|
|
|
|
|
|
Рис. 56 — 590 |
|
|
|
|
|
|
|||||||||||


σ = ? |
|
Решение. Игла не смачивается жидкостью, а лишь |
||||
g = 9,81 м/с2 |
касается её в нижней части своей поверхности. |
|||||
ρ = 4,5·103 кг/м3 |
||||||
d = 2,0·10–3 м |
Поверхность жидкости прогибается под действием |
|||||
hпогр = R= ½d |
силы тяжести иглы. |
|
|
|
||
|
|
Предположим, что поверхность под иглой прини- |
||||
мает форму полуцилиндра длиной L и радиусом R = d/2, где R – |
||||||
радиус иглы; d – её диаметр. При этом в жидкости возникает |
||||||
добавочное давление, вычисляемое по формуле Лапласа |
|
|||||
|
|
|
pЛ = σ ( 1 + 1 ), |
|
||
|
|
R |
R |
|
|
|
|
F Л |
|
2 |
|
||
R↕ |
|
|
1 |
|
|
|
•C |
где σ – поверхностное натяжение жидкости; R1 и |
|||||
R ↕ |
|
R2 – радиусы кривизны поверхности, измеренные |
||||
|
mg |
во взаимно перпендикулярных плоскостях. |
|
|||
Рис. 61 |
В данном случае R1 ≈ R, |
R2 = ∞ и pЛ = |
2σ . |
|||
|
|
|||||
|
|
|
|
|
|
d |
Сила лапласова давления под изогнутой поверхностью жидкости |
||||||
уравновешивает силу тяжести иглы: |
|
|
|
|||
|
|
|
F п.н = F тяж , |
|
|
(1) |
где F п.н= pЛ S ; S ≈ 2 R L – площадь проекции изогнутой поверх- |
||||||
ности жидкости на горизонтальную плоскость; F тяж= mg – сила тя- |
||||||
жести; g – ускорение свободного падения; m=ρV =ρ π R2 L – масса; |
||||||
V =π R2 L – объём; ρ – плотность; L – длина иглы. |
|
|||||
Из условия равновесия (1) получим |
[σ] = м2 кг м =H . |
|||||
σ 2 RL = ρ π R2 L g |
=> σ = π R2 ρ g . |
|||||
R |
|
|
2 |
|
м3 c2 |
м |
|
σ = 0,5 3,14 1,0 10−6 4,5 103 9,81. |
σ = 69·10-3 Н/м. |
||||
Пример 2. Ультразвуковой распылитель производит 5 кг |
||||||
водяного тумана за один час. Оценить полезную мощность |
||||||
прибора. Размер частиц тумана принять равным 20 мкм. |
||||||
σ = ? |
|
Решение. Туман – это взвешенные в |
воздухе |
|||
m = 5 кг |
|
капельки жидкости. Под действием сил поверх- |
||||
σ = 73·10-3 Н/м |
||||||
ρ = 1,0·103 кг/м3 |
ностного натяжения площадь поверхности стремится |
|||||
d = 20·10–6 м |
к минимуму и капли приобретают форму, близкую к |
|||||
t = 3,6·103 c |
|
сферической. |
|
|
|
|
|
|
|
149 |
|
|
|