
- •Лекция 7. Химические процессы и реакторы Виды химических реакторов
- •4.2. Процесс в химическом реакторе
- •4.2.1. Математическая модель процесса в химическом реакторе
- •4.2.2. Анализ процесса в химическом реакторе
- •4.3. ИзотермическиЙ процесс в химическОм реакторЕ
- •4.3.1. Режимы идеального смешения периодический и идеального вытеснения
- •4.3.2. Режим идеального смешения в проточном реакторе
- •4.3.3. Сопоставление непрерывных процессов в режимах идеального смешения и вытеснения
- •4.4. Неизотермический процесс в химическом реакторе
- •4.4.1. Режимы идеального смешения периодический и идеального вытеснения с теплообменом
- •Температурный режим в проточном реакторе идеального смешения
- •Сопоставление адиабатического процесса в проточных режимах идеального смешения и вытеснения и выбор эффективного ректора при протекании простых реакций аr q
- •Каскад ректоров ис (к-ис)
- •Состав и структура химико-технологической системы
- •Элементы хтс
- •Состояние хтс синтез и анализ хтс
- •Основы разработки эффективных хтс
- •Задачи синтеза и анализа хтс
- •Лекция 12
- •Анализ хтс
- •Основы расчёта материального баланса химико-технологической системы
- •1. Общий вид уравнений материального баланса
- •2. Химико-технологическая система и её расчётная схема
- •2.1. Материальный баланс элементов хтс
- •2. Общий вид уравнений теплового (энергетического) баланса
- •3. Форма представления материального баланса
- •1. Концепция полного использования сырьевых ресурсов
- •7) Комбинирование производств
- •2. Концепция полного использования энергетических ресурсов
- •4) Вторичные энергетические ресурсы
- •5). Энерго-технологическая система
- •3. Концепция минимизации отходов
- •4. Концепция эффективного использования оборудования
- •6) Совмещение процессов
- •7) Перестраиваемые (гибкие) химико-технологические системы
- •12.05.20. Лекция 14. ОПтимальные схемы реакторов ив и ис
- •5.6.1. Система химических реакторов
- •Примеры построения эффективных химических производств
- •Производство серной кислоты
- •Хтс производства азотной кислоты
Сопоставление адиабатического процесса в проточных режимах идеального смешения и вытеснения и выбор эффективного ректора при протекании простых реакций аr q
Главным
показателем при выборе реактора для
простых реакций является скорость
процесса или интенсивность. Скорость
зависит от концентрации и температуры.
На рис. VII.12
показаны изменения концентрации,
температуры и скорости реакции в обоих
реакторах при проведении экзо и
эндотермических реакций (l
–длина РИВ, y
– координата (объем) РИС-Н). Видно, что
для эндотермической реакции более
эффективным будет РИВ. Для реакции А![]() R
+ Q
возможны 2 случая. Если влияние концентрации
на скорость реакции сильнее, чем влияние
температуры, предпочтительно использовать
РИВ, там скорость будет выше чем в РИС-Н.
Если же на скорость реакции сильнее
влияет температура, чем концентрация,
скорость реакции для РИВ и РИС-Н возрастут,
причем для РИВ она пройдет через mах.
В 1-м случае выгоднее использовать
R
+ Q
возможны 2 случая. Если влияние концентрации
на скорость реакции сильнее, чем влияние
температуры, предпочтительно использовать
РИВ, там скорость будет выше чем в РИС-Н.
Если же на скорость реакции сильнее
влияет температура, чем концентрация,
скорость реакции для РИВ и РИС-Н возрастут,
причем для РИВ она пройдет через mах.
В 1-м случае выгоднее использовать

РИВ, там выше скорость реакции при прочих равных условиях. Во 2-м случае, когда на скорость реакции сильнее влияет температура, чем концентрация, для получения максимальной скорости на всем протяжении процесса выгода взять систему из 2-х реакторов РИС-Н и РИВ (рис.VII.14).

На участке

Эффективное проведение обратимых экзотермических реакций требует, как известно (было раньше, см. лекцию «гомогенные процессы»), приближения режима процесса к ЛОТ «см. зависимости r(T) и х(Т)». Такое приближение к ЛОТ можно осуществить, например, если секционировать реакционную зону, т.е. разделить ее на участки, (слои катализатора, если реактор –каталитический) и отводить тепло от нагретой реакционной смеси за счет реакции после каждого участка (см. рис. реактора ниже).

Рис. 5. Зависимость скорости обратимой экзотермической реакции (а) и степени превращения (б) от температуры, x1 x2 x3 x4

Ниже показан реальный режим процесса в реакторе с тремя реакционными участками в виде пилообразной линии.

PS:Более подробно типы реакторов для обратимой экзореакции вы изучите при прохождении лаб.практикума.
ЛЕКЦИИ 10 и 11
Каскад ректоров ис (к-ис)
В единичном РИС-Н не достигается высокая степень превращения, т.к. концентрация исходного вещества С0 в нем мгновенно снижается от исходной до конечного значения СК и весь процесс протекает при низкой концентрации и значит при низкой скорости. Поэтому часто применят ряд последовательно расположенных РИС – каскад реакторов К-РИС. Концентрация исходного реагента С0 в таком каскаде снижается до конечной не сразу (степень превращения соответственно повышается), а ступенчато от реактора к реактору рис. 1.

В каждом реакторе концентрация исходного вещества в объеме постоянная и равна концентрации его на выходе из реактора (Рис.2). В целом рабочая концентрация С в каскаде на всем протяжении процесса устанавливается выше, чем в единичном РИС-Н, и при увеличении числа реакторов ее изменение приближается к модели РИВ.

Расчет К-РИС заключается в определении числа реакторов N, необходимых для достижения заданной степени превращения СК. Существуют аналитический и графический методы расчета.
Аналитический метод расчета удобно использовать при протекании реакции первого порядка.
Дано: исходные условия (С0, объемы реакторов В К-ИС, объемный расход смеси V0 на входе в К-ИС, будем его считать постоянным);
Конечные условия (концентрация СК или степень превращения хК.
Требуется определить необходимое число реакторов в каскаде N.
Математическая модель процесса в реакторе ИС при протекании реакции первого порядка описывается уравнением: (С0 - С)/ = kC, откуда для каждого реактора в К-РИС запишем:

В случае реакторов одинакового объема (равные значения ):
Ск = С0/(1 + k) N , где N – число реакторов.
Из этой формулы можно рассчитать N
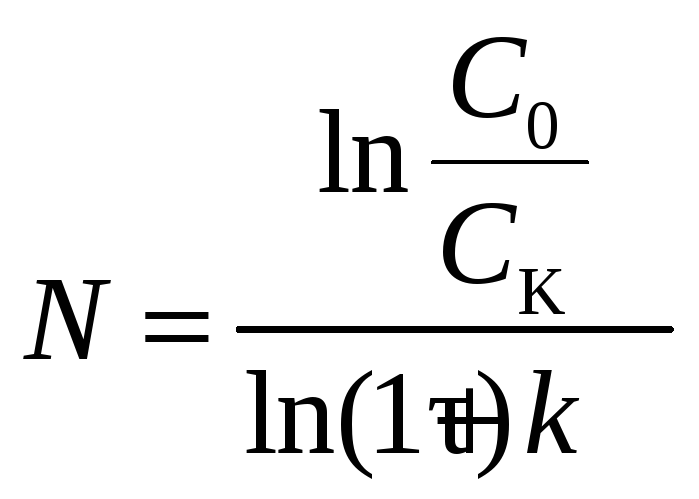
Или через степень превращения хК.:

Очевидно, что если дано N, легко определить Ск или хК, т.е. решить обратную задачу.
Графический метод расчета К-РИС используют обычно при сложной кинетике реакции. Для первого (головного) реактора в К-ИС имеем:
 ,
,
откуда
![]()
Для 2-го ректора
![]() и т. д.
и т. д.
В этих
уравнениях левая часть есть кинетическое
уравнение реакции, которую можно
изобразить на графике в координатах
r(С).
Правые части –прямые линии в тех же
координатах с тангенсами наклона к оси
концентрации, равными
![]() и т.д.
и т.д.
Т.о. для расчета К-РИС надо вначале построить по точкам зависимость
r(С),
затем из точки С0,
на оси абсцисс провести прямую с
тангенсом угла наклона ![]() до пересечения с кривой
r(С)
(рис.3). Опустив перпендикуляр из точки
пересечения, найдем концентрацию на
выходе из первого реактора С1
.
Она же будет концентрация на входе в
следующий реактор. Такие операции
продолжают повторять до тех пор, пока
не будет достигнута концентрация Ск.
Число ступеней и будет числом реакторов
в каскаде.
до пересечения с кривой
r(С)
(рис.3). Опустив перпендикуляр из точки
пересечения, найдем концентрацию на
выходе из первого реактора С1
.
Она же будет концентрация на входе в
следующий реактор. Такие операции
продолжают повторять до тех пор, пока
не будет достигнута концентрация Ск.
Число ступеней и будет числом реакторов
в каскаде.
ХИМИЧЕСКОЕ ПРОИЗВОДСТВО КАК ХИМИКО-ТЕХНОЛОГИЧЕСКАЯ СИСТЕМА
Структура и описание химико-технологической системы
Химическое производство (ХП)- совокупность операций, осуществляемых в машинах и аппаратах, связанных между собой технологическими, энергетическими, информационными потоками и предназначенных для переработки сырья в продукты.
Все части ХП взаимосвязаны, функционируют вместе, обеспечивая получение продукции и выполняя другие функции производства (такие, как управление, снабжение водой, теплом, энергией). (см. 1-ю лекцию)
Такой объект называется также системой.
Система - совокупность элементов и связей между ними, функционирующая как единое целое.
Элемент изменяет входящие в него потоки – их свойства и состояние. Выходящие потоки передаются по связям в другие элементы, в которых происходят последующие изменения потоков. Такая система функционирует как единое целое, перерабатывая входящие в нее потоки в выходящие из нее. Для исследования таких объектов, их свойств, особенностей функционирования развита теория систем.
В химическом производстве элементы - машины, аппараты и другие устройства; связи - трубо-, газо-, паропроводы, которые соединяют машины, аппараты, устройства. В элементах происходит превращение потоков (изменение их состояния - разделение, смешение, сжатие, нагрев, химические превращения и прочее). По связям потоки (материальные, тепловые, энергетические) передаются из одного элемента в другой. Это позволяет представить химическое производство как химико-технологическую систему (в дальнейшем будем также использовать сокращение ХТС).
Химико-технологическая система (ХТС) - совокупность аппаратов, машин и других устройств (элементов) и материальных, тепловых, энергетических и других потоков (связей) между ними, функционирующая как единое целое и предназначенная для переработки исходных веществ (сырья) в продукты.
Элемент изменяет состояние потока. Он может быть представлен отдельным аппаратом (реактором, смесителем, абсорбером, теплообменником, турбиной и т.д.) или их совокупностью, производящей какое-то изменение состояние потока. Например, реактор с теплообменником производит изменение химического состава и меняет теплосодержание потока. Степень детализации элемента: один аппарат или совокупность нескольких аппаратов; состав такой совокупности, - зависит от задачи исследований.
В зависимости от цели исследований не все аппараты будут влиять на интересующие свойства ХТС. Если цель исследований - определение производительности, выхода продукта и другие материальные показатели, то теплообменники, насосы и другое оборудование, не изменяющие состав потоков, можно не включать в ХТС. В этом случае говорят, что рассматривается технологическая подсистема производства. Если цель исследований - обеспечение производства энергией, то в ХТС включают энергетическое оборудование как ее элементы, и рассматривают энергетическую подсистему.
Таким образом, химико-технологическая система представляет собой обобщенную модель химического производства, отображающая его структуру и позволяющую предсказывать те или иные свойства и показатели химического производства.
Представив химическое производство как химико-технологическую систему, можно использовать развитую теорию систем для его исследованию, иметь научный метод его изучения.
Конкретная реализация и приложение теории систем к исследованию ХТС получила название системного анализа ХТС
Системный анализ ХТС - совокупность методов и средств изучения сложных химико-технологических систем.
Системный анализ - результат успешного применения к исследованию и разработке ХТС опыта изучения, создания и эксплуатации химических производств с привлечением методов, используемых в химических, физических и математических науках, моделировании, вычислительной математике, механике, автоматическом управлении и других разделах науки, используемых в инженерно-химических исследованиях и разработках.
Последовательность этапов при исследовании ХТС:
1. Выделение элементов, которые определяют интересующие или необходимые свойства ХТС.
2. Установление зависимости выходных потоков от входных для каждого элемента, т.е. получение его математического описания (см., например, матмодели реакторов РИВ или РИС). Поскольку в элементах ХТС происходят превращения потоков, то их описание основывается, главным образом, на физико-химических и физических закономерностях протекающих в них процессов. Математические описания элементов создают основу количественных расчетов при исследовании системы.
3. Выделение связей между элементами, ответственных за проявление интересующих свойств ХТС.
4. Исследование ХТС - расчет показателей, определение свойств (особенностей), изучение эволюции (развития, изменения) ХТС для улучшения ее показателей и свойств. Здесь используются методы различных областей наук - кибернетики, топологии, теории информатики, игр, решение, катастроф, факторного анализа. Математическое описание системы, состоящей из сотен элементов и связей, - сложная система алгебраических, дифференциальных и интегральных уравнений. Поэтому основное средство системного анализа - электронные вычислительные машины, компьютеры.
