
- •Лекция 7. Химические процессы и реакторы Виды химических реакторов
- •4.2. Процесс в химическом реакторе
- •4.2.1. Математическая модель процесса в химическом реакторе
- •4.2.2. Анализ процесса в химическом реакторе
- •4.3. ИзотермическиЙ процесс в химическОм реакторЕ
- •4.3.1. Режимы идеального смешения периодический и идеального вытеснения
- •4.3.2. Режим идеального смешения в проточном реакторе
- •4.3.3. Сопоставление непрерывных процессов в режимах идеального смешения и вытеснения
- •4.4. Неизотермический процесс в химическом реакторе
- •4.4.1. Режимы идеального смешения периодический и идеального вытеснения с теплообменом
- •Температурный режим в проточном реакторе идеального смешения
- •Сопоставление адиабатического процесса в проточных режимах идеального смешения и вытеснения и выбор эффективного ректора при протекании простых реакций аr q
- •Каскад ректоров ис (к-ис)
- •Состав и структура химико-технологической системы
- •Элементы хтс
- •Состояние хтс синтез и анализ хтс
- •Основы разработки эффективных хтс
- •Задачи синтеза и анализа хтс
- •Лекция 12
- •Анализ хтс
- •Основы расчёта материального баланса химико-технологической системы
- •1. Общий вид уравнений материального баланса
- •2. Химико-технологическая система и её расчётная схема
- •2.1. Материальный баланс элементов хтс
- •2. Общий вид уравнений теплового (энергетического) баланса
- •3. Форма представления материального баланса
- •1. Концепция полного использования сырьевых ресурсов
- •7) Комбинирование производств
- •2. Концепция полного использования энергетических ресурсов
- •4) Вторичные энергетические ресурсы
- •5). Энерго-технологическая система
- •3. Концепция минимизации отходов
- •4. Концепция эффективного использования оборудования
- •6) Совмещение процессов
- •7) Перестраиваемые (гибкие) химико-технологические системы
- •12.05.20. Лекция 14. ОПтимальные схемы реакторов ив и ис
- •5.6.1. Система химических реакторов
- •Примеры построения эффективных химических производств
- •Производство серной кислоты
- •Хтс производства азотной кислоты
4.2.2. Анализ процесса в химическом реакторе
Анализ процесса в химическом реакторе - исследование влияния условий процесса и характеристик (свойств) его составляющих на показатели работы реактора, а также выявление особенностей процесса и режима.
Условия процесса - состав исходной реакционной смеси (начальные концентрации реагентов – Сi0), объем поступающего потока (нагрузка на реактор – V0), температуры входного потока T0, хладоагента TX (для процессов с теплоотводом) или в реакторе (для изотермического процесса - T).
Свойства составляющих процесса - характеристики химического процесса: схема превращения и тип реакций (вид кинетических уравнений), энергия активации, тепловой эффект; для неизотермических процессов - параметры теплоотвода (коэффициенты теплопередачи, поверхность теплообмена, теплофизические свойства потока).
Показатели процесса - степень превращения х, селективность S, выход продукта Е, а также профили концентраций, степени превращения и температуры в реакторе, их изменение во времени. Зная эти показатели, можно далее определять и другие: конструктивные параметры реактора, энергетические затраты, экономические показатели и др.
Особенности процесса и режима - влияние условий и свойств процесса на его показатели, управление процессом (изменение условий и свойств для достижения желаемых показателей), критические режимы (например, их существование, неустойчивость).
4.3. ИзотермическиЙ процесс в химическОм реакторЕ
4.3.1. Режимы идеального смешения периодический и идеального вытеснения
Процессы в реакторах, работающих в режимах идеального смешения периодическом (РИС-п) и идеального вытеснения (РИВ) описываются математически идентичными уравнениями (4.9 а) и (4.9 в). Полагая , t в зависимости от процесса, для дальнейшего рассмотрения используем уравнение вида:
dС/d = W(С), С = С0 при = 0. (4.10)
Простая необратимая реакция А = В. Математическая модель процесса, скорость превращения исходного компонента которого описывается уравнением W(С) = -kС (реакция первого порядка), имеет вид:
dСA/d = -r = -kСA, СA = С0 при = 0. (4.11)
Решением уравнения (4.10) являются зависимости:
 (4.12)
(4.12)
 (4.13)
(4.13)
Графическое представление С() из уравнения (4.12) и х() для исходного вещества из уравнения (4.13) иллюстрирует рис. 4.4 (n = 1).
Влияние порядка реакции. Для реакции n-го, скорость превращения исходного компонента описывается выражением W(С) = -r=-kСn,уравнение (4.11) преобразуется к виду:
dСA/d = -kСAn или dхA/d = kС0n-1(1 - хA)n. (4.14)
Решением уравнения (4.14) является следующая зависимость С():
![]() . (4.15)
. (4.15)
Зависимости С() и х() исходного вещества для n < 1, n > 1 и n = 1 показаны на рис. 4.4.

Рис. 4.4. Зависимость концентрации исходного вещества C (а) и степени превращения x (б) от для простых необратимых реакций разного порядка n в режимах ИВ (или ИС-п).
Влияние температуры. В уравнениях (4.11) или (4.14) только константа скорости k зависит от температуры (по уравнению Аррениуса k = k0exp(-Е/RТ)), увеличиваясь вместе с ней. Таким образом, с ростом температуры скорость реакции увеличивается, концентрация исходного компонента быстрее уменьшается со временем, и интенсивность процесса возрастет (рис. 4.5).
Влияние начальной концентрации С0 на процесс в реакторе оценивается по двум факторам: производительности процесса и изменению степени превращения при определенной нагрузке на реактор V0.
Увеличение концентрации С (и С0) исходного компонента вызывает повышение скорости реакции r = kСn, что вызывает рост производительности процесса.
С другой стороны увеличение концентрации приводит к возрастанию количества вещества, которое надо превращать. Для реакций с n = 1 начальная концентрация С0 не влияет на зависимость х() (уравнение 4.13). Если n > 1, то с ростом С0 степень превращения возрастает (уравнение 4.15). Если n <

Рис. 4.5. Влияние температуры Т на зависимость C() (T2 > T1)для режима ИВ (или ИС-п)

Рис. 4.6. Влияние C0 на изменение функции x() для реакций порядка n для режима ИВ (или ИС-п); сплошные линии получены при C01, штриховые – при C02 > C01
1, то с увеличением С0, х медленнее меняется во времени, степень превращения уменьшается (рис. 4.6).
Простая обратимая реакция А = R. Скорость простой обратимой реакции r(С) = k1СA - k2СR зависит от концентрации двух реагентов. Выразим математическую модель процесса через степень превращения реагента А (СA = С0(1- хA), СR = С0 хA, С0 – исходная концентрация А):
dхA /d = k1(1 - хA) - k2 хA, хA = 0 при = 0. (4.16)
После интегрирования:
![]() . (4.17)
. (4.17)
В отличие от простой необратимой реакции, протекающей до конца (х = 1), обратимая реакция протекает до равновесия, предельная степень превращения в этом случае равна равновесной (х = хP) рис. 4.7 (n = 1).
Влияние температуры. Повышение температуры приводит к росту константы скорости как прямой k1, так и обратной k2 реакции. Насколько каждая их констант влияет на общую скорость реакции определяется соотношением их энергий активации (соответственно Е1 и Е2). Для экзотермической

Рис. 4.7. Зависимость степени превращения x от для простой обратимой (сплошная линия) и для необратимой реакции (штриховая) в режимах ИВ (или ИС-п)
реакции QP > 0 (QP = Е2 - Е1), Е2 > Е1, и k2 (и скорость обратной реакции) увеличивается с температурой сильнее, чем k1 (и скорость прямой реакции). Для эндотермической это соотношение будет обратным.
Влияние температуры на зависимость хА() обратимой экзо- и эндотермической реакции представлена на рис. 4.8.
Сложная реакция с параллельной схемой превращения
k 1
R
1
R
А
k2 S
Математически процесс описывается уравнениями (n=1):
d СA/d
= -(k1+k2)СA;
СA/d
= -(k1+k2)СA;
dСR/d = k1СA; (4.18)
dСS/d = k2СA;
СA = С0, СR = СS = 0 при = 0.
Решим систему уравнений (4.18) относительно концентраций реагентов А, R и S:
![]() ; (4.19)
; (4.19)
![]() ; (4.20)
; (4.20)
![]() . (4.21)
. (4.21)
Зависимости концентраций реагентов от представлены на рис. 4.9.

Рис. 4.8. Зависимость x() при температурах Т1 (1) и Т2 > Т1 (2, 3) для эндотермической (2) и экзотермической (3) реакций в реакторе ИВ (или ИС-п); штриховыми линиями показаны равновесные степени превращения xр для тех же условий

Рис. 4.9. Изменение концентрации реагентов в реакторе ИВ (или ИС-п) при протекании сложной параллельной реакции: сплошные линии построены при температуре Т1, штриховые - при Т2 > Т1 и E1 > E2
Влияние температуры. Если Е1 > Е2 (Е1 - энергия активации реакции, в которой образуется продукт R), то при повышении температуры, концентрация продукта R возрастет при всех . Концентрация продукта S (CS) вначале возрастет за счет увеличения скорости превращения, а затем – уменьшится, т.к. большая доля А будет превращаться в R (рис. 4.9).
Селективность процесса зависит не только от соотношения констант скоростей реакций, но и от их порядка (см. прошлые лекции). По мере протекания процесса в реакторе, с увеличением и уменьшением СA, селективность процесса SR будет меняться в интервале между С0 и текущим значением СA (направление изменения показано стрелкой на рис. 4.10, а) как среднеинтегральная величина значений дифференциальной селективности SR'. Если n1 = n2 (n1 и n2 – порядки частных реакций образования R и S, соответственно) то, следуя уравнениям 4.20 и 4.21, изменения S'R и SR в ходе рекции не происходит (рис. 4.10, а и б). Характер изменения селективности в ходе реакции в случае n1 > n2 и n1 < n2 представлен на рис. 4.10.

Рис. 4.10. Зависимость дифференциальной селективности SR для параллельной реакции от концентрации СА (а) и интегральной селективности SR от (б) в реакторе ИВ при различном соотношении порядков частных реакций n1 и n2
Практические выводы. При n1 = n2 достигаемая в реакторе степень превращения не будет влиять на селективность процесса. Если n1 > n2, то достижение высоких степеней превращения может быть нецелесообразным из-за
уменьшения избирательности по продукту R. Если n1 < n2, то увеличение степени превращения благоприятно для селективности по продукту R. Повышение температуры благоприятно и для интенсивности, и для селективности процесса, если Е1 > Е2. В противоположном случае (Е1 < Е2) снижение температуры благоприятно для селективности процесса в ущерб его интенсивности.
Сложная реакция с последовательной схемой превращения
![]()
Математически процесс описывается системой уравнений (n=1):
d СA/d
= -k1СA;
СA/d
= -k1СA;
dСR/d = k1СA - k2СR; (4.22)
dСS/d = k2СR;
СA = С0, СR = СS =0 при = 0.
Решим систему уравнений (4.22) относительно концентраций реагентов А, R и S:
![]() ; (4.23)
; (4.23)
 ; (4.24)
; (4.24)
 . (4.25)
. (4.25)
Графически зависимости (4.23), (4.24), (4.25) представлены на рис. 4.11. Максимум на кривой СR соответствует Rmax - моменту, когда скорости образования и расходования промежуточного продукта R сравниваются, а также
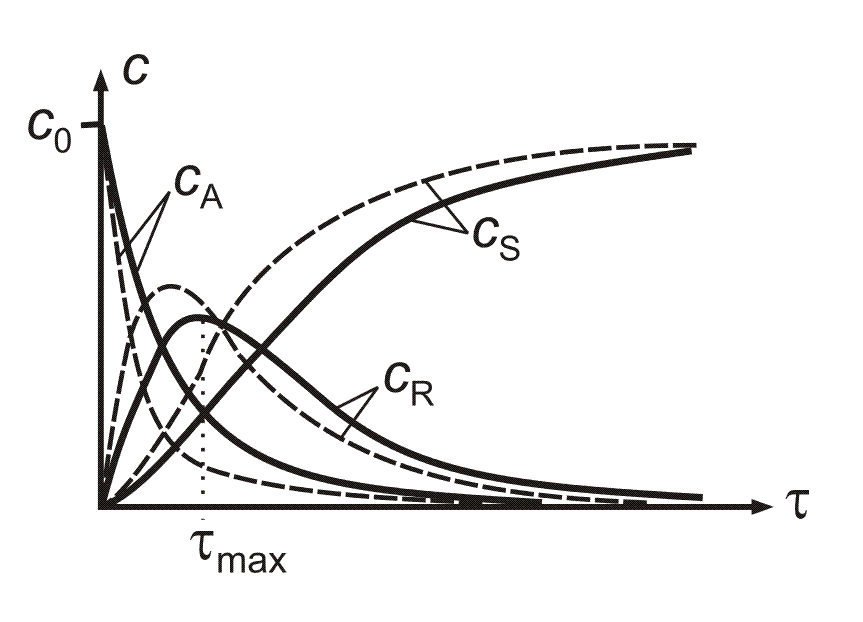
Рис. 4.11. Изменение концентрации реагентов в реакторе ИВ (или ИС-п) при протекании последовательной реакции; сплошные линии - при температуре Т1 и Е1, штриховые - при T2 > T1 и E1 > E2
СRmax – максимальному содержанию продукта R в смеси. Интегральная селективность по продукту R уменьшается с глубиной превращения.
Влияние температуры. Вследствие увеличения температуры изменение концентрации любого компонента происходит за меньшее время, следовательно, Rmax – время достижения максимального количества продукта R уменьшается (рис. 4.11). Если Е1 > Е2 (Е1 - энергия активации первой частной реакции), то увеличение температуры способствует большему выходу промежуточного продукта R, а также увеличению селективности по R. В обратном случае (Е2 > Е1) максимальная концентрация и селективность по R уменьшатся.
Практические выводы следующие. Максимальный выход промежуточного продукта R обеспечивает проведение процесса при max (длина реактора ИВ или время периодического процесса). Уменьшение приведет к увеличению селективности по R в ущерб общему превращению. Увеличение приведет к потери как в селективности SR, так и выходе продукта R. Если же целевой продукт - конечный (S), то следует добиваться как можно большей степени общего превращения. Увеличение температуры целесообразно, если Е1 > Е2 – в этом случае возрастет и интенсивность, и выход R, и селективность по R.
