
- •Лекция 7. Химические процессы и реакторы Виды химических реакторов
- •4.2. Процесс в химическом реакторе
- •4.2.1. Математическая модель процесса в химическом реакторе
- •4.2.2. Анализ процесса в химическом реакторе
- •4.3. ИзотермическиЙ процесс в химическОм реакторЕ
- •4.3.1. Режимы идеального смешения периодический и идеального вытеснения
- •4.3.2. Режим идеального смешения в проточном реакторе
- •4.3.3. Сопоставление непрерывных процессов в режимах идеального смешения и вытеснения
- •4.4. Неизотермический процесс в химическом реакторе
- •4.4.1. Режимы идеального смешения периодический и идеального вытеснения с теплообменом
- •Температурный режим в проточном реакторе идеального смешения
- •Сопоставление адиабатического процесса в проточных режимах идеального смешения и вытеснения и выбор эффективного ректора при протекании простых реакций аr q
- •Каскад ректоров ис (к-ис)
- •Состав и структура химико-технологической системы
- •Элементы хтс
- •Состояние хтс синтез и анализ хтс
- •Основы разработки эффективных хтс
- •Задачи синтеза и анализа хтс
- •Лекция 12
- •Анализ хтс
- •Основы расчёта материального баланса химико-технологической системы
- •1. Общий вид уравнений материального баланса
- •2. Химико-технологическая система и её расчётная схема
- •2.1. Материальный баланс элементов хтс
- •2. Общий вид уравнений теплового (энергетического) баланса
- •3. Форма представления материального баланса
- •1. Концепция полного использования сырьевых ресурсов
- •7) Комбинирование производств
- •2. Концепция полного использования энергетических ресурсов
- •4) Вторичные энергетические ресурсы
- •5). Энерго-технологическая система
- •3. Концепция минимизации отходов
- •4. Концепция эффективного использования оборудования
- •6) Совмещение процессов
- •7) Перестраиваемые (гибкие) химико-технологические системы
- •12.05.20. Лекция 14. ОПтимальные схемы реакторов ив и ис
- •5.6.1. Система химических реакторов
- •Примеры построения эффективных химических производств
- •Производство серной кислоты
- •Хтс производства азотной кислоты
Примеры построения эффективных химических производств
Чтобы разработать новое эффективное химическое производство или провести модернизацию действующего предприятия надо решить задачи анализа и синтеза ХТС. Анализ заключается в получении конкретной расчетной информации о показателях всех потоков, пронизывающих ХТС. И мы знаем как ее получить –путем составления и решения материальных и тепловых балансов как для отдельных элементов, так и подсистем и ХТС в целом, а также путем исследования свойств ХТС. Занимаясь анализом ХТС мы можем рассчитать показатели эффективности работы ХТС, такие как расходные коэффициенты по сырью и энергии, можем оценить экологичность разрабатываемого варианта, определить экономические показатели, такие как объем необходимых инвестиций, себестоимость продукции и т.д. Когда мы проводим синтез ХТС мы выбираем и рассчитываем эффективные аппараты, режимы их функционированиия, ищем наилучшие технологические связи между аппаратами с тем, чтобы все 4 концепции синтеза, которых говорили в прошлой лекции, были выполнены. Они все важны: ресурсо-энерго сбережение, минимизация отходов и эффективное использование оборудования.
Из всего обширного перечня производств выбрано производство серной и азотной кислот, существующие много лет, хорошо изученные с научной т.з. и тем не менее, постоянно подвергающиеся модернизации. Нет предела совершенствованию. Содержимое этой лекции направлено на то, чтобы продемонстрировать реализацию задач синтеза и анализа на конкретных примерах.
Производство серной кислоты
Производство минеральных удобрений (суперфосфата, сульфата аммония), а также разложение фосфатного сырья является крупнейшим потребителем серной кислоты. Высокая химическая активность и относительно небольшая стоимость производства предопределили очень большое разнообразие применения серной кислоты почти во всех промышленных отраслях.
Сырьевая база производства серной кислоты - серосодержащие соединения, из которых можно получить диоксид серы. В промышленности около 80% серной кислоты получают из природной серы и железного (серного) колчедана. Значительное место занимают отходящие газы цветной металлургии, получаемые при обжиге сульфидов цветных металлов и содержащие диоксид серы. Некоторые производства используют как сырье сероводород, образующийся в производстве кокса, при сероочистке в нефтепереработке. Первой стадией технологической системы является обжиг серосодержащего сырья для получения диоксида серы.
Химическая схема производства серной кислоты. Сравним 2 схемы производства, в которых в качестве сырья выступает серный колчедан или сера. Химическая схема включает реакции:
обжиг серного
колчедана 4 FeS2 + 11 O2
![]()
![]() 2Fe2O3 + 8 SO2+Qр
2Fe2O3 + 8 SO2+Qр
или серы
S2 + 2 O2
![]() 2 SO2 +Qр;
2 SO2 +Qр;
окисление диоксида серы SO2 + 1/2 O2 = SO3 +Qр;
абсорбция триоксида серы SO3 + H2O = H2SO4 +Qр.
Серный колчедан это дешевое природное сырье. Но на этом его преимущества заканчиваются. Это горная порода, кроме пирита FeS2 в ней есть много других примесей, в том числе отрицательно влияющих на свойства катализатора для окисления диоксида серы. Если ориентироваться на серный колчедан, необходимо предусмотреть стадию очистки газа после обжига, что конечно увеличивает материальные затраты и удорожает стоимость готового продукта. Кроме того, при обжиге образуется огарок –твердый отход. Маркетинговые исследования показывают, что на него отсутствуют потенциальные потребители. Поэтому огарок пойдет в отвалы, а это негативное воздействие на экологию.
Кроме того, при обжиге серного колчедана в воздухе нельзя получить газ с высоким содержанием диоксида серы, т.к. много кислорода тратится на образование огарка. Максимум это 8-8,5 об.%. Это значит, чтобы добиться высокой производительности ХТС по серной кислоте придется перекачивать огромные массы потоков, опять затраты, уже на транспортировку потоков.
Сера, как сырье, дороже серного колчедана, но при ее горении получается чистый газ, не требуется система очистки, концентрация диоксида серы в газе будет выше до 10-13 об.%. Нет твердых отходов. И наш выбор-это сера. Несмотря на правильный выбор, мы все же рассмотрим в качестве сырья серный колчедан только по одной причине. Там появляется гетерогенный процесс «Г-Т», который мы изучали ранее и полезно его еще раз вспомнить.
Функциональная производства серной кислоты

Рис.1 Функциональная схема производства серной кислоты из колчедана
1 –отделение (подсистема обжига колчедана), 2- отделение очистки обжигового газа, 3- подсистема окисления диоксида серы, 3- отделение абсорбции SO3.
Обжиг серосодержащего сырья.
Обжиг серосодержащего сырья. Обжиг колчедана (пирита) является сложным физико-химическим процессом, который описывается моделью «сжимающееся ядро».
В промышленности обжиг ведут при 1120-1170 К. Лимитирующей стадией процесса внутренняя диффузия кислорода к поверхности свежего пирита ми продуктов окисления в газовую фазу. При этих же температурах твердый компонент размягчается, что способствует слипанию его частиц. Эти факторы определили способ проведения процесса и тип реактора.
Сначала использовали полочный реактор. Колчедан располагали на полках, и воздух проходил как через неподвижные слои. Естественно, колчедан был кусковой - тонко измельченный создавал бы значительное гидравлическое сопротивление и мог легко слипаться, что создавало бы неоднородное горение. Опыт показал, что несмотря на усовершенствования, трудно решить проблемы теплосъема из зоны обжига, невозможно использование мелких частиц. А ведь основной прием интенсификации гетерогенного процесса, определяемый стадией внутренней диффузией- дробление частиц.
Мелкие частицы можно перерабатывать в кипящем (псевдоожиженном) слое, что реализовано в печах КС - кипящего слоя (рис. 2). Пылевидный колчедан подается через питатель в реактор.
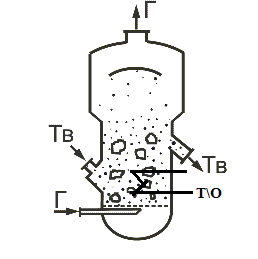
Рис. 2. Реактор с кипящим слоем колчедана
Воздух) подается снизу через распределительную решетку со скоростью, достаточной для взвешивания твердых частиц. Их витание в слое предотвращает слипание и способствует хорошему контакту их с газом, выравнивается температурное поле по всему слою, обеспечивает ся подвижность твердого материала и его переток в выходной патрубок для вывода продукта из реактора. В таком слое подвижных частиц можно расположить теплообменные элементы, причем коэффициент теплоотдачи от псевдоожиженного слоя сравним с теплоотдачей к кипящей жидкости. Тем самым обеспечено эффективные теплоотвод из зоны реакции, управление его температурным режимом и использование тепла реакции. Основной недостаток печей КС - повышенная запыленность обжигового газа из-за механической эрозии подвижных твердых частиц. Это потребует более тщательной очистки газа от пыли - в циклоне и электрофильтре.
Очистка газа после обжига
Газы обжига колчедана содержат в виде примесей соединения фтора, селена, теллура, мышьяка некоторые другие, образующиеся из примесей в сырье. Естественная влага сырья переходит также в газ. При горении образуется некоторое количество SO3, а также, возможно, оксиды азота. Эти примеси приводят или к коррозии аппаратуры, или к отравлению катализатора, а также сказываются на качестве продукта - серной кислоты. Очистку газа после обжига подробно не рассматриваем! На экзамене не будет.
Окисление диоксида серы. Физико-химические свойства процесса. Реакция
SO2
+ 1/2O2
![]() SO3 + Qр
SO3 + Qр
является каталитической, обратимой, экзотермической, протекает на катализаторе с уменьшением объема. Константа равновесия Кр пределяется из уравнения:
 (5)
(5)
где
![]() - парциальные давления соответствующих
компонентов в состоянии равновесия.
- парциальные давления соответствующих
компонентов в состоянии равновесия.
Равновесную степень превращения диоксида серы xр получим из стехиометрического уравнения и условия равновесия (5):
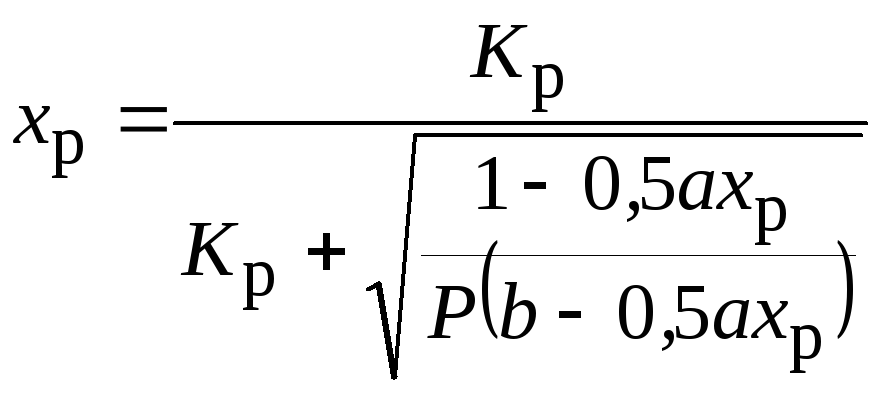 (6)
(6)
Выражение 1 - 0,5axp показывает относительное изменение (уменьшение) объема реакционной смеси. Уравнение (6) определяет xp в неявном виде и решается подбором или на компьютере. Зависимости Кр, xp от температуры, состава реакционной смеси и давления, состава газа показаны на рис.3. (см. лекцию «термодинамические закономерности»)
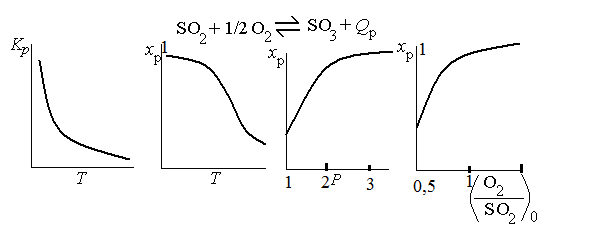
Промышленно нужные степени превращения (около 99%) достигаются при температурах 675-695 К. Давление не сильно влияет на xp. Поэтому в промышленности процесс проводят при давлении, близком к атмосферному.
Скорость реакции r описывается уравнением:
![]() (7)
(7)
где
k
= koexp(-E/RT)
- константа скорости реакции, A' = 0,8 -
константа,
![]() - парциальные давления соответствующих
компонентов, атм.
- парциальные давления соответствующих
компонентов, атм.
Для обсуждения и анализа удобно использовать более простой вид
r = (k1 + k 1) с0 (xp x), (8)
Из уравнений (7-8) видно, что с ростом температуры обе скобки справа ведут себя по разному. В итоге зависимость скорости от температуры проходит через max. (см. лекцию «кинетические закономерности»)

Рис. 4. Зависимость скорости реакции (а) и степени превращения (б) от температуры, x1 x2 x3 x4
Схема реакционного узла. В промышленности приближение к теоретической температуре Топт (ЛОТ) осуществляют в многослойном реакторе с адиабатическими слоями катализатора и промежуточным отводом тепла. Охлаждение между слоями осуществляют в теплообменниках или поддувом воздуха или холодного газа (обычно только первого слоя). Наиболее распространенная схема реактора показана на рис. 5.
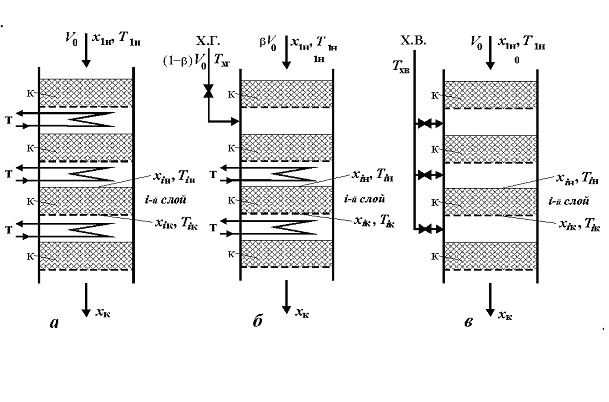
Рис. 5. Схемы многослойных реакторов окисления диоксида серы с адиабатическими слоями катализатора (к): а – с промежуточными теплообменниками (т); б – с вводом холодного газа (х.г.) после первого слоя и теплообменниками (т) после остальных слоев; в – с вводом холодного воздуха (х.в.)
На рис. 6 для варианта а изображены профили температуры и степени превращения по высоте реактора.
Рис.6. Графики хр –
равновесные степени превращения; Топт
– оптимальные емпературы; Реактор
– режим реактора окисления SO2:
1, 2, 3, 4 – слои катализатора; т.о.
– теплообменники
Абсорбция триоксида серы - последняя стадия процесса, в которой образуется серная кислота. Взаимодействие SO3 c H2O
SO3 + H2O = H2SO4 + Qр
протекает достаточно интенсивно как в жидкой, так и газообразной (паровой) фазах. Кроме того, H2SO4 может растворять в себе SO3, образуя олеум. Этот продукт удобен для транспортировки, поскольку он не вызывает коррозии даже обычных сталей. Растворы серной кислоты чрезвычайно агрессивны. Олеум является основным продуктом сернокислотного производства.
Физико-химические условия абсорбции.
Абсорбция триоксида серы водой описывается экзотермической гетерогенной реакцией газ–жидкость
SO3(г) + H2O(ж) = H2SO 4 + Qр
Реакция быстрая, процесс лимитируется диффузией триоксида серы из газовой фазы в жидкую. Вспомним рекомендации ПАХТ относительно влияния на скорость процесса абсорбции. Скорость записывается в виде:
![]() ,
,
Где
-коэффициент массообмена, F-поверхность
конткта фаз,
![]() и
и
![]() -парциальные
давления SO3 в газовом
потоке и равновесное значение над
раствором жидкости. Видно, что чем больше
, F и разность
парциальных давлений (движущая сила)
тем больше скорость. Практически это
означает, что в абсорбере надо обеспечить
хорошие скорости движения контактирующих
фаз (турбулентность), использовать
насадку для развития поверхности
контакта, снижать температуру, что
приводит кувеличению растворимости
газа в жидкости и снижению при этом
-парциальные
давления SO3 в газовом
потоке и равновесное значение над
раствором жидкости. Видно, что чем больше
, F и разность
парциальных давлений (движущая сила)
тем больше скорость. Практически это
означает, что в абсорбере надо обеспечить
хорошие скорости движения контактирующих
фаз (турбулентность), использовать
насадку для развития поверхности
контакта, снижать температуру, что
приводит кувеличению растворимости
газа в жидкости и снижению при этом
![]() .
Чтобы минимизировать
.
Чтобы минимизировать
![]() есть еще один важный прием. Посмотрим
на фазовую диаграмму тройной системы
H2O -
H2SO4-
SO3.
есть еще один важный прием. Посмотрим
на фазовую диаграмму тройной системы
H2O -
H2SO4-
SO3.
Фазовая диаграмма тройной системы H2O - H2SO4- SO3 представлена на рис. 7

Рис. 7 Фазовая диаграмма тройной системы H2O - H2SO4- SO3
Что мы видим. В паровой фазе левой части графика над раствором серной кислоты присутствуют практически пары воды, реакция поглощения триоксида серы будет протекать в паровой фазе с образованием тумана серной кислоты, который уйдет из абсорбера с газовой фазой.
В паровой фазе левой части графика присутствует практически чистый триоксид серы, который затрудняет абсорбцию триоксида серы из газового потока. В азеотропной точке А в паровой фазе присутствует только кислота и нет SO3, что обеспечивает максимальную движущую силу процесса.
Минимальное содержание воды в паровой фазе наблюдается в азеотропной точке при значении концентрации серной кислоты 98,3 % и образование паров серной кислоты будет минимальным, а абсорбция триоксида серы будет наиболее полной.
Чтобы обеспечить нужную концентрацию H2SO4 в поглощающей жидкости, организована ее интенсивная циркуляция, так что поглощение осуществляется при концентрации H2SO4 98,3 %. Вследствие большого орошения в абсорбере увеличение концентрации за проход жидкости составляет не более 1-1,5%. Все рассмотренные выше условия обеспечивают полное поглощение SO3 и минимальное образование сернокислотного тумана (т.е. решаются концепции ресурсосбережения и минимизации отходв)

Рис.8. Схема абсорбции
Схема абсорбции приведена на рис.3. (Та же схема, которую вы рассчитывали на семинаре).
К сожалению, из-за того, что реакция окисления диоксида серы –обратимая, она не протекает на 100%. Рассмотренные выше мероприятия позволяют достичь степени превращения SO2 не выше 98-98,5%. Возможность снижения температуры ограничена активностью имеющихся катализаторов, увеличение давления усложняет инженерное оформление процесса, и потому эти методы пока не получили промышленного применения. Количество выбрасываемого в атмосферу SO2 составляет 10-15 т в сутки. В атмосфере SO2 может окисляться до SO3 под действием солнечной энергии и частиц пыли как катализатора (например, оксиды железа – хорощий катализатор окисления, применявшийся в промышленности).
Этого нельзя допустить. Надо искать решения этой экологической проблемы. Кроме температуры, давления, концентрации есть еще один способ сдвига реакции вправо- это удаление продукта реакции. Предлагается на каком-то этапе протекания реакции, удалить из реакционной смеси образовавшийся SO3 а оставшуюся реакционную смесь направить на повторное окисление остатков SO2. В результате была разработана и действует в настоящее время:
Система двойного контактирования и двойной абсорбции (ДК/ДА)..
Итак, эффективным способом увеличения степени превращения в обратимой реакции является удаление ее продукта. Функциональная схема такого способа показана на рис. 9. Подсистема получения сернистого газа (обжиг серосодержащего сырья) принципиально не меняется. Полученный сернистый газ частично окисляется в первом реакторе, после чего в первой (промежуточной) ступени абсорбции из него удаляется SO3. Далее оставшийся SO2 окисляется во втором реакторе, и газ направляется на вторую абсорбцию. В отсутствие SO3 окисление SO2 во втором реакторе будет более полным. Каждый реактор состоит из адиабатических слоев катализатора с промежуточными теплообменниками подобно реакторам в схеме одинарного окисления (рис. 5).
В этой схеме реакционную смесь приходится нагревать дважды - в первом реакторе от 320 К до температуры перед первым слоем 690 К и после его охлаждения до 320-340 К для промежуточной абсорбции SO3 - перед вторым реактором. Нагрев осуществляется за счет тепла реакции. Но во второй ступени окисляется низкоконцентрированный газ, тепла реакции выделяется мало и для нагрева реакционной смеси необходимы теплообменники с большой поверхностью. Увеличить общее количество выделяемого тепла можно за счет увеличения начальной концентрации SO2. Поэтому в системах ДК/ДА используют газ, содержащий не. менее 10% SO2. Во избежание перегрева катализатора в первом слое температура на входе не должна превышать 695К (см. выше о выборе начальной концентрации), для чего используют низкотемпературные катализаторы.
Технологическая схема стадий окисления и абсорбции в системе ДК/ДА представлена на рис. 9.

Рис. 4. Технологическая схема контактного отделения окисления SO2 и абсорбции SO3 по методу ДК/ДА: 1к, 2к – контактные аппараты (реакторы); 1а, 2а – абсорберы; Т – теплообменники
На первой ступени окисления использован трехслойный реактор 1к,. Концентрация SO2 в поступающем газе - 9,5-10,5%. Степень превращения на выходе из реактора 90-95%. Промежуточная абсорбция SO3 идет в включает абсорбер 1а,. После него газ содержит только 0,6-1%. Поскольку во второй ступени тепла выделяется мало (из-за низкой концентрации SO2), для нагрева газа до температуры реакции используют теплообменник после второго слоя реактора 2к. Степень превращения оставшегося SO2 составляет примерно 95%, общая степень превращения - 99,6-99,8%. В этой схеме реакционную смесь приходится нагревать дважды сначала до температуры реакции перед головным слоем первого реактора, и после его охлаждения, что необходимо для промежуточной абсорбции SO3 перед вторым реактором. Нагрев осуществляется за счет тепла реакции (прием, который называется регенерация тепла).
