
- •Лекция 7. Химические процессы и реакторы Виды химических реакторов
- •4.2. Процесс в химическом реакторе
- •4.2.1. Математическая модель процесса в химическом реакторе
- •4.2.2. Анализ процесса в химическом реакторе
- •4.3. ИзотермическиЙ процесс в химическОм реакторЕ
- •4.3.1. Режимы идеального смешения периодический и идеального вытеснения
- •4.3.2. Режим идеального смешения в проточном реакторе
- •4.3.3. Сопоставление непрерывных процессов в режимах идеального смешения и вытеснения
- •4.4. Неизотермический процесс в химическом реакторе
- •4.4.1. Режимы идеального смешения периодический и идеального вытеснения с теплообменом
- •Температурный режим в проточном реакторе идеального смешения
- •Сопоставление адиабатического процесса в проточных режимах идеального смешения и вытеснения и выбор эффективного ректора при протекании простых реакций аr q
- •Каскад ректоров ис (к-ис)
- •Состав и структура химико-технологической системы
- •Элементы хтс
- •Состояние хтс синтез и анализ хтс
- •Основы разработки эффективных хтс
- •Задачи синтеза и анализа хтс
- •Лекция 12
- •Анализ хтс
- •Основы расчёта материального баланса химико-технологической системы
- •1. Общий вид уравнений материального баланса
- •2. Химико-технологическая система и её расчётная схема
- •2.1. Материальный баланс элементов хтс
- •2. Общий вид уравнений теплового (энергетического) баланса
- •3. Форма представления материального баланса
- •1. Концепция полного использования сырьевых ресурсов
- •7) Комбинирование производств
- •2. Концепция полного использования энергетических ресурсов
- •4) Вторичные энергетические ресурсы
- •5). Энерго-технологическая система
- •3. Концепция минимизации отходов
- •4. Концепция эффективного использования оборудования
- •6) Совмещение процессов
- •7) Перестраиваемые (гибкие) химико-технологические системы
- •12.05.20. Лекция 14. ОПтимальные схемы реакторов ив и ис
- •5.6.1. Система химических реакторов
- •Примеры построения эффективных химических производств
- •Производство серной кислоты
- •Хтс производства азотной кислоты
2. Химико-технологическая система и её расчётная схема
Химико-технологическая система представляет собой совокупность аппаратов и потоков между ними. Например, на рис. 1. показана схема ХТС, состоящая из двух реакторов Р1 и Р2 и устройства разделения Д продуктов превращения.

Рис. 1. Схема химико-технологической системы
В системе можно выделить совокупность аппаратов подсистему, например, реакторный узел (обведен пунктирной линией a). Отдельный аппарат или подсистему будем называть "расчётным элементом ХТС" или просто элементом. В элемент входят потоки ("входные потоки") и выходят их него ("выходные потоки"). Расчётным элементом может быть ХТС в целом (обведён пунктирной линией b). В выделенном элементе входные потоки преобразуются в выходные в результате протекания химических превращений, массообменных и других процессов.
М атериальный
баланс может быть составлен для любого
элемента -
каждого аппарата, подсистемы или ХТС
в целом.
атериальный
баланс может быть составлен для любого
элемента -
каждого аппарата, подсистемы или ХТС
в целом.
Рис. 2. Расчётные элементы ХТС:
а смеситель, b делитель, с реактор
Для составления балансов удобно выделить элементы так, чтобы в каждом из них входило и выходило не более 3-х потоков. Тогда можно рассмотреть следующие элементы (рис. 2):
Смеситель (a). Входят два потока и выходит один. В элементе происходит простое смешение потоков.
Делитель (b). Входит один поток и выходят два. Если происходит только разветвление потока, делитель называют простым, покомпонентный составы входящих и выходящих потоков не меняются. В таких процессах, как испарение, ректификация, абсорбция, фильтрация, составы входящих и выходящих потоков различаются, и такой элемент называют делителем пропорциональным.
Реактор (c). Проходит один поток, но его компонентный состав принципиально меняется вследствие протекающих в элементе химических превращений. Элементом "реактор" может быть как отдельный аппарат, так и подсистема из нескольких аппаратов, в которых протекают химические превращения.
Из описанных элементов можно составить расчетную схему ХТС, что особенно удобно при автоматизированном расчете материальных балансов. В представленных далее примерах и задачах будут использованы методы составления материального баланса для указанных видов расчетных элементов ХТС.
2.1. Материальный баланс элементов хтс
Смеситель ( а) объединяет два потока:
G3 = G1 + G2 (4)
Gi,3 = Gi,1+ Gi,2 i = 1, ..., B (5)
Здесь индексы 1 и 2 относятся к двум входным потокам, индекс 3 – к выходному; индекс i нумерация компонентов потока; В – число компонентов.
Концентрации компонентов – их массовые доли в выходящем потоке:
gi,3
=
![]() (1.6)
(1.6)
Для баланса можно использовать мольные потоки М, а если смешиваются газы или жидкости, то объёмы потоков V;
M3
= M1
+
M2,
Mi,3
= Mi,1+
Mi,2,
ni,3
=
![]() ,
i
= 1, ..., B (1.7)
,
i
= 1, ..., B (1.7)
V3
= V1
+
V2,
Vi,3
= Vi,1+
Vi,2,
ci,3
=
![]() ,
i
=
1, ..., B
,
i
=
1, ..., B
где ni и ci концентрации компонентов, соответственно, в мольных и объёмных долях.
Делитель простой (b) разделяет поток на два или более потоков без изменения состава. Допустим, что один из двух выходящих из делителя потоков (пусть это будет 2-й поток) составляет долю входного потока:
G2 = G1, G3 = (1 )G1 (8)
Тогда все компоненты разделятся по потокам:
Gi,2 = Gi,1, Gi,3 = (1 )Gi,1 i = 1, ..., B (9)
Концентрации компонентов в потоках на выходе из простого делителя не изменяются. Аналогичные балансовые уравнения можно получить, если использовать мольные или объёмные потоки.
Реактор (с) осуществляет химическое превращение во входящем потоке и принципиально меняет его состав. Изменение химического состава реагирующей смеси описывается стехиометрическими уравнениями, которые показывают, в каких соотношениях вещества вступают в реакцию и определяют количественные изменения состава реакционной смеси.
Простая реакция будет описываться одним стехиометрическим уравнением:
AA + BB + … = RR + SS + …+ Qp(-Hp), (13)
Стехиометрические коэффициенты A, B, R, S показывают число молей соответствующих веществ, вступивших и образовавшихся в ходе реакции. Соотношение между количествами превращённых веществ N, также выраженных в молях,
 (14)
(14)
где NA, NB – количества израсходованных исходных веществ А и В; NR, NS – количества образовавшихся веществ R и S.
Если реакция протекает в газовой фазе без изменения объёма, концентрация выражена в мольных, объёмных долях или парциальных давлениях используют также изменение концентраций реагирующих веществ:
 (15)
(15)
Зная количество одного из веществ после химического превращения, можно определить, как мы уже знаем, количества всех компонентов смеси. Например, если NA – количество оставшегося исходного вещества, то
Ni
= Ni,0
![]() (NA,0
– NA), или
(16)
(NA,0
– NA), или
(16)
 (17)
(17)
Знак "" для продукта реакции, знак "+" для исходного вещества. Напомню, что для исходных веществ стехиометрические коэффициенты принимаются отрицательными, а для продуктов – положительными.
Степень превращения исходного вещества (например, А) – доля его количества, вступившего в реакцию:
 ,
(18)
,
(18)
где NA,0, NA – количество вещества А до и после превращения.
Зная количество хотя бы одного компонента на выходе из реактора или степень превращения исходного компонента, можно определить по уравнениям состояние выходного потока – количества и концентрации всех веществ.
Сложная реакция описывается несколькими стехиометрическими уравнениями. Их называют частными реакциями.
В сложной схеме превращений одна из реакций приводит к образованию полезного продукта, например, R. Другие реакции – побочные, без образования нужного продукта. Для более простого изложения характеристик сложной реакции представим её системой стехиометрических уравнений, в которых:
левая часть содержит одно и то же исходное вещество;
правая часть только одного уравнения содержит полезный продукт.
Например:
A + B = R x1
x= x1 + x2 (19)
A + C = S x2
Вводится степень превращения исходного вещества в каждом стехиометрическом уравнении. В примере показаны x1 и x2 – степени превращения исходного вещества А в каждой реакции и x – общая степень превращения вещества А. Задавшись степенью превращения xА,j исходного вещества А в каждом стехиометрическом уравнении, определим количества всех компонентов:
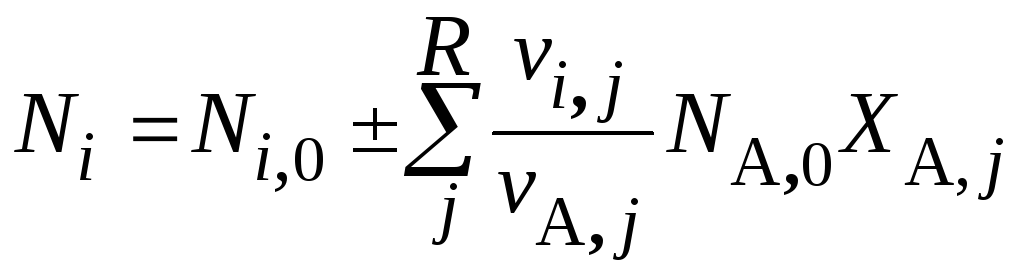 , (20)
, (20)
где i,j – стехиометрический коэффициент i-го вещества в j-ой реакции (см. лекцию, раздел «стехиометрические соотношения» или семинар от 14.02.20).
Напомню, для сложных реакций вводятся следующие показатели.
Выход продукта – доля всего количества исходного вещества, превратившаяся в данный продукт. Полагая, что А исходное вещество, выход ER по продукту R:
 (21)
(21)
В примере (19) ER = x1.
Селективность (избирательность) по продукту доля превратившегося количества исходного вещества в данный продукт. Полагая, что А исходное вещество, селективность SR по продукту R:
 (22)
(22)
В примере (19) SR = x1/x.
Для простой реакции SR = 1 и для любого i-го продукта Еi = x. Для сложной реакции ER = SRx.
Таким образом, задавая степени превращения xA,j исходного вещества А во всех стехиометрических уравнениях сложной реакции, можно определить количества Ni всех компонентов в прореагировавшей смеси, выходы продуктов Ei и селективность процесса по продуктам SR.
Стехиометрические уравнения с "массовыми" стехиометрическими коэффициентами. В расчетах материального баланса реакционного элемента используют и другие формы записи химических превращений. Стехиометрические коэффициенты в химических уравнениях показывают количества компонентов, вступающих в химическое взаимодействие. Традиционно эти количества измеряют в молях. Но можно стехиометрические коэффициенты выразить в массовых величинах, умножив "мольные" коэффициенты на мольную массу. На пример, в "мольном" выражении стехиометрических коэффициентов окисление диоксида серы выглядит так:
SО2 + 1/2 О2 = SО3.
Мольные массы SО2 - 64, О2 - 32, SО3 - 80, и это же уравнение с "массовыми" стехиометрическими уравнениями будет выглядеть так:
64SО2 + 16О2 = 80SО3
В такой записи очевиден материальный баланс: суммарная масса исходных веществ равна массе продукта. Формулы (5.6)-(5.7), (5.9)-(5.10) также можно использовать с "массовыми" стехиометрическими коэффициентами. Естественно, что и другие переменные в них также имеют "массовую" размерность (количества веществ G, а не N, концентрации g, а не С, и другие). Используя уравнение (5.6) с "массовыми" стехиометрическими коэффициентами ij, можно сразу получить массовый баланс в реакционном элементе.
Суммарное (брутто-) стехиометрическое уравнение. В ряде случаев необходимо получить материальный баланс подсистемы и даже ХТС в целом, где протекают последовательно ряд превращений. Рассмотрим пример: в производстве азотной кислоты определить количество НNО3, образующейся из 1 тонны аммиака. В химико-технологическом процессе протекают следующие реакции:
окисление аммиака
4NН3 + 5О2 = 4NО + 6Н2О (23)
(для простоты объяснения полагаем, что NН3 полностью окисляется до NО),
окисление оксида азота
2NО + О2 = 2NО2 (24)
абсорбция диоксида азота
3NО2 + Н2О = 2НNО3 + NО (25)
В абсорбционную колонну подается кислород, и образующийся оксид азота повторно окисляется до NО2 по реакции (24). Таким образом, образование азотной кислоты представлено стехиометрическими уравнениями (23-25). Умножим первое из них на 1, второе - на 3, третье - на 2 и сложим их. Получим суммарное стехиометрическое уравнение (брутто-уравнение)
4NН3 + 8О2 = 4НNО3 + 4Н2О (26)
Конечно, такая реакция неизвестна. Но стехиометрическое уравнение показывает, в каких соотношениях реагенты вступают во взаимодействие друг с другом не зависимо от схемы превращений, и этому определению отвечает уравнение (5.14). Из него сразу получаем, что 1 моль НNО3 образуется из одного моля аммиака и двух молей кислорода.
Умножим стехиометрические коэффициенты в (5.14) на мольные массы соответствующих компонентов (NН3 - 17, О2 - 32, НNО3 - 63, Н2О - 18) и получим
68NН3 + 256О2 = 252НNО3 + 72Н2О
Из этого уравнения видно, что для производства 252 кг НNО3 надо затратить 68 кг NН3, а на 1т (1000 кг) НNО3 пойдет 681000/252 = 270 кг аммиака. Удобство записи суммарного (брутто-) стехиометрического уравнения очевидно.
