
- •Лекция 7. Химические процессы и реакторы Виды химических реакторов
- •4.2. Процесс в химическом реакторе
- •4.2.1. Математическая модель процесса в химическом реакторе
- •4.2.2. Анализ процесса в химическом реакторе
- •4.3. ИзотермическиЙ процесс в химическОм реакторЕ
- •4.3.1. Режимы идеального смешения периодический и идеального вытеснения
- •4.3.2. Режим идеального смешения в проточном реакторе
- •4.3.3. Сопоставление непрерывных процессов в режимах идеального смешения и вытеснения
- •4.4. Неизотермический процесс в химическом реакторе
- •4.4.1. Режимы идеального смешения периодический и идеального вытеснения с теплообменом
- •Температурный режим в проточном реакторе идеального смешения
- •Сопоставление адиабатического процесса в проточных режимах идеального смешения и вытеснения и выбор эффективного ректора при протекании простых реакций аr q
- •Каскад ректоров ис (к-ис)
- •Состав и структура химико-технологической системы
- •Элементы хтс
- •Состояние хтс синтез и анализ хтс
- •Основы разработки эффективных хтс
- •Задачи синтеза и анализа хтс
- •Лекция 12
- •Анализ хтс
- •Основы расчёта материального баланса химико-технологической системы
- •1. Общий вид уравнений материального баланса
- •2. Химико-технологическая система и её расчётная схема
- •2.1. Материальный баланс элементов хтс
- •2. Общий вид уравнений теплового (энергетического) баланса
- •3. Форма представления материального баланса
- •1. Концепция полного использования сырьевых ресурсов
- •7) Комбинирование производств
- •2. Концепция полного использования энергетических ресурсов
- •4) Вторичные энергетические ресурсы
- •5). Энерго-технологическая система
- •3. Концепция минимизации отходов
- •4. Концепция эффективного использования оборудования
- •6) Совмещение процессов
- •7) Перестраиваемые (гибкие) химико-технологические системы
- •12.05.20. Лекция 14. ОПтимальные схемы реакторов ив и ис
- •5.6.1. Система химических реакторов
- •Примеры построения эффективных химических производств
- •Производство серной кислоты
- •Хтс производства азотной кислоты
2. Общий вид уравнений теплового (энергетического) баланса
В основу энергетического) баланса положен закон сохранения энергии, согласно которому приход тепла или энергии в данном процессе равен его расходу в том же процессе (т.е. как и в материальном балансе, приход равен расходу). В общем виде:
![]() (27)
(27)
Для каждого элемента или подсистемы ХТС, в которой протекают экзо-эндотермические процессы:
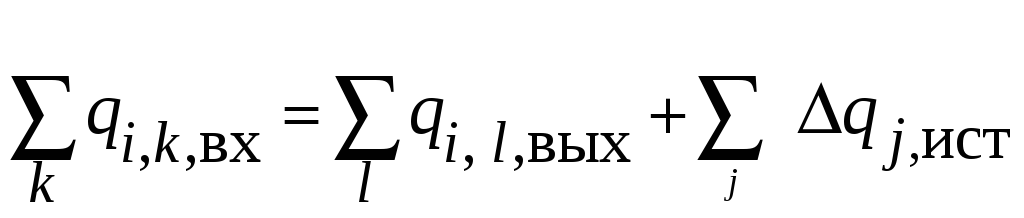 (28)
(28)
В этих уравнениях
![]() и
и
![]() входные
и выходные потоки (внешние потоки),
входные
и выходные потоки (внешние потоки),
![]()
энергетические
потоки (источники),
обусловленные протекание в системе
процессов с тепловыми эффектами, главным
образом, химические превращения.
энергетические
потоки (источники),
обусловленные протекание в системе
процессов с тепловыми эффектами, главным
образом, химические превращения.
Теплота, выделившаяся
в реакции, зависит от ее теплового
эффекта Qp
и глубины протекания реакции - степени
превращения x
исходного компонента. В уравнении (13)
стехиометрический коэффициент перед
А равен A
и qp
= QpxA/A
(кДж/моль).
Для сложной реакции
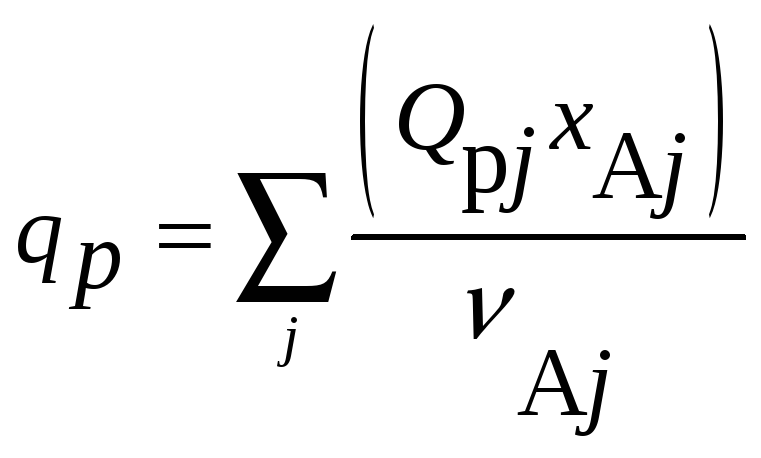 (индекс j
относится к j-му
стехиометрическому уравнению).
(индекс j
относится к j-му
стехиометрическому уравнению).
j относится к j-му стехиометрическому уравнению).
Используемые в
справочниках значения сp
и Qp - удельные, относящиеся к
единице количества вещества. Теплоемкость
смеси ср - аддитивное
свойство теплоемкостей составляющих
ее компонентов срi:
![]()
где Сi
концентрации компонентов.
где Сi
концентрации компонентов.
Можно принять, что
изменение Т мало отражается на
величине Hp
(и Qp соответственно). Это
обусловлено возрастанием энтальпии
как исходных веществ, так и продуктов
реакции. Допущение Hp
const означает также
малое влияние температуры на разность
тепловых емкостей (произведение Gcр)
исходной и прореагировавшей реакционной
смеси. Тепловая емкость смеси в большинстве
случаев меняется менее, чем на 10 %. Можно
принять средние значения Hp
(Qp) и cр =
![]() (удельной теплоемкости) в рабочем
температурном интервале и использовать
уравнения:
(удельной теплоемкости) в рабочем
температурном интервале и использовать
уравнения:
С учетом приведенных рассуждений и сделанных замечаний уравнение теплового баланса будет иметь следующие составляющие:
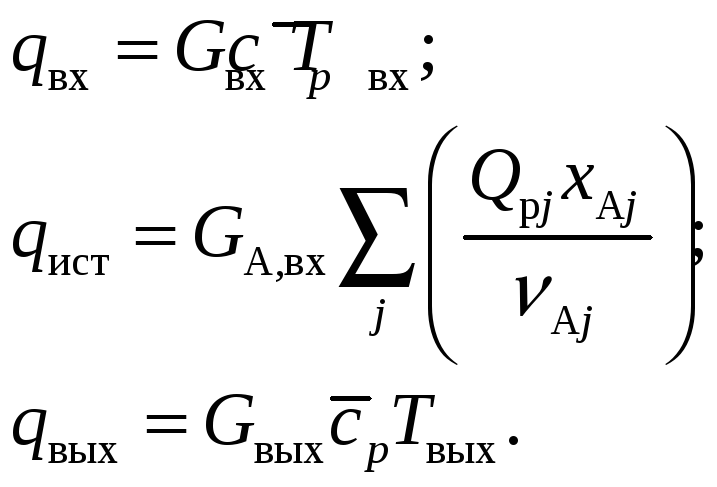 (29)
(29)
Приведем пример приближенного расчета температуры на выходе сложного по схеме реакторного узла окисления диоксида серы - рис. 3. Реакционная смесь с начальной концентрацией SO2 С0 и объемным расходом V проходит последовательно ряд теплообменников и слои катализатора, где проходит окисление. Известны температура и степени превращения
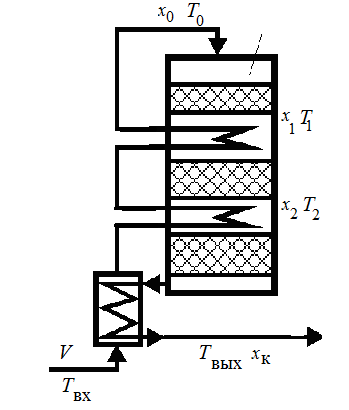
Рис.3 Реакционный узел (подсистема) окисления SO2
в каждом слое. Расчет температурного режима всех потоков весьма громоздкая задача. Расчет температуры только выходящего потока Твых проведем, используя балансовое уравнение (27) и (28). Для этого поместим реакционный узел в «оболочку» и будем считать его "расчётным элементом ХТС", не вникая в параметры состояния потоков, которые циркулируют внутри него. Реакция протекает с малым изменением объема реакционной смеси (несколько процентов), потоки газофазные, Составим уравнение теплового баланса для этого расчётного элемента:
VcpTвх + QрVC0хк = VcрTвых.
Здесь входящий
поток SO2
![]() ;
хк – конечная степень
превращения в реакторе (на выходе из
последнего слоя катализатора).
;
хк – конечная степень
превращения в реакторе (на выходе из
последнего слоя катализатора).
После очевидного преобразования получим
Твых = Твх + (QрC0/cр)хк
или
Твых = Твх + Тад хк
Разогрев реакционной смеси, несмотря на сложность внутренней структуры реакционного узла, равен адиабатическому разогреву.
Для других источников, не связанных с химическими реакциями, например фазовые превращениями (испарение, конденсация, плавление, сублимация, а также растворение):
![]() ,
(30)
,
(30)
где Gi - количество i-го компонента, изменившего свое фазовое состояние в j-м процессе; i - его доля от общего количества Gi; qфп - удельная теплота фазового превращения.
