
- •Лекция 7. Химические процессы и реакторы Виды химических реакторов
- •4.2. Процесс в химическом реакторе
- •4.2.1. Математическая модель процесса в химическом реакторе
- •4.2.2. Анализ процесса в химическом реакторе
- •4.3. ИзотермическиЙ процесс в химическОм реакторЕ
- •4.3.1. Режимы идеального смешения периодический и идеального вытеснения
- •4.3.2. Режим идеального смешения в проточном реакторе
- •4.3.3. Сопоставление непрерывных процессов в режимах идеального смешения и вытеснения
- •4.4. Неизотермический процесс в химическом реакторе
- •4.4.1. Режимы идеального смешения периодический и идеального вытеснения с теплообменом
- •Температурный режим в проточном реакторе идеального смешения
- •Сопоставление адиабатического процесса в проточных режимах идеального смешения и вытеснения и выбор эффективного ректора при протекании простых реакций аr q
- •Каскад ректоров ис (к-ис)
- •Состав и структура химико-технологической системы
- •Элементы хтс
- •Состояние хтс синтез и анализ хтс
- •Основы разработки эффективных хтс
- •Задачи синтеза и анализа хтс
- •Лекция 12
- •Анализ хтс
- •Основы расчёта материального баланса химико-технологической системы
- •1. Общий вид уравнений материального баланса
- •2. Химико-технологическая система и её расчётная схема
- •2.1. Материальный баланс элементов хтс
- •2. Общий вид уравнений теплового (энергетического) баланса
- •3. Форма представления материального баланса
- •1. Концепция полного использования сырьевых ресурсов
- •7) Комбинирование производств
- •2. Концепция полного использования энергетических ресурсов
- •4) Вторичные энергетические ресурсы
- •5). Энерго-технологическая система
- •3. Концепция минимизации отходов
- •4. Концепция эффективного использования оборудования
- •6) Совмещение процессов
- •7) Перестраиваемые (гибкие) химико-технологические системы
- •12.05.20. Лекция 14. ОПтимальные схемы реакторов ив и ис
- •5.6.1. Система химических реакторов
- •Примеры построения эффективных химических производств
- •Производство серной кислоты
- •Хтс производства азотной кислоты
Лекция 7. Химические процессы и реакторы Виды химических реакторов
Химический реактор - устройство, предназначенное для проведения в нем химических превращений.
Общий вид реактора и схемы некоторых из них приведены на рис. 4.1.
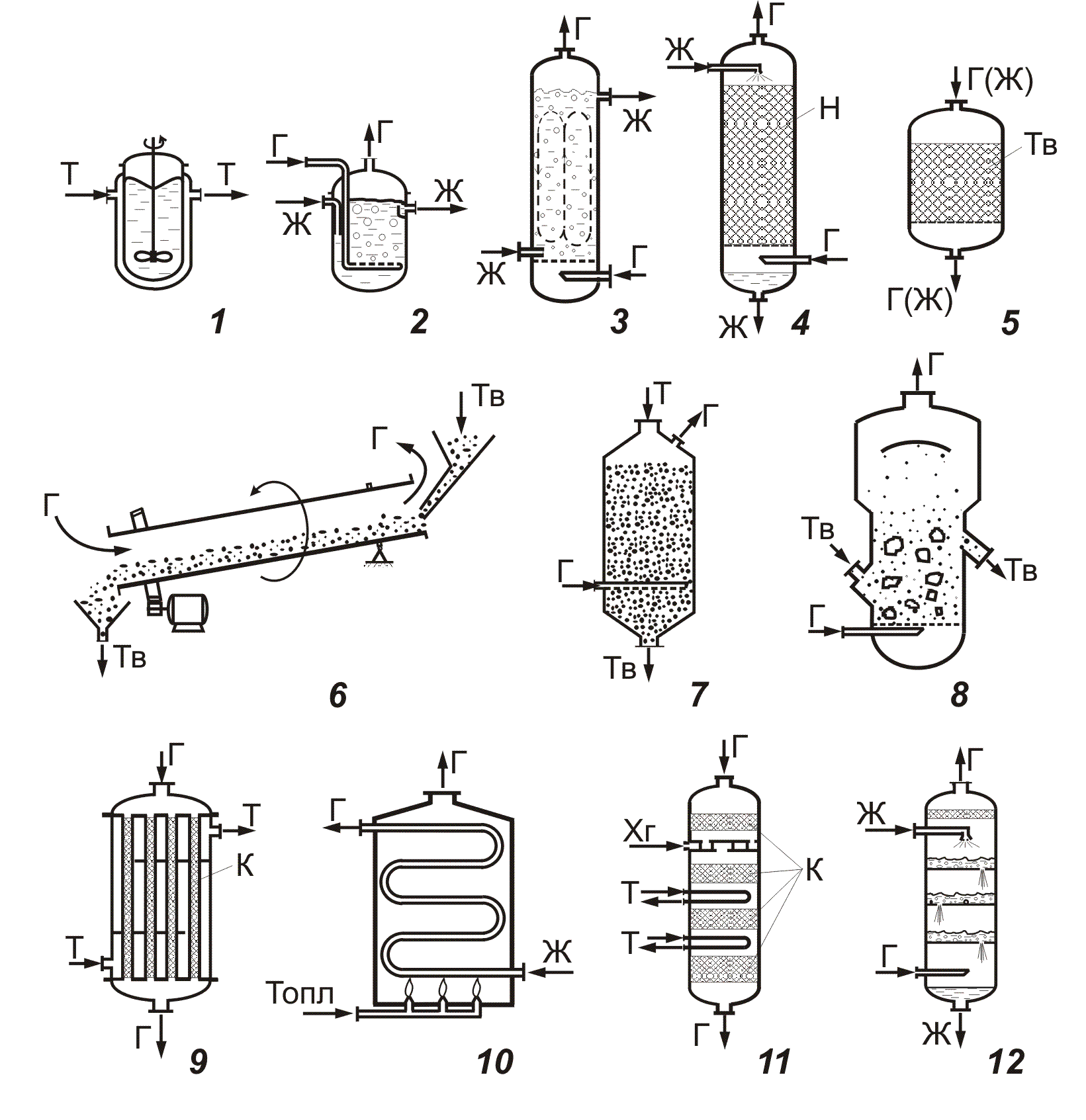
Рис. 4.1. Схемы химических реакторов:
1,2 – емкостной; 3 – колонный; 4 – насадочный; 5-8 для систем Г – ТВ; 9, 10 – трубчатый; 11, 12 - многослойный реактор Г - газ; Ж - жидкость; Т - теплоноситель; Н - насадка; Тв - твердый реагент; К - катализатор; Хг - холодный газ; Топл – топливо.
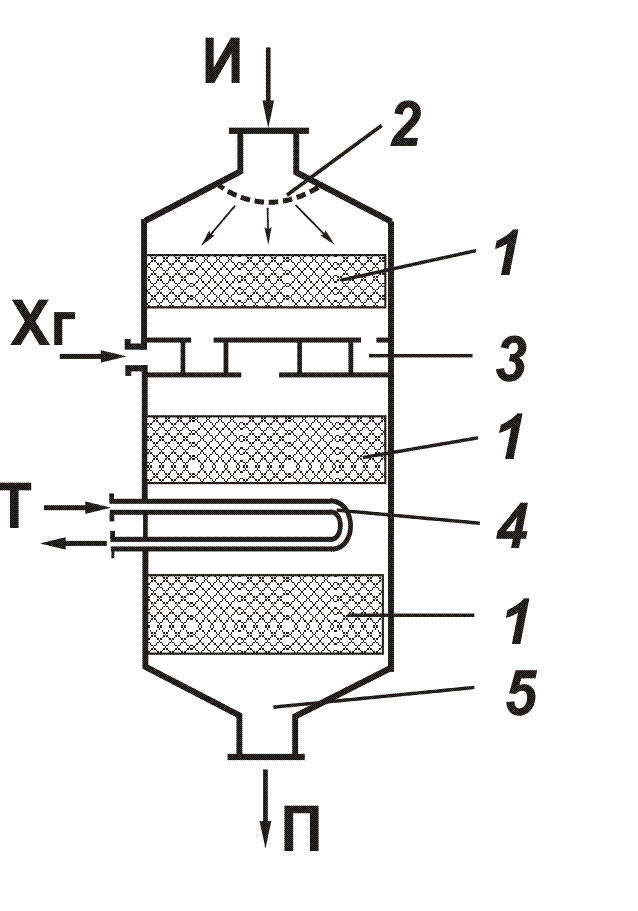
Рис. 4.2. Структурные элементы химического реактора:
1 - реакционная зона; 2 - входное и распределительное устройство; 3 - смеситель, 4 - теплообменник, 5 - выходное устройство; Хг - холодный газ; Т - теплоноситель; И и П - исходный и конечный продукты соответственно
Для всех реакторов характерны общие структурные элементы, представленные на рис. 4.2.
4.2. Процесс в химическом реакторе
4.2.1. Математическая модель процесса в химическом реакторе
Математическая модель процесса в химическом реакторе выглядит следующим образом:
dN/dt = Nвх/вых + Nист; (4.1)
dq/dt = Qвх/вых + Qист. (4.2)
Здесь dN/dt и dq/dt - накопление вещества и теплоты в выделенном элементарном объеме; Nвх/вых, Qвх/вых - материальные и тепловые потоки, входящие в выделенный объем и выходящие из него (покидающие объем потоки имеют отрицательное значение); Nист, Qист - источники вещества и тепла внутри выделенного объема. Источником вещества является химическая реакция, источником тепла - химическая реакция и фазовые превращения.
Периодический процесс в реакторе 1 на рис. 4.1. Все компоненты загружаются одновременно. Засчет интенсивного перемешивания концентрации и температуры в каждый момент времени одинаковы по всему объему vp реакционной зоны (реактора). Обозначим температуру теплоносителя - ТX, площадь поверхности теплообмена - FT, коэффициент теплообмена - КT. Схема процесса в таком реакторе представлена на рис. 4.3, а.
Процесс - нестационарный. В реакторе нет входящих и выходящих потоков и Nвх/вых = 0. Источником i-го вещества является химическое превращение: Nист,i = Wi(С, Т)vp.
dNi/dt = Niвх/вых +Niист;
dNi/dt = 0 +Wi(С, Т)vp.
Количество вещества в реакторе Ni = vpСi, тогда уравнение (4.1) принимает вид:
dСi/dt = Wi(С, Т); (4.3)
С = Сi0 при t = 0.
Источник теплоты – тепловой эффект химического превращения (для единственной реакции Qист = QPr(С, Т)vp) и теплобмен с теплоносителем КTFT(ТX - Т).
dq/dt = Qвх/вых +Qист;
dq/dt = 0 + QPr(С, Т)vp + КTFT(ТX - Т).
Изменение количества теплоты в реакторе: dq = сpvpdТ (теплоемкость сp неизменна), удельная поверхность теплообмена: Fуд = FT/vp. Уравнение (4.2) принимает вид:
сpdТ/dt = QPr(С, Т) - КTFуд(Т - ТX); (4.4)
при t = 0 Т = Т0.
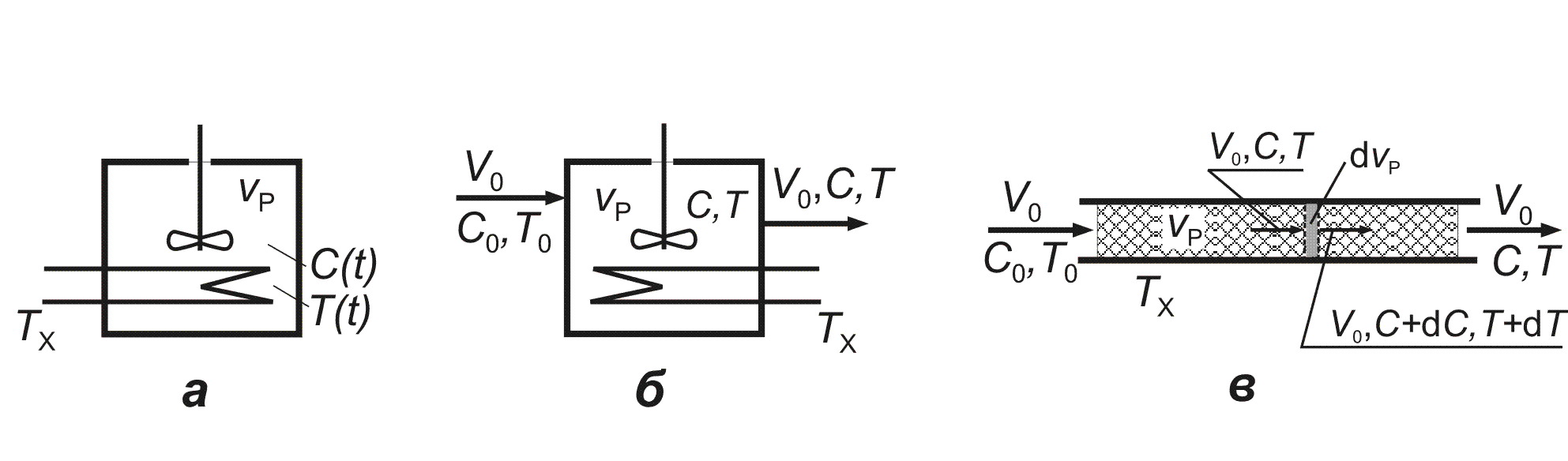
Рис. 4.3. Схемы реакторов:
а - в режиме идеального смешения периодическом (ИС-п); б – в режиме идеального смешения проточном, или непрерывном (ИС-н); в - идеального вытеснения (ИВ). Пояснения см. в тексте
Такой процесс и описывающие его уравнения называют режимом (моделью) идеального смешения периодическим - ИС-п.
Процессы в реакторах типа 2, 3, 8 и в реакционной зоне реактора 12 на рис. 4.1. Схема процесса представлена на рис. 4.3, б. Рассматривается процесс в одной, интенсивно перемешиваемой, фазе. Реактор проточный, процесс стационарный (dNi/dt = 0 и dq/dt = 0). В единицу времени в реактор входит поток реагентов объемом V0, содержащий компоненты в количестве V0Сi0. Температура во входном потоке - Т0. Объем реакционной смеси не меняется. Из реактора выходит поток V0 с температурой Т с содержанием каждого компонента - V0Сi. Элементарный объем – вся реакционная зона. Источник веществ - химическое превращение: Ni,ист = Wi(С, Т)vp.
dNi/dt =Niвх/вых + Niист;
0=V0Сi0 - V0Сi+ Wi(С, Т)vp.
Определим отношение vp/V0 = - как условное время реакции. Уравнение (4.1) примет вид:
(Сi - Сi0)/ = Wi(С, Т). (4.5)
Используя приведенные ранее выражения для источника теплоты, теплообмена, условного времени реакции и удельной поверхности теплообмена, преобразуем уравнение (4.2):
dq/dt =Qвх/вых+Qист;
0= V0сpТ0 - V0сpТ + QPr(С, Т)vp + КTFT(ТX - Т);
сp.(Т - Т0)/ = QPr(С, Т) – КTFуд(Т - ТX). (4.6)
Такой процесс и описывающие его уравнения называют режимом (моделью) идеального смешения непрерывным - ИС-н.
Процессы в реакторах 47, 911 на рис. 4.1 – протекают непрерывно. Поток течет через реактор без перемешивания. Профиль скорости по сечению – плоский. Такой режим потока называют поршневым, или идеального вытеснения. Реактор представим в виде трубки сечением S, через который проходит поток величиной V0 - рис. 4.3, в. Выделим элементарный объем (рис. 4. 3, в) - участок толщиной dl и объемом dvp = Sdl. В него с потоком входит компонент i в количестве V0Сi и выходит V0(Сi + dСi). Источник вещества в выделенном объеме - химическое превращение Nист,i = Wi(С, Т)dvp.
dNi/dt =Niвх/вых+ Niист;
0= V0Сi - V0(Сi + dСi) + Wi(С, Т)dvp.
Процесс стационарный, объем реакционной смеси не меняется, и уравнение (4.1) примет вид:
dСi/d = Wi(С, Т); (4.7)
С = Сi0 при = 0.
Условное время реакции связано со скоростью потока u выражением = l/u.
Тепловое уравнение процесса (4.2): V0сpТ - тепловой поток, входящий в элементарный объем, и V0сp(Т + dТ) - выходящий из него; QPr(С, Т)dvp + КTdFT(ТX - Т) - источники теплоты (реакция и теплообмен через боковую поверхность dFT в выделенном объеме).
dq/dt =Qвх/вых +Qист;
0= V0сpТ - V0сp(Т + dТ) + QPr(С, Т)dvp + КTdFT(ТX - Т) .
Fуд = dFT/dvp - удельная поверхность теплообмена, - условное время реакции. Получаем следующее выражение:
сpdТ/d = QPr(С, Т) - КTFуд(Т - ТX); (4.8)
Т = Т0 при = 0.
Такой процесс и описывающие его уравнения называют режимом (моделью) идеального вытеснения - ИВ.
Таким образом, выделяют три математические модели, описывающие процесс в проточных (периодических) и непроточных (непрерывных) реакторах идеального смешения и вытеснения:
ИС-п ИС-н ИВ
dС/dt = W(С) (С - С0)/ = W(С) dС/d = W(С) (4.9)
С = С0 при t = 0 С = С0 при = 0
(а) (б) (в)
(здесь выписаны уравнения только для одного компонента).
