
- •Тема 1.1. Основні закони хімії
- •Закон збереження маси речовини
- •Контрольні запитання:
- •Тема 1.2. Оксиди
- •Визначення. Класифікація оксидів.
- •Контрольні запитання:
- •Тема 1.3. Основи
- •Визначення. Класифікація основ.
- •Контрольні запитання:
- •Тема 1.4. Кислоти
- •Визначення. Класифікація кислот.
- •Контрольні запитання:
- •Тема 1.5. Солі
- •Визначення. Класифікація солей.
- •Контрольні запитання:
- •Тема 1.6. Хімічний зв'язок
- •Поняття про хімічний зв'язок. Типи хімічного зв’язку.
- •Контрольні запитання:
- •Тема 1.7. Електролітична дисоціація. Реакції йонного обміну
- •Контрольні запитання:
- •Тема 1.8. Окисно-відновні реакції
- •Контрольні запитання:
- •Тема 2.1. Загальна характеристика металів
- •Контрольні запитання:
- •Тема 2.2. Корозія металів
- •Корозія металів. Види корозії.
- •Контрольні запитання:
- •Тема 2.3. Лужні метали
- •Контрольні запитання:
- •Тема 2.4. Кальцій
- •Кальцій.**
- •Контрольні запитання:
- •Тема 2.5. Сполуки Кальцію
- •Контрольні запитання:
- •Тема 2.6. Алюміній
- •Контрольні запитання:
- •Тема 2.7. Залізо
- •Контрольні запитання:
- •Тема 2.8. Сульфур. Сірка.
- •Контрольні запитання:
- •Тема 2.9. Сполуки Сульфуру
- •Контрольні запитання:
- •Тема 2.10. Сульфатна кислота та її солі
- •Контрольні запитання:
- •Тема 2.11. Нітроген. Азот.
- •Контрольні запитання:
- •Тема 2.12. Аміак. Солі амонію.
- •Контрольні запитання:
- •Тема 2.13. Сполуки Нітрогену
- •Контрольні запитання:
- •Тема 2. 14.Фосфор
- •Фосфор.
- •Контрольні запитання:
- •Тема 2.15. Сполуки Фосфору
- •Контрольні запитання:
- •Тема 2.16. Карбон. Вуглець.
- •Контрольні запитання:
- •Тема 2.16. Сполуки Карбону
- •Контрольні запитання:
- •Тема 2.18. Силіцій.
- •Контрольні запитання:
- •Тема 2.19. Сполуки Силіцію.
- •Контрольні запитання:
- •Тема 3.1. Теорія будови органічних речовин о.М. Бутлерова
- •Контрольні запитання:
- •Тема 3.2. Алкани
- •Контрольні запитання:
- •Тема 3.3. Алкени
- •Контрольні запитання:
- •Тема 3.4. Алкіни
- •Контрольні запитання:
- •Тема 3.5. Алкадієни (дієнові вуглеводні)
- •Контрольні запитання:
- •Тема 3.6. Ароматичні вуглеводні (арени)
- •Контрольні запитання:
- •Тема 3.7. Природні джерела вуглеводнів
- •Контрольні запитання:
- •Тема 4.1. Одноатомні спирти
- •Контрольні запитання:
- •Тема 4.2. Багатоатомні спирти
- •Контрольні запитання:
- •Тема 4.3. Феноли
- •Контрольні запитання:
- •Тема 4.4. Альдегіди
- •Контрольні запитання:
- •Тема 4.5. Карбонові кислоти
- •Контрольні запитання:
- •Тема 4.6. Естери
- •2. Номенклатура:
- •Контрольні запитання:
- •Тема 4.7. Жири. Мило
- •Контрольні запитання:
- •Тема 5.1. Вуглеводи. Глюкоза
- •Контрольні запитання:
- •Тема 5.2. Сахароза
- •Контрольні запитання:
- •Тема 5.3. Крохмаль і целюлоза
- •Контрольні запитання:
- •Тема 5.4. Аміни
- •Контрольні запитання:
- •Тема 5.5. Амінокислоти
- •Контрольні запитання:
- •Тема 5.6. Білки
- •Контрольні запитання:
Контрольні запитання:
-
Що називається ступенем окиснення? Правила визначення ступенів окиснення.
-
Які реакції називаються окисно-відновними?
-
Типи окисно-відновних реакцій?
-
Які процеси відбуваються під час окисно-відновних реакцій?
-
Що називається окисником (відновником)?
-
Методом електронного балансу розставити коефіцієнти в реакціях:
a) K+H2O→KOH+H2 б) H2S + O2→SO2 +H2O
-
Методом електронного балансу розставити коефіцієнти в реакціях:
a)Al+WO3→Al2O3+W б) H2SO4(к)+ Zn→ ZnSO4 + SO2 + H2O
Література:
-
Данильченко В.Є., Фрадіна Н.В. Хімія. 8 – 9 класи: Навч. посібник. – Х.: Країна мрій™, 2003. - с. 103-104.
-
Хомченко Г.П. Химия. – М.: Высшая школа, 1981. – Ч. І, Гл. 3, § 28, Гл. 7, §§ 55-59, с. 37-38, 66-74.
-
Стахеєв О.Ю. Хімія. Узагальнюючі схеми і таблиці. – Тернопіль.: «Богдан», 1998. – с. 9.
РОЗДІЛ 2. ХІМІЯ ЕЛЕМЕНТІВ.
Тема 2.1. Загальна характеристика металів
План
-
Положення металів в періодичній системі.
-
Металічний зв'язок та кристалічні гратки.*
-
Фізичні властивості металів.*
-
Хімічні властивості металів. **
-
Поширення металів в природі.
-
Способи добування металів.*
1. Усі хімічні елементи умовно поділяють на металічні й неметалічні. До елементів-металів належать s-елементи (за винятком Н і Не), усі d- та f-елементи. Серед p-елементів металічні розміщені у лівій частині періодичної системи хімічних елементів під діагоналлю Бор В – Астат At.
Для більшості елементів-металів характерна невелика кількість електронів на зовнішньому енергетичному рівні їх атомів (від 1 до 3) і порівняно великі радіуси атомів, що зумовлює здатність атомів металів легко втрачати валентні електрони й утворювати позитивно заряджені йони.
2 .
Металічний
зв'язок – це
особливий тип
хімічного зв’язку, який виникає в
кристалі металу, внаслідок віддавання
окремими його атомами валентних
електронів. Останні циркулюють всередині
кристалу (“електронний газ”), стають
усуспільненими всіма йонами металу і
міцно їх зв’язують.
.
Металічний
зв'язок – це
особливий тип
хімічного зв’язку, який виникає в
кристалі металу, внаслідок віддавання
окремими його атомами валентних
електронів. Останні циркулюють всередині
кристалу (“електронний газ”), стають
усуспільненими всіма йонами металу і
міцно їх зв’язують.
Металічний зв’язок є ненапрямленим, оскільки валентні електрони розподілені по всьому кристалі майже рівномірно. Він існує в кристалах і розплавах металів і сплавів, у чистому вигляді характерний для лужних і лужноземельних металів. У перехідних металів зв’язок між атомами частково є ковалентним. Наявність металічного зв’язку зумовлює спільні властивості металів.
Кристалічні гратки металів
У вузлах кристалічних граток металів містяться атоми та позитивно заряджені йони. Між ними постійно рухаються електрони. За рахунок електростатичного притягання між йонами та електронами забезпечується певна стабільність кристалічних граток металів.
О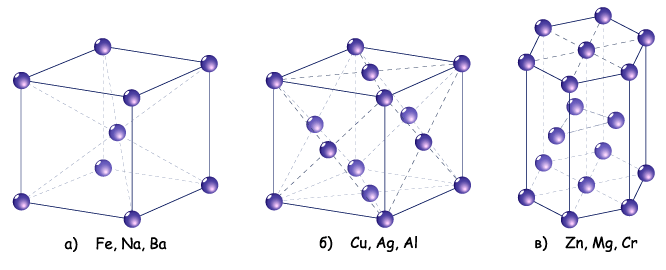 сновні
типи кристалічних граток:
сновні
типи кристалічних граток:
а – кубічна об’ємноцентрована;
б – кубічна гранецентрована;
в – гексагональна.
3. Фізичні властивості металів:
1) металічний блиск внаслідок розсіювання світла електронами. Найкраще відбивають світло індій In та срібло Ag.
2) сріблясто-білий колір (Ag, Al, Ni) або сріблясто-сірий (Fe, Pb), за винятком золота Au та міді Cu. За забарвленням метали умовно поділяють на чорні й кольорові. До чорних металів найчастіше відносять залізо та його сплави (чавун, сталь). Усі інші – називають кольоровими.
3) характерна теплова й електрична провідність, що зумовлена постійним рухом електронів у кристалі. За стандартних умов найвищу електричну провідність має срібло Ag, на другому місці – мідь Cu, далі золото Au і алюміній Al.
4) твердість металів порівнюють із твердістю алмазу. Найтвердішими з металів є хром Cr і вольфрам W, найм’якшими – є лужні метали, які легко ріжуться ножем.
5) пластичність металів –здатність металів необоротно деформуватися під дією механічних навантажень. Пояснюється можливістю переміщення (ковзання) одних шарів йонів металів відносно інших завдяки наявності “електронного газу”. Найпластичнішим металом є золото Au, а стибій Sb – дуже крихкий метал;
6) за густиною метали поділяють на легкі (ρ< 5 г/см3) і важкі (ρ > 5 г/см3).
Типові легкі метали – Li, Na, Mg, Al. До важких металів належить Zn, Fe, Cu, Pb, Hg, Au. Найважчим з металів є осмій Os.
7) за температурою плавлення метали поділяються на легкоплавкі tпл < 1000o C - натрій, магній, алюміній і тугоплавкі tпл > 1000o C - мідь, залізо, хром, титан, молібден.
4. Хімічна активність металів визначається здатністю їх атомів віддавати валентні електрони, тобто окиснюватись і перетворюватись на катіони (позитивно заряджені йони). За активністю метали розташовано у певний ряд (ряд Бекетова, витискувальний ряд, ряд активності, електрохімічний ряд металів). Згідно цього ряду:
1) кожний метал цього ряду може витіснити з водного розчину сполуки будь-який з металічних елементів, що стоїть праворуч від нього, і може бути витіснений будь-яким з металів, що стоять ліворуч;
2) усі метали, що стоять ліворуч від водню, можуть витісняти Гідроген з кислот, а ті, що стоять праворуч, - не можуть;
3) чим лівіше стоїть у ряду метал, тим він сильніший відновник і тим важче відновити його.
Крім цього метали:
1) взаємодіють з неметалами: 2Mg + O2 → 2MgO
2) взаємодіють з водою
Лужні й лужноземельні метали взаємодіють з водою за стандартних умов з утворенням лугів: 2Na + 2H2O → 2NaOH + H2
Менш активні метали реагують з водою при нагріванні: Zn + H2O → ZnO + H2
5. Метали зустрічаються в природі як у вільному стані (самородні метали), так і головним чином у вигляді хімічних сполук.
Самородні метали – це найменш актинві метали: золото Au, платина Pt і платинові метали – осмій Os, іридій Ir, рутеній Ru, родій Rh, паладій Pd, іноді срібло Ag, ртуть Hg і мідь Cu.
Природні мінеральні утворення, з яких технологічно можливо й економічно доцільно добувати метали, називають рудами. Основними рудами металів є їх оксиди і солі (сульфіди, сульфати, хлориди, карбонати). Якщо руди містять сполуки двох або декількох металів, то вони називаються поліметалічними.
6. Отримання металів з руд – задача металургії. Сучасна металургія отримує понад 75 металів і багато численні сплави на їх основі. В залежності від способів отримання металів розрізняють піро-, гідро- та електрометалургію.
Пірометалургія охоплює способи отримання металів з руд за допомогою реакцій відновлення, що проводяться при високих температурах. В якості відновників використовують вугілля, активні метали, карбон (ІІ) оксид, водень, метан. В основі цього методи лежить реакція відновлення металу з його оксиду: Сu2O + C → 2Cu + CO.
У тих випадках, коли руда є сульфідом металу, її попередньо переводять в оксид шляхом окислювального обпалення, а потім оксид металу відновлюють вугіллям: 2ZnS + 3O2 → 2ZnO + 2SO2
ZnO + C → Zn + CO
Відновлення металів з їх сполук іншими металами, хімічно більш активними, при високих температурах називається металотермією. В якості відновників використовують алюміній (алюмінотермія), магній (магнійтермія), кальцій, натрій. Цим способом одержують ті метали, які при відновленні їх оксидів вугіллям утворють карбіди (Mn, Cr, Ti, Mo, W).
Гідрометалургія охоплює способи отримання металів з розчину їх солей. При цьому метал, який входить до складу руди, спочатку переводять в розчин за допомогою необхідних реагентів, а потім виділяють його з цього розчину. Цим методом добувають до 25% міді, золото, срібло, цинк. Кадмій, молібден, уран.
Електрометалургія охоплює способи отримання металів за допомогою електролізу. Цим способом одержують легкі метали з їх розплавлених оксидів або хлоридів: алюміній, натрій і т.д.
Таким чином, в основі всіх способів отримання з їх сполук лежать окисно-відновні процеси.
