
- •Тема 1.1. Основні закони хімії
- •Закон збереження маси речовини
- •Контрольні запитання:
- •Тема 1.2. Оксиди
- •Визначення. Класифікація оксидів.
- •Контрольні запитання:
- •Тема 1.3. Основи
- •Визначення. Класифікація основ.
- •Контрольні запитання:
- •Тема 1.4. Кислоти
- •Визначення. Класифікація кислот.
- •Контрольні запитання:
- •Тема 1.5. Солі
- •Визначення. Класифікація солей.
- •Контрольні запитання:
- •Тема 1.6. Хімічний зв'язок
- •Поняття про хімічний зв'язок. Типи хімічного зв’язку.
- •Контрольні запитання:
- •Тема 1.7. Електролітична дисоціація. Реакції йонного обміну
- •Контрольні запитання:
- •Тема 1.8. Окисно-відновні реакції
- •Контрольні запитання:
- •Тема 2.1. Загальна характеристика металів
- •Контрольні запитання:
- •Тема 2.2. Корозія металів
- •Корозія металів. Види корозії.
- •Контрольні запитання:
- •Тема 2.3. Лужні метали
- •Контрольні запитання:
- •Тема 2.4. Кальцій
- •Кальцій.**
- •Контрольні запитання:
- •Тема 2.5. Сполуки Кальцію
- •Контрольні запитання:
- •Тема 2.6. Алюміній
- •Контрольні запитання:
- •Тема 2.7. Залізо
- •Контрольні запитання:
- •Тема 2.8. Сульфур. Сірка.
- •Контрольні запитання:
- •Тема 2.9. Сполуки Сульфуру
- •Контрольні запитання:
- •Тема 2.10. Сульфатна кислота та її солі
- •Контрольні запитання:
- •Тема 2.11. Нітроген. Азот.
- •Контрольні запитання:
- •Тема 2.12. Аміак. Солі амонію.
- •Контрольні запитання:
- •Тема 2.13. Сполуки Нітрогену
- •Контрольні запитання:
- •Тема 2. 14.Фосфор
- •Фосфор.
- •Контрольні запитання:
- •Тема 2.15. Сполуки Фосфору
- •Контрольні запитання:
- •Тема 2.16. Карбон. Вуглець.
- •Контрольні запитання:
- •Тема 2.16. Сполуки Карбону
- •Контрольні запитання:
- •Тема 2.18. Силіцій.
- •Контрольні запитання:
- •Тема 2.19. Сполуки Силіцію.
- •Контрольні запитання:
- •Тема 3.1. Теорія будови органічних речовин о.М. Бутлерова
- •Контрольні запитання:
- •Тема 3.2. Алкани
- •Контрольні запитання:
- •Тема 3.3. Алкени
- •Контрольні запитання:
- •Тема 3.4. Алкіни
- •Контрольні запитання:
- •Тема 3.5. Алкадієни (дієнові вуглеводні)
- •Контрольні запитання:
- •Тема 3.6. Ароматичні вуглеводні (арени)
- •Контрольні запитання:
- •Тема 3.7. Природні джерела вуглеводнів
- •Контрольні запитання:
- •Тема 4.1. Одноатомні спирти
- •Контрольні запитання:
- •Тема 4.2. Багатоатомні спирти
- •Контрольні запитання:
- •Тема 4.3. Феноли
- •Контрольні запитання:
- •Тема 4.4. Альдегіди
- •Контрольні запитання:
- •Тема 4.5. Карбонові кислоти
- •Контрольні запитання:
- •Тема 4.6. Естери
- •2. Номенклатура:
- •Контрольні запитання:
- •Тема 4.7. Жири. Мило
- •Контрольні запитання:
- •Тема 5.1. Вуглеводи. Глюкоза
- •Контрольні запитання:
- •Тема 5.2. Сахароза
- •Контрольні запитання:
- •Тема 5.3. Крохмаль і целюлоза
- •Контрольні запитання:
- •Тема 5.4. Аміни
- •Контрольні запитання:
- •Тема 5.5. Амінокислоти
- •Контрольні запитання:
- •Тема 5.6. Білки
- •Контрольні запитання:
Контрольні запитання:
-
Яке місце в періодичній системі елементів займає Нітроген?
-
Наведіть електронну формулу атома Нітрогену. Які ступені окиснення для нього характерні?
-
Які фізичні властивості азоту?
-
Де використовується азот?
-
Скласти рівняння реакцій за схемою N2→NO→ NO2→HNO3→NaNO3
-
Який об’єм займає азот за н.у. масою 56 г?
-
Визначте об’єм аміаку, який утворився при взаємодії 11,2л азоту з 11,2л водню, якщо вихід продукту реакції складає 95%.
Література:
-
Данильченко В.Є., Фрадіна Н.В. Хімія. 10 – 11 класи: Навч. посібник. – Х.: Країна мрій™, 2003. - с. 21.
-
Хомченко Г.П. Химия. – М.: Высшая школа, 1981. – Ч. ІІ, Гл. 10, §§ 78-79, с. 93-94.
-
Стахеєв О.Ю. Хімія. Узагальнюючі схеми і таблиці. – Тернопіль.: «Богдан», 1998. – с. 28.
Тема 2.12. Аміак. Солі амонію.
План
-
Склад та будова молекули аміаку.
-
Фізичні властивості.
-
Хімічні властивості.**
-
Добування.*
-
Застосування.
-
Солі амонію.*
1. Молекулярна формула NH3
Електронна формула
![]()
Структурна формула
![]()
Молекула має форму піраміди з атомом Нітрогену у вершині та кутом 107° між ковалентними полярними зв’язками N – H, внаслідок чого вона полярна.
Ступінь окиснення Нітрогену становить -3.
2. Аміак – безбарвний газ, з різким запахом, набагато легший за повітря, дуже добре розчиняється у воді (за температури 20ºC в 1 об’ємі води – 700 об’ємів амоніаку). Водний розчин амоніаку називають амоніачною водою, або нашатирним спиртом, масова частка амоніаку в ньому дорівнює 25%. Аміак легко зріджується, за температури -33,4ºC переходить у рідкий стан.
3. Хімічні властивості.
1) Як відновник аміак окиснюється киснем і горить у ньому зеленкуватим полум’ям.
4NH3 + 3O2 = 2N2 + 6H2O (горіння амоніаку)
За наявності каталізатора (Pt, Fe2O3) і нагрівання під час окиснення аміаку утворюються два оксиди:
![]()
2) Аміак взаємодіє з водою
![]()
У розчині лише невелика частка молекул амоніаку перетворюється на йони амонію, тому амоніачна вода пахне амоніаком. ЇЇ позначають формулою NH3 · H2O і називають амоній гідроксидом або нашатирним спиртом. Він належить до слабких і нестійких основ:

3) Аміак взаємодіє з кислотами, утворюючи солі амонію:

4. У лабораторії аміак добувають із суміші твердих речовин – нашатирю NH4Cl і гашеного вапна Ca(OH)2:
![]()
У промисловості амоніак синтезують із простих речовин азоту і водню:

Оптимальні умови синтезу аміаку:
-
застосування тиску (30 МПа) для зміщення рівноваги у бік утворення аміаку;
-
використання каталізатору ( губчасте Fe);
-
підвищення температури (450- 550ºC).
5. Аміак застосовують:
1) для виробництва нітратної кислоти, солей амонію, вибухових речовин, соди, барвників;
2) як добриво і для добування азотних добрив, у тім числі й карбаміду (сечовини):
![]()
3) як холодоагент у холодильних установках;
4) у медицині як нашатирний спирт;
5) у хімічних лабораторіях як слабкий луг;
6) у побуті під час прання білизни, для виведення плям, чищення килимів і ювелірних виробів.
6. Солі амонію – кристалічні речовини з йонним типом зв’язку, до складу яких входить один або кілька катіонів амонію та аніон кислотного залишку.
Солі амонію – сильні електроліти:
1) у водних розчинах дисоціюють на йони:
![]()
2) взаємодіють з іншими солями, відбувається реакція йонного обміну:
![]()
3) взаємодіють з лугами з виділенням аміаку:
![]()
4) розкладаються під час нагрівання з виділенням аміаку (якщо утворені кислотами – неокисниками):
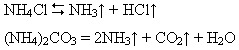
А якщо солі амонію утворені кислотами-окисниками, то виділяються різні сполуки Нітрогену:
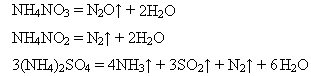
Добування: Солі амонію добувають внаслідок взаємодії аміаку або аміачної води з кислотами:

Застосування:
1) Амоній нітрат і амоній сульфат використовують як добриво.
2) Амоній нітрат (у суміші з алюмінієм і вугіллям) застосовують для виготовлення вибухової речовини – амоналу.
3) Амоній хлорид під назвою „нашатир” – під час паяння для очищення поверхні паяльника
