
- •Тема 1.1. Основні закони хімії
- •Закон збереження маси речовини
- •Контрольні запитання:
- •Тема 1.2. Оксиди
- •Визначення. Класифікація оксидів.
- •Контрольні запитання:
- •Тема 1.3. Основи
- •Визначення. Класифікація основ.
- •Контрольні запитання:
- •Тема 1.4. Кислоти
- •Визначення. Класифікація кислот.
- •Контрольні запитання:
- •Тема 1.5. Солі
- •Визначення. Класифікація солей.
- •Контрольні запитання:
- •Тема 1.6. Хімічний зв'язок
- •Поняття про хімічний зв'язок. Типи хімічного зв’язку.
- •Контрольні запитання:
- •Тема 1.7. Електролітична дисоціація. Реакції йонного обміну
- •Контрольні запитання:
- •Тема 1.8. Окисно-відновні реакції
- •Контрольні запитання:
- •Тема 2.1. Загальна характеристика металів
- •Контрольні запитання:
- •Тема 2.2. Корозія металів
- •Корозія металів. Види корозії.
- •Контрольні запитання:
- •Тема 2.3. Лужні метали
- •Контрольні запитання:
- •Тема 2.4. Кальцій
- •Кальцій.**
- •Контрольні запитання:
- •Тема 2.5. Сполуки Кальцію
- •Контрольні запитання:
- •Тема 2.6. Алюміній
- •Контрольні запитання:
- •Тема 2.7. Залізо
- •Контрольні запитання:
- •Тема 2.8. Сульфур. Сірка.
- •Контрольні запитання:
- •Тема 2.9. Сполуки Сульфуру
- •Контрольні запитання:
- •Тема 2.10. Сульфатна кислота та її солі
- •Контрольні запитання:
- •Тема 2.11. Нітроген. Азот.
- •Контрольні запитання:
- •Тема 2.12. Аміак. Солі амонію.
- •Контрольні запитання:
- •Тема 2.13. Сполуки Нітрогену
- •Контрольні запитання:
- •Тема 2. 14.Фосфор
- •Фосфор.
- •Контрольні запитання:
- •Тема 2.15. Сполуки Фосфору
- •Контрольні запитання:
- •Тема 2.16. Карбон. Вуглець.
- •Контрольні запитання:
- •Тема 2.16. Сполуки Карбону
- •Контрольні запитання:
- •Тема 2.18. Силіцій.
- •Контрольні запитання:
- •Тема 2.19. Сполуки Силіцію.
- •Контрольні запитання:
- •Тема 3.1. Теорія будови органічних речовин о.М. Бутлерова
- •Контрольні запитання:
- •Тема 3.2. Алкани
- •Контрольні запитання:
- •Тема 3.3. Алкени
- •Контрольні запитання:
- •Тема 3.4. Алкіни
- •Контрольні запитання:
- •Тема 3.5. Алкадієни (дієнові вуглеводні)
- •Контрольні запитання:
- •Тема 3.6. Ароматичні вуглеводні (арени)
- •Контрольні запитання:
- •Тема 3.7. Природні джерела вуглеводнів
- •Контрольні запитання:
- •Тема 4.1. Одноатомні спирти
- •Контрольні запитання:
- •Тема 4.2. Багатоатомні спирти
- •Контрольні запитання:
- •Тема 4.3. Феноли
- •Контрольні запитання:
- •Тема 4.4. Альдегіди
- •Контрольні запитання:
- •Тема 4.5. Карбонові кислоти
- •Контрольні запитання:
- •Тема 4.6. Естери
- •2. Номенклатура:
- •Контрольні запитання:
- •Тема 4.7. Жири. Мило
- •Контрольні запитання:
- •Тема 5.1. Вуглеводи. Глюкоза
- •Контрольні запитання:
- •Тема 5.2. Сахароза
- •Контрольні запитання:
- •Тема 5.3. Крохмаль і целюлоза
- •Контрольні запитання:
- •Тема 5.4. Аміни
- •Контрольні запитання:
- •Тема 5.5. Амінокислоти
- •Контрольні запитання:
- •Тема 5.6. Білки
- •Контрольні запитання:
Міністерство освіти і науки, молоді та спорту
України
Сумський державний університет
Машинобудівний коледж
ОПОРНІ КОНСПЕКТИ
з дисципліни
„Хімія”
для студентів І курсу всіх спеціальностей
2011 р.
Опорні конспекти розроблені викладачами дисципліни „Хімія” Пальмовою І.О. та Хроленко І.А.
Розглянуто і затверджено цикловою комісією природничо-математичних дисциплін
Протокол № від „ ” _________ 2011р.
ЗМІСТ
РОЗДІЛ 1. ОСНОВИ НЕОРГАНІЧНОЇ ХІМІЇ 5
1.1. Основні закони хімії 5
1.2. Оксиди 6
1.3. Основи 9
1.4. Кислоти 11
1.5. Солі 12
1.6. Хімічний зв'язок 14
1.7. Електролітична дисоціація. Реакції йонного обміну 17
1.8. Окисно-відновні реакції 19
РОЗДІЛ 2. ХІМІЯ ЕЛЕМЕНТІВ 21
2.1. Загальна характеристика металів 21
2.2. Корозія металів 24
2.3. Лужні метали 27
2.4. Кальцій 30
2.5. Сполуки кальцію 33
2.6. Алюміній 35
2.7. Залізо 38
2.8. Сульфур. Сірка 41
2.9. Сполуки Сульфуру 43
2.10. Сульфатна кислота та її солі 46
2.11. Нітроген. Азот. 50
2.12. Аміак. Солі амонію. 53
2.13. Сполуки Нітрогену 56
2.14. Фосфор 60
2.15. Сполуки Фосфору 62
2.16. Карбон. Вуглець. 65
2.17. Сполуки Карбону 68
2.18. Силіцій 71
2.19. Сполуки Силіцію 74
РОЗДІЛ 3. ВУГЛЕВОДНІ 76
3.1. Теорія будови органічних речовин О.М. Бутлерова 76
3.2. Алкани 77
3.3. Алкени 81
3.4. Алкіни 83
3.5. Алкадієни (діє нові вуглеводні) 85
3.6. Ароматичні вуглеводні (арени) 87
3.7. Природні джерела вуглеводнів 89
РОЗДІЛ 4. ОКСИГЕНОВМІСНІ ОРГАНІЧНІ РЕЧОВИНИ 92
4.1. Одноатомні спирти 92
4.2. Багатоатомні спирти 94
4.3. Феноли 97
4.4. Альдегіди 99
4.5. Карбонові кислоти 101
4.6. Естери 104
4.7. Жири. Мило 105
РОЗДІЛ 5. ВУГЛЕВОДИ. НІТРОГЕНОВМІСНІ ОРГАНІЧНІ РЕЧОВИНИ 108
5.1. Вуглеводи. Глюкоза. 108
5.2. Сахароза 111
5.3. Крохмаль і целюлоза. 112
5.4. Аміни 114
5.5. Амінокислоти 116
5.6. Білки 118
Рівні засвоєння навчального матеріалу:
-
перший рівень – початковий – відповідь студента при відтворенні навчального матеріалу – елементарна, фрагментарна, зумовлюється початковими уявленнями про предмет вивчення;
-
другий рівень – середній – студент відтворює основний навчальний матеріал, здатний розв’язувати завдання за зразком, володіє елементарними вміннями навчальної діяльності (*);
-
третій рівень – достатній – студент знає істотні ознаки понять, явищ, закономірностей зв’язків між ними, а також самостійно застосовує знання в стандартних ситуаціях, володіє розумовими операціями (аналізом, абстрагуванням, узагальненням тощо), уміє робити висновки, виправляти допущені помилки; відповідь повна, правильна, логічна, обґрунтована, хоча їй бракує власних суджень (**);
-
четвертий рівень – високий – знання студента є глибокими, міцними, узагальненими, системними; студент уміє застосовувати знання творчо, його навчальна діяльність має дослідницький характер, позначена вмінням самостійно оцінювати різноманітні життєві ситуації, явища, факти, виявляє і відстоює особисту позицію (***).
РОЗДІЛ 1. ОСНОВИ НЕОРГАНІЧНОЇ ХІМІЇ.
Тема 1.1. Основні закони хімії
План
-
Закон збереження маси речовини
-
Закон об’ємних відношень
-
Закон Авогадро та наслідки з закону.
-
Періодичний закон Д.І. Менделєєва.
1. До основних законів хімії належать:
-
закон збереження маси речовини (Ломоносов М.В., 1748р., Лавуазьє 1789р.)
-
закон об’ємних відношень (Гей-Люссак, 1802р.)
-
закон Авогадро (1811р.)
-
Періодичний закон Д.І. Менделєєва (1869р.)
Закон збереження маси речовини:
Маса речовин, що вступила в реакцію, дорівнює масі речовин, що утворилися в результаті реакції.
Маса реагентів = масі продуктів реакції
Цей закон використовується при розставлянні коефіцієнтів в рівняннях реакцій, при розв’язуванні задач за рівняннями хімічних реакцій
2. Закон об’ємних відношень:
Об’єми газів, що вступають в реакцію, відносяться один до одного і до об’ємів газоподібних продуктів реакції, що утворилися, як невеликі цілі числа.
Приклад: 2Н2 + О2 → 2Н2О(г)
V(Н2) : V(О2) : V(Н2О) = 2:1:2
Цей закон дає можливість розв’язувати задачі за рівняннями реакцій за участю газоподібних речовин.
3. Закон Авогадро:
У рівних об’ємах будь-яких газів, взятих при однаковій температурі і однаковому тиску, міститься однакове число молекул.

1 моль 1 моль 1 моль
Наслідки:
1) Однакове число молекул будь-яких газів за однакових умов займають однаковий об’єм.
2) Об’єм 1 моль будь-якого газу за нормальних умов завжди дорівнює 22,4л.
Цей закон дає можливість розв’язувати розрахункові задачі за участю газоподібних речовин за нормальних умов.
4. Періодичний закон (1869р):
Властивості простих тіл, а також форми та властивості сполук елементів перебувають у періодичній залежності від величини атомних ваг (мас) елементів.
Сучасне формулювання:
Властивості хімічних елементів, а також простих і складних речовин, які вони утворюють, перебувають у періодичній залежності від величини заряду ядра атомів цих елементів.
Контрольні запитання:
-
Назвіть основні закони хімії.
-
Сформулюйте закон збереження маси речовини та розкрийте його практичне значення.
-
Сформулюйте закон об’ємних відношень та розкрийте його практичне значення.
-
Сформулюйте закон Авогадро і наслідки з нього.
-
Сформулюйте періодичний закон Д.І. Менделєєва та розкрийте його практичне значення.
-
Розставте коефіцієнти в рівняннях реакцій:
А) H2 + Cl2 → HCl Б) NaOH + H2SO4 → Na2SO4 + H2O
В) Ba(OH)2 + Na2SO4 → BaSO4 + NaOH Г) SO2 + O2 → SO3
7. Обчисліть, який об’єм аміаку уториться при взаємодії 10 л азоту з 10 л водню.
Література:
-
Данильченко В.Є., Фрадіна Н.В. Хімія. 8 – 9 класи: Навч. посібник. – Х.: Країна мрій™, 2003. - с. 13, 27.
-
Данильченко В.Є., Фрадіна Н.В. Хімія. 10 – 11 класи: Навч. посібник. – Х.: Країна мрій™, 2003. - с. 184-185.
-
Хомченко Г.П. Химия. – М.: Высшая школа, 1981. – Ч. І, Гл. 1, § 6, с. 11-13.
Тема 1.2. Оксиди
План
-
Визначення. Класифікація оксидів.
-
Хімічні властивості основних та кислотних оксидів.**
-
Хімічні властивості амфотерних оксидів.**
-
Добування оксидів.*
1. Оксиди – бінарні сполуки елементів з Оксигеном.
Класифікація оксидів за хімічними властивостями:
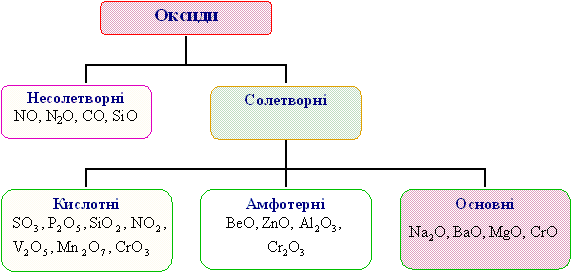
Несолетворні оксиди – реакційно здатні сполуки, які не утворюють солей.
Оксиди солетворні – оксиди, які утворюють солі.
Основні оксиди – це оксиди, яким відповідають основи.
Кислотні оксиди – це оксиди, яким відповідають кислоти.
Амфотерні оксиди – це оксиди, які взаємодіють і з розчинами кислот, і з розчинами лугів з утворенням солей і води.
2. Хімічні властивості основних і кислотних оксидів:
|
Оксиди |
|
|
основні |
кислотні |
|
1. Взаємодіють з кислотами: CaO + H2SO4 → CaSO4 + H2O |
1. Взаємодіють з лугами: CO2 + Ca(OH)2 → CaCO3 + H2O |
|
2. Взаємодіють з водою |
|
|
CaO+ H2O → Ca(OH)2 |
SO3 + H2O → H2SO4 |
|
3. Взаємодіють між собою |
|
|
CaO + SiO2 → CaSiO3 (стоплення) |
|
3. Амфотерні властивості виявляють оксиди металічних елементів, які у періодичній системі розміщені між високоактивними металічними і неметалічними елементами.
Якщо металічний елемент виявляє кілька можливих ступенів окиснення, то характер його оксидів у міру збільшення ступеня окиснення змінюється від основного через амфотерний до кислотного:
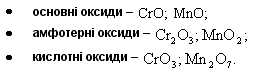
Хімічні властивості амфотерних оксидів:

4. Добування оксидів:



