
- •5В072800 «Өнімді өңдеу технологиясы» мамандықтарына
- •Мазмұны
- •4.9.2 Жұмыс бағдарламасы
- •Физколлоидты химия
- •5В072800 «Өнімді өңдеу технологиясы» мамандықтарына
- •4.9.3 Оқу бағдарламасы
- •5В072800 «Өнімді өңдеу технологиясы» мамандықтарына
- •Tycihikteme жазба
- •Пәннің мазмұны
- •I бөлім. Химиялық термодинамикалық негізі және оны химиялың процестерге қолдану
- •II бөлім. Фазалык, тепе-теңдік және электролит емес ерітінділердің ілімі
- •III бөлім.Электрохимия
- •IV бөлім. Химиялық кинетика және катализ
- •Ұсынылатын лабораториялық жұмыстардың
- •Ұсынылған hегізі әдебиеттер:
- •4.9.3 Оқу бағдарламасы
- •5В072800 «Өнімді өңдеу технологиясы» мамандықтарына
- •1 Оқытылатын пәннің сипаттамасы
- •Пәннің мақсаты мен міндеттері
- •3 Алдыңғы реквизиттер мен кейінгі реквизиттер
- •Пәннің қысқаша сипаттамасы
- •Пәннің мақсаты мен міндеттері
- •6.Пәннің мазмұны
- •Дәрістік сабақтар тақырыптары
- •Практикалық сабақтар тақырыптары
- •Зертзханалық сабақтар тақырыптары
- •Соөж / моөж тақырыптары
- •Сөж / мөж тақырыптары
- •Негізгі әдебиеттер
- •Қосымша әдебиеттер
- •Баға жайында ақпарат Бағалау критерийі
- •Баллдар щкаласы
- •Студенттердің тәртіп саясаты және процедурасы
- •Студенттің өзіндік жұмыстарын ұйымдастыруға арналған әдістемелік нұсқаулар (оқытушылар таңдауы).
- •10. Ұсынылған әдебиттер:
- •8.1. Негізгі және косымша әдебиеттер:
- •4.1 Курстың тақырыптық жоспары
- •4.2 Пән бойынша тапсырмаларды орындау және тапсыру графигі
- •4.3 Пән бойынша соөж, сөж тапсырмаларды орындау және тапсыру графигі
- •Дәрістік сабақтардың мазмұны
- •4.4. Сөж және сөож сабақтарының мазмұны
- •Негізгі әдебиеттер
- •Қосымша әдебиеттер
- •Глоссарий физколлидты – химия.
- •Химиялық термодинамика
- •Энергияның түрлері
- •Термодинамиканың 1-ші заңы
- •1. Термодинамиканың бірінші бастамасы, анықтамалары, мәні.
- •2. Термодинамиканың 1-ші заңының математикалық сипатталуы.
- •1. Жылу сыйымдылық, сипаттама
- •2. Меншікті және молярлы жылу сыйымдылық түрлері. 3.Нақты жылу сыйымдылық,орташа жылу сыйымдылық
- •2. Меншікті және молярлы жылу сыйымдылық түрлері.
- •3. Нақты жылу сыйымдылық,орташа жылу сыйымдылық
- •Гесс заңдары
- •2. Гесс заңының салдарлары
- •3. Химиялық реакциялардың жылу эффектілерінің температураға тәуелділігі. Кирхгофф теңдеуі.
- •Термодинамиканың екінші бастамасы.
- •1. Өздігінен жүретін және өздігінек жүрмейтін процесстер. .Термодинамиканың екінші заңы:анықтамлары, мәні .Карно циклі
- •2.Қайтымды, қайтымсыз процесстердің жұмысы мен жылуы.
- •Бірінші және екінші занның теңдеулерін біріктіріп жазсақ
- •Темодинамикалық тепе-теңдік
- •1. Тепе - теңдік константасы Ле - Шателье принципі а) қысымның әсері б) температура әсері в) концентрация әсері
- •2. Изотерма, изобара және Вант-Гофф изохораның теңдеулері.
- •3.Клаузиус-Клапейрон теңдеуі. Ле - Шателье принципі
- •Изотерма теңдеуі
- •4. Химиялық потенциал.Парциалды мольдік шамалар.
- •Фазалық тепе-теңдік.
- •1. Фаза, фаза туралы түсінік. Гиббс фазаларының ережесі.
- •2.Біркомпонентті диаграммалар. Судың күй диаграммасы.. Біркомпонентті гетерогенді жүйелер
- •Сурет 1 Судың күй диаграммасы.
- •3. Екі компонентті диаграммалардың негізгі түрлері. Олардың құрастыру принциптері.
- •Ерітінділер. Идеалды ерітінділер.
- •Идеалды ерітінділер. Рауль заңы.
- •Генри заңы.
- •Коновалов заңдары. Коноваловтың 1 заңы.. Коноваловтың екінші заңы.
- •Таралу заңы.
- •Электролит ертінділері. Реалды ерітінділер.
- •1. Электролиттік диссоциация теориясының кемшіліктері
- •2..Күшті электролиттердің теориясы
- •3. Термодинамикалық белсенділік және оның анықтау әдістері.
- •Реалды ерітінділердің термодинамикасы.
- •Химиялық кинетика.
- •1. Негізгі түсініктері мен анықтамалары.
- •2. Статикалық жағдайлардағы қайтымсыз реакциялардың кинетикасы.
- •4. Реакция жылдамдығына температураның әсері. Гофф ережесі.
- •Катализ.
- •1. Катализаторлардың жалпы қасиеті. Катализаторлардың өзіндігі. Оң және теріс катализ.
- •2. Катализаторлардың активтену энергиясына әсері. Негізгі түсініктер.
- •3. Гомогенді катализ (механизм).. Гомогенді катализдегі активациялық қисықтар
- •Гетерогенді процестердің кинетикасы
- •1. Гетерогенді химиялық реакция
- •2. Гетерогенді катализ..
- •3. Гетерогенді катализдің механизмі Дифффузия мен адсорбцияның ролі.
- •Электрохимия.
- •Электродты процестер
- •1. Стандартты потенциал Гальваникалық элементтер.
- •2. Гальваникалық элементтердің термодинамикасы.
- •3. Стандартты потенциал Нернст теңдеуі.
- •4. Электродтардың жіктелуі
- •5. . Химиялық элемент.
- •Электродтық процестердің кинетикасы.
- •1. Электролиз. Электролиз заңдары. Фарадей заңдары.
- •2. Электролиз. Электролиз заңдары. Фарадей заңдары.
- •3. Диффузиялық потенциал, диффузиялық поляризация
- •Бөлшектерінң шамасына қарай
- •Лиофобты зольдердің каогуляциясы мен тұрақтылығы
- •Конденсациялық әдіс арқылы дисперстік жүйелерді алу
- •Химиялық конденсация
- •Дисперстік жүйелерді тазалау
- •Дисперстік жүйелердің оптикалық қасиеттері
- •1.Дисперсік жүйелерде жарықтың шашырауы
- •2.Жарықтың жұтылуы (адсорбциясы)
- •3.Фарадей- Тиндаль эффектісі
- •Дисперстік жүйелердің электрлік қасиеттері. Қос электрлік қабаттың құрылысы Қос электрлік қабаттың пайда болу механизмі
- •Электрокинетикалық құбылыстар
- •Микрогетерогенді жүйелер
- •Фазааралық бөлу беттеріндегі молекулалық әрекеттесулер-беттік құбылыстар Беттік қабаттың термодинамикалық сипаттамалары
- •Когезия мен адгезия. Когезия және адгезия жұмыстары
- •Капиллярлық қысым
- •Капиллярдың бойымен сұйықтың көтерілуі
- •Адсорбция құбұлысы
- •1.Адслрбция, оның түрлері
- •2.Ертінді-газ шекарасындағы адсорбция
- •3. Сұйытылған ерітінділердегі адсорбция
- •Сұйытылған ерітінділердегі адсорбция
- •Шишковский теңдеуі
- •Лэнгмюр теңдеуі
- •4.9.9. Зертханалық жұмыстарды орындау бойынша әдістемелік нұсқаулар мен ұсыныстар
- •2. Тапсырма: Химиялық, реакцияның жылу тиімділігін есептеу.
- •Тапсырманы орындау реті:
- •2. Ерітіндінің парциальдық молярлы жылуын жөне еру энтропиясын анықтау
- •Тапсырманы орындау реті:
- •Тапсырманы орындау реті:
- •Тапсырманы орындау реті:
- •1.4. Химиялық тепе-теңдктіі экспериментады. Зертгеудің пршщипі
- •9. Лабораториялық жұмыс: Үш компонентті (системалар) жүйелер
- •2 Үш құралас бөлікп жүйелердің өзара ерігіштігі
- •Тапсырманы орындау реті:
- •Жұмыстың барысы:
- •Тапсырманы орындау реті:
- •Нәтижелер мен есептеулерді теориялық түсіндіру
- •4.9.7 Практикалық (семинарлық) сабақтар жоспары
- •4.9.7 Практикалық (семинарлық) сабақтар жоспары Методикалық нұсқаулар
- •2.8.Курс бойынша емтихан сұрақтары
4. Электродтардың жіктелуі
Электрдты процеске қатысатын заттың химиялық табиғатына орай электродтар бірінші және екінші текті болып бөлінеді.
I – текті электродтар. Ондағы металл тотықсызданған түрге татса, ал осы металдың ионы тотыққан болып есептеледі. Бұған мысал ретінде мыс пен мырыш электродтарын алуға болады. Бұл электродтардағы потенциалдар айырмасы катиондардың активтілігінен функционалды тәуелділікте болғандықтан, оны катион арқылы қайтымдылықта болатын электродтар дейді.
II – текті электродтар. Бұл электрдтар сырты өзінің ерімейтін тұзымен қапталып, анионның жақсы еритін тұзының ерітіндісіне батырылған металдан тұрады. Мысалы, күміс сымын суда ерімейтін күміс хлоридімен қаптап, сосын оны суда жақсы еритін хлорлы калий не тұз қышқылының ерітіндісіне батырса, екінші текті электродтар қатарына жататын, хлор күміс электроды деп аталатын электрод шығады.
Электрод потенциалын анықтаушы иондардың табиғатына байланысты электродтар жалпы алғанда бірінші текті және екінші текті электродтар болып бөлінеді. Сонымен қатар, газ электродтары, тотығу-тотықсыздану электродтары, амальгамалы электродтар және ион алмасу электродтары болып та бөлінеді. Газ электродтары мен амльгамалы электродтар бірінші текті электродтарға жатады, тотығу-тотықсыздану электродтарын кейде үшінші текті электродтар деп атайды.
Бірінші текті электродтар.
Бірінші текті электродтардың потенциалы катионның не анионның активтігіне тәуелді. Оларға металл электродтары, амальгамалы электродтар және бейметалл электродтары жатады. Ме электродының потенциалы катионның (Меn+), бейметалл электродының потенциалы анионның (Аn-) активтігімен анықталады.
Меn+/M, мысалы Zn2+/Zn
Аn- /A, мысалы Se2-/Se
Металл электродында өтетін реакция:
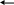 Меn+
+ne
M
Меn+
+ne
M
Электрод потенциалының Нернст теңдеуі қатты металдың активтігін 1-ге тең деп есептегенде былай жазылады:
ε = Меn+/M= ε0 Меn+/M+(RT/nF) lna Меn+
Амальгамалы электродтар.
М еталл амальгамасы мен сол металдың ионы бар ерітіндіден тұрады. Меn+/M (Hg) электродтық реакция мен электрод потенциалының теңдеулері мынадай: Меn+ +ne M(Hg)
εМеn+/M(Hg)= ε0 Меn+/M(Hg)+ (RT/nF) lnτa Меn+ /aM(Hg) - мұнда aM(Hg) - металдың амальгамадағы активтігі. Амальгамалы электродтар лаборатория жұмыстарында қолданылады. Мысалы, электрохимиялық элементтердің электр қозғаушы күшін өлшеуде қолданылатын стандартты Вестон элементіндегі бір электрод кадмийдің амальгамалы электроды Cd2+/ Cd (Hg) сілтілік металдардың электродтары олардың амальгамасы түрінде қолданылады.
Потенциалы анионның концентрациясына тәуелді болатын бейметалл электродтарында өтетін реакция.
A+ne An-
Электрод потенциалының теңдеуі (қатты бейметалдың активтігі 1-ге тең).
ε An-/А= ε0 An-/А- (RT/nF) lna An-
Бұл теңдеудің анионның активтігі өскен сайын электродтың потенциалы төмендейтінін көреміз.
Екінші текті электродтар.
Екінші текті электродтар металдан, сол металдың нашар еритін тұзынан және осы тұзбен аттас анионы бар басқа бір жақсы еритін электролиттің ерітіндісінен тұрады. Металл өзінің нашар еритін тұзының кристалдарынан жасалған пастамен қапталып, сол тұзбен аттас анионы бар электролиттің ерітіндісіне батырылады. Электродтың схемасы:
An- /МА,М
Э лектродтың реакция катионның да, анионның да қатысында жүреді. Электрохимиялық процестің өзімен қатар (Меn+ +ne M) МА тұзының тұнбаға түсуі не ерітіндіге өтуі жүреді. (МА Меn++ An-)
Бұл екі процестің қосындысы
МА+ne M+An-
Электродтың потенциалы осы соңғы реакциямен анықталады. Потенциалдың теңдеуі (ama=am=1жағдайда)
ε An-/МА,М= ε0 An-/МА,М- (RT/nF) lna An-
Екінші текті электродтар потенцалдары ұзақ уақыт бойына тұрақты сақталатындықтан салыстырмалы электрод ретінде потенциометрлік анықтауларда қолданылады. Салыстырмалы электрод ретінде көбінесе каломель және хлор-күміс электродтары пайдаланылады.
Каломель электроды деп – каломель мен (Hg2Cl2) сынап қоспасынан жасалған пастамен қапталған, калий хлорииді ерітіндісіне батырылған сынап электродын айтады.
Cl-/Hg2Cl2,Hg
Электродтық реакцияның нәтижесінде каломель тотықсызданып металл күйіндегі сынапты және хлор анионын береді.
Hg2Cl2+2e=2 Hg+2 Cl-
Сынап электродының потенциалы бірінші текті металл электроды потенциалының теңдеуімен өрнектеледі:
ε Hg22+/ Hg= ε0 Hg22+/ Hg +(RT/2F) lna Hg22+
Б ұл теңдеуге сәйкес электродтық реакция: Hg22++2e 2Hg
О
 х,Red/Pt;
Ox+ne Red
х,Red/Pt;
Ox+ne Red
Мысалы, Sn4+,Sn2+/Pt; Fe3+,Fe2+/Pt MnO4-,MnO42-/Pt
Бұларда өтетін реакция
Sn4++2e Sn2+; Fe3++e Fe2+ және MnO4-+e MnO42-
Тотығу-тотықсыздану электрдтарының потенциалы да Нернст теңдеуімен анықталады
ε Ox,Red= ε0Ox,Red+(RT/nf)ln(aOx/aRed)
мұнда ε0Ox,Red-стандартты тотығу-тотықсыздану потенциалы
Хингидрон электроды деп органикалық зат-хингидронның
(C6H4O2 C6H4(OH)2) қаныққан ерітіндіде батырылған Pt электродын
хинон гидрохинон
айтады.
C6H4(OH)2 C6H4O2+2H++2e
ε xT= ε0xT+ RT/2f)ln(ax aH+/aT
Х электродының стандартты потенциалының 25оС –тағы мәні
ε0xT=0,6992В Оның t-ға тәуелділігі мына формуламен анықталады
ε0xT=0,7177-7,4 10-4t
Ион алмасу электродтары.Ион алмасу электродтары иониттен және ионит батырылған ерітіндіден тұрады.Ионит пен ерітінді арсында ион алмасу салдарынан электродтық потенциал пайда болады.Мысалы иониттің I+ ионы ерітіндінің М+ ионымен алмасады делік I+ионит+M+еріт I+ еріт+ M+ ионит
Калм= (aI+ еріт+ M+ ионит)/ (a I+ионит+M+еріт)
Тепе-теңдік жағдайда иониттің беттік қабаты мен ерітінді бір-біріне қарама-қарсы зарядталады,сөйтіп ионитпен ерітінді шекарасында қос электр қабаты пайда болады.Ерітіндіде әртүрлі ионит иондарымен алмасады.Сондықтан ион алмасу электрон+ион селективті электродтар деп атлады.
Шыны электроды.Шыны электроды арнаулы шыныдан жасалған жұқа мембранадан тұрады.Шыны құрамында сілтілік металдың мөлшері көбірек болады.
Маш ++ Н+еріт Na+еріт+Hаш+ Алмасу реакциясының тепе-теңдік константасы
Калм=( aNa+еріт+Hаш+)/(aNaш+ aHеріт+)
Хлор-күміс электроды-күміс хлоридінің (AgCl)кристалымен қапталған және KCl ерітіндісіне батырылған күміс электроды
Cl-/AgCl,Ag
Э лектродтық реакцияның теңдеуі AgCl+e Ag+Cl- электрод потенциалының формуласы ε Cl-/AgCl,Ag= ε0 Cl-/AgCl,Ag- RT/f)lnaСl-
Газ электродтары.Газ электродтарының схемасы жалпы түрде былай жазылады: Ерітінді/газ,металл
Ерітіндіде сол алынған газдың ионы болады.Электродты металл ролін инертті металдар атқарады.(Pt,Au,Ra).Инертті металл реакцияға қатыспайды,тек өткізгіш ролін атқарады
Газ электродтарында сутегі,оттегі,хлор электродтары жатады.
Сутегі электроды- Pt ұнтағымен қапталған,Н2 газымен қаныққан,сөйтіп Н2 ионы бар ерітіндіге батырылған платина пластинкасы
Н3О+/H2,Pt 2H++2e H2
Электрод потенциалының теңдеуі
 ε
Н+/H2=
ε0
Н+/H2
+( RT/2f)ln(a2
Н+/PH2)
немесе ε0
Н+/H2=0
болғандықтан
ε
Н+/H2=
ε0
Н+/H2
+( RT/2f)ln(a2
Н+/PH2)
немесе ε0
Н+/H2=0
болғандықтан
ε Н+/H2=( RT/f)lna Н+/PH21/2)
Оттегі электроды H2O,OH-/O2,Pt-схемасы
Мұнда Pt пластинкасы оттегі газымен қанықтырылып,ОН ионы бар ерітіндіге батырылады
O2+2H2O+4e=4OH-
ε OН-/O2= ε0 OН-/O2 +( RT/4f)ln(Po2a2 Н20/a4OH-)
ε OН-/O2= ε0 OН-/O2 +( RT/2f)lnaH20
Оттегі электродының стандартты потенциалының 298К t-ғы мәні
ε OН-/O2=+0,401 B
Хлор электродтың схемасы Cl-/Cl2,Pt
Cl2+2e 2Cl-
ε Cl-/Cl2= ε0 Cl-/Cl2 +( RT/2f)ln(PCl2/a2Cl-)
Тотығу-тотықсыздану электродтары.Жалпы алғанда барлық электродтарда тотығу-тотықсыздану реакциясы жүруі нәтижесінде электродтық потенциал пайда болады.Кейбір электродтардың тотығу-тотықсыздану электродтары деп аталу себебі мұндай электродтарда реакция металл мен ерітінді арасында емес, ерітіндінің өз ішінде өтеді.Тотығу-тотықсыздану электродтары (немесе редокс электродтар) инертті металдан және ішінде заттың тотыққан (OХ) және тотықсызданған (Red) түрлері бар ерітіндіден тұрады.Ерітіндіге батырылған инертті металл электродтық реакцияға қатыспай,тек өткізгіш ролін атқарады.
