
- •1.Закон сохранения массы в химических превращениях. Обоснование. Условия его выполнения.
- •2. Закон постоянства состава. Условия его выполнения.
- •4. Закон Авогадро. Относительная плотность газа.
- •7. Энтальпия химической реакции. Расчёт по табличным данным (обоснование).
- •5. Энергетические эффекты химических реакций. Формы выделения и поглощения энергии. Теплота и работа. Методы и условия их измерения (3 примера).
- •6. Энтальпия образования вещества, стандартное состояние вещества.
- •8. Энтропия вещества. Зависимость от температуры, объема, агрегатного состояния (причины зависимости). Предельные значения, единицы измерения.
- •10. Самопроизвольные и не самопроизвольные процессы в природе, приведите по 2 примера химических и не химических самопроизвольных и не самопроизвольных процессов).
- •11. Энергия Гиббса образования вещества. Температурная зависимость. Стандартное состояние вещества.
- •12. Энергия Гиббса химической реакции. Какой смысл величины и значение ΔrG для химических реакций? Обсудите, возможны ли реакции.
- •13. Химическое равновесие (стабильное, метастабильное, неустойчивое). Необходимые условия (возможности) достижения равновесия (скорость реакции, количества вещества, изолированность системы).
- •14. Обратимые, необратимые и практически необратимые реакции. Дайте определение. Приведите по три примера каждого случая. Условия, обеспечивающие существование обратимости.
- •17. Влияние температуры на химическое равновесие. Причины влияния. Приведите 2 примера реального использования изменения температуры для смещения равновесия.
- •18. Влияние концентрации на химическое равновесие. Причины влияния. Приведите 2 примера реального использования изменения концентрации, реагента или продукта для смещения.
- •20. Скорость химической реакции, методы ее определения (2 конкретных примера экспериментального определения скорости реакции), основной закон химической кинетики.
- •21. Порядок реакции. Экспериментальное определение порядка реакции (конкретный пример описания и расчета).
- •22. Влияние температуры на скорость химической реакции. Причины влияния. Уравнения Аррениуса. Приведите 2 примера реального использования изменения температуры для, изменения скорости.
- •23. Влияние концентрации на скорость химической реакции. Причины влияния. Приведите 2 примера реального использования изменения концентрации реагента для изменения скорости реакции.
- •25. Растворы (твердые жидкие газообразные - по 2 примера) Способы, выражения концентрации растворов. Процентная и молярная концентрация, мольная доля.
- •26. Электролиты, определение. Твердые и жидкие электролиты (по одному примеру). Механизм электропроводности.
- •27. Сильные и слабые электролиты (по 3 примера). Константа и степень диссоциации. Закон разбавления Оствальда.
- •28. Протолитические равновесия. Константа равновесия. Кислоты, основания, амфолиты (по 3 примера каждого класса).
- •29. Автопротолиз воды (рН, температурная зависимость). Ионное произведение воды, рН растворов, кислот, оснований, солей.
- •30. Кислоты: сильные и слабые. Растворимые в воде и нерастворимые. Применение. По 1 примеру.
- •31. Сильные и слабые основания. Растворимые и нерастворимые в воде. Применение (по 1 примеру).
- •32. Соли: средние, основные и кислые: растворимые и нерастворимые в воде. Применение (по 1 примеру).
- •34. Буферные системы (приведите 3 примера). Расчет рН буферного раствора на примере
- •35. Равновесие осадок-раствор. Насыщенный раствор. Пр. Условия образования и растворения осадка.
- •36. Коллоидные частицы, системы. Строение коллоидной системы на примере золей кремниевой кислоты и гидроксида железа (III). Коллоидные системы в природе
- •37. Симплексные и комплексные соединения. Координационное число. Константа устойчивости. Приведите по 2 примера устойчивых и неустойчивых комплексных ионов. Двойные соли.
- •38. Окислнтельно-восстанавительные процессы. Окислитепьно-восстановительные полуреакции. Э.Д.С. Суммарной окислительно-восстановительной реакции.
- •39. Электродный потенциал. Стандартный электронный потенциал. Ряд стандартных электронных потенциалов металлов. Уравнение Нернста.
- •40. Электролиз. Закон Фарадея. Электролиз водных растворов на примере электролиза водных солей хлорида меди и фторида натрия. Какими факторами определяется состав продуктов электролиза?
- •41. Понятие о волновой функции. Атомная орбиталь. Плотность вероятности, s, p, d –ао (симметрия).
12. Энергия Гиббса химической реакции. Какой смысл величины и значение ΔrG для химических реакций? Обсудите, возможны ли реакции.
а) ΔrG <0 б) ΔrG>0 (правильные ответы в обоих случаях да)
Реакция возможна (возможно, совершение полезной работы), как выше указывалось, что ΔrG <0. При ΔrG>0 реакция самопроизвольно не идет. При ΔrG = 0 имеет место равновесие.
Пример самопроизвольной химической реакции: восстановление Fe3O4 оксидом углерода (II): см. вопрос 10.
13. Химическое равновесие (стабильное, метастабильное, неустойчивое). Необходимые условия (возможности) достижения равновесия (скорость реакции, количества вещества, изолированность системы).
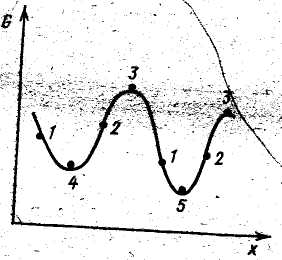
Рисунок показывает схему возможного изменения свободной энергии в некой системе при изменении какого-либо из ее параметров X (например, концентрации одного из веществ). В точках 1 изменение свободной энергии отрицательно и процесс происходит самопроизвольно слева направо (переводит систему в состояние, с большим рассматриваемым параметром и меньшей свободной энергией). В точках 2 при возрастании X свободная энергия возрастает, т.е. самопроизвольно процесс идти не может, требуется затрата энергии извне. В точках 3-5 свободная энергия не меняется ΔG = 0. Такие состояния системы называются равновесными. Отличием точек 3 от 4 и 5 является то, что любое изменение параметра сопровождается в них уменьшением G: при любом воздействии на систему начинается самопроизвольный процесс изменения параметра, сопровождающийся уменьшением свободной энергии. Следовательно, в точках максимумов система не может существовать конечное время. Такое равновесное состояние называется неустойчивым равновесием. В точках 4 и 4 изменения X приводят к увеличению G и система стремится возвратиться в исходное положение. Отличие точки 5 в том, что в ней система имеет свободную наименьшую энергию, она находится в стабильном равновесии. В остальных точках минимумов, которые не являются абсолютными, система находится в метастабильном состоянии. В метастабильном состоянии система может находиться сколь угодно долго, для перехода ее в стабильное состояние должен быть преодолен некоторый энергетический барьер - энергия активации ΔG.
14. Обратимые, необратимые и практически необратимые реакции. Дайте определение. Приведите по три примера каждого случая. Условия, обеспечивающие существование обратимости.
16. Принцип Ле-Шателье в применении к химическим системам (по 1 примеру гомогенных и гетерогенных равновесий и влияние на них различных факторов). К каким системам применим закон Ле-Шателье? Является ли принцип Ле-Шателье физическим, или химическим, или геологическим законом?
Если на систему, находящуюся в равновесии, оказывается внешнее воздействие, смещающее это равновесие, то равновесие смещается в сторону, указанную данным воздействием (ослабляющую его действие), до тех пор, пока нарастающее в системе противодействие не станет равно оказанному действию.
Принцип Ле-Шателье относится только к равновесным системам, т.е. таким, состояние которых соответствует минимуму свободной энергии, так что любое изменение, выводящее систему из равновесного состояния, сопровождается увеличением G, требует затрат работы, а самопроизвольным оказывается процесс, возвращающий систему в состояние равновесия. В химических системах, где равновесное состояние определяется отношением активностей веществ – компонентов системы, выражаемым соответствующей константой равновесия, новое состояние равновесия (т.е. снова ΔG = 0) возникает благодаря перераспределению величин активностей в результате изменения количеств веществ в реакционной смеси. Это перераспределение и есть «нарастающее в системе противодействие». Оно может реализоваться при неизменной константе равновесия (влияние давления и концентраций) или благодаря ей изменению (температурная зависимость). Принцип Ле-Шателье - Брауна, являющийся следствием второго закона термодинамики, определяющего направление процессов в различных системах, относится не только к химическим реакциям, но и к другим равновесным явлениям, в частности к фазовым равновесиям. Он распространяется не только на химические, мо и на различные физико-химические равновесия. Смещение равновесия при изменении условий таких процессов, как кипение, кристаллизация, растворение, происходит в соответствии с принципом Ле-Шателье. Пример:
2NO + О2 ↔ 2NO2
Смесь этих газов находится в химическом равновесии при определенной температуре и давлении. Не изменяя температуры, увеличим давление так, чтобы объем, системы уменьшился в 2 раза. В первый момент парциальное давления и концентрации всех газов возрастут вдвое, но при этом изменится соотношение между скоростями прямой и обратной реакции - равновесие нарушится. В том случае, когда реакция протекает без изменения числа молекул газов, равновесие не нарушается при сжатии или при расширении системы. Например, в системе: Н2+ I2 ↔ 2HI равновесие не нарушается при изменении объема; выход HI не зависит от давления.
Так, например, синтез аммиака представляет собой экзотермическую реакцию:
N2 + ЗН2 = 2NH3, ΔН = -92,4 кДж
Поэтому при повышении температуры равновесие в системе Н2 - N2 - NH3 сдвигается влево - в сторону разложения аммиака, так как этот процесс идет с поглощением теплоты.
И наоборот, синтез оксида азота (II) представляет собой эндотермической реакцию:
N2 + О2 = 2NO, ΔН = 180,5 кДж. Поэтому при повышении температуры равновесие в системе N2 – О2 - NО сдвигается вправо - в сторону образования NО.
