
- •Оглавление
- •Введение
- •Маннитол и его свойства
- •Химическое строение
- •Физические свойства
- •Общее применение
- •Фармакологические свойства Фармакодинамика
- •Фармакокинетика
- •Маннитол как препарат
- •Нозологическая классификация (мкб-10)
- •Применение маннитола в медицине
- •Мочегонные средства. Общие сведения
- •Осмотические диуретики
- •Механизм действия
- •Аналоги маннитола (по типу действия)
- •Осмотический эффект и фармакологические основы применения маннитола в нейрореаниматологии и нейрохирургии
- •Антиоксидантные свойства маннитола
- •Клиническое применение маннитола
- •Осложнения и побочные эффекты при применении маннитола
- •Применение в ветеринарии
- •Применение при острой почечной недостаточности
- •Применение при тепловых поражениях
- •Применение при лечении менингитов
- •Применение при лечении глаукомы
- •Заключение.
- •Библиографический список Русскоязычная литература:
- •Иностранные источники:
- •Приложение:
Физические свойства
Маннит представляет собой лиофилизированную массу светло-желтого цвета или бесцветные кристаллы со сладким вкусом.
Растворим в воде, очень легко – в горячей. Хорошо растворим в спирте. Нерастворим в эфире.
tпл 166 °С; tkип 276—280 °С/133,322 н/м2 (т. е. 1 мм pm. ст.), удельное вращение [α]D25 -0,24° (вода)
Угол R−O−H в молекуле маннита равен 109°. Гидроксильный кислород находится в состоянии sp³ гибридизации.
Нахождение в природе
Впервые маннит выделен из застывшего сока кавказского ясеня (так называемой «манны»), в больших количествах (до 25-30 %) также содержится в соке платана, в ламинарии (морской капусте) и других морских водорослях, в маслинах, свекле, луке, сельдерее, инжире, в грибах.
Получение
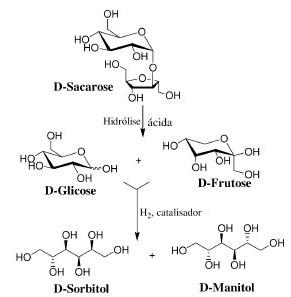
В промышленности D-маннит получают из морских коричневых водорослей с помощью горячего спирта (Pedro S. M. de Oliveira, 2009) или каталитическим гидрированием сахарозы по схеме (рис. 3):
 (рис.
3)
(рис.
3)
Далее маннитол легко выделается из технической смеси с сорбитолом.
Химические свойства
Кислотно-основные свойства
Кислотные свойства
В связи с тем, что маннит является многоатомным спиртом, он обладает слабыми кислотными свойствами и способен к диссоциации по связи О-Н с образованием алкоксид-ионов (1):
![]() (1)
(1)
Основные свойства
Спирты могут также вести себя как слабые основания Льюиса, образовывая с сильными минеральными кислотами соли алкоксония (2), а также давая донорно-акцепторные комплексы с кислотами Льюиса (3).
![]() (2)
(2)
![]() (3)
(3)
Обычно подобные реакции не останавливаются на указанной стадии и ведут к нуклеофильному замещению гидроксильной группы или отщеплению воды.
Химические реакции
Все химические реакции спиртов можно разделить на три условных группы, связанных с определёнными реакционными центрами и химическими связями:
Разрыв связи O−H (реакционный центр — водород);
Разрыв или присоединение по связи С−OH (реакционный центр — кислород);
Разрыв связи −СOH (реакционный центр — углерод).
Особенностью маннита является способность при аккуратном окислении переходить в глюкозу.
Его шестиазотный эфир, так называемый нитроманнит, С6H8(O.NО2)6 кристаллизуется в виде игл, с температурой плавления 112-113°, при осторожном нагревании постепенно разлагается, при ударе же взрывает и имеет некоторое значение как взрывчатое вещество.
Маннит имеет ось симметрии, способен к реакциям этерификации и нуклеофильного замещения, это, в сочетании с его низкой стоимостью, делает его использование в реакциях сложного органического синтеза очень выгодным и удобным.
Особое значение имеет то, что из маннита часто синтезируют вещества, которые редко и в небольших количествах встречаются в природе, но обладают сильными лекарственными свойствами.
Например, (+)-Mycalamides, вещество, которое было выделено из губок рода Микале, обитающих только вблизи порта Отаго в Новой Зеландии. Это вещество даже в малых концентрациях обладает сильными противоопухолевыми, противовирусными и иммуносупрессивными свойствами.
Процесс синтеза, который впервые был осуществлен группой ученых из Японии (Kagawa, N.; Ihara, M.; Toyota, M.; Org. Lett. 2006), изображен на схеме (см. Приложение)
