
- •3. Обмен углеводов, липидов и азотистых веществ
- •3.1. Обмен углеводов
- •3.1.1. Фотосинтез
- •3.1.1.1. Световая стадия фотосинтеза
- •3.1.1.2. Темновая стадия фотосинтеза
- •3.1.1.3. Фотодыхание
- •3.1.1.4. Ассимиляция со2 у с4-растений
- •3.1.1.5. Эффективность использования энергии при фотосинтезе
- •3.1.1.6. Конечные продукты фотосинтеза
- •3.1.2. Дыхание
- •3.1.2.1. Гликолиз
- •3.1.2.2. Цикл ди- и трикарбоновых кислот
- •3. 1.2.4. Окислительное фосфорилирование
- •3.1.2.5. Энергетический выход реакций дыхания
- •3. 1.2.6. Пентозофосфатный цикл
- •3.1.3. Взаимопревращения моносахаридов
- •3.1.4. Синтез и превращения олигосахаридов
- •3.1.5. Синтез и распад полисахаридов
3.1.2.2. Цикл ди- и трикарбоновых кислот
У растений и других аэробных организмов пировиноградная кислота подвергается окислению до СО2 и Н2О в ходе реакций, промежуточными продуктами которых являются ди- и трикарбоновые кислоты. Поскольку указанные реакции впервые были изучены Г.А. Кребсом (1937) и осуществляются в виде циклических превращений они получили название цикла Кребса или цикла ди- и трикарбоновых кислот. Ферменты, катализирующие реакции цикла Кребса, локализованы в матриксе или во внутренней мембране митохондрий.
Непосредственно в реакции цикла Кребса вступает производное пировиноградной кислоты – ацетил-КоА, которое образуется в результате окислительного декарбоксилирования пировиноградной кислоты, катализируемого мультиферментным пируватдегидрогеназным комплексом. Фер-ментный комплекс растворён в матриксе митохондрий и состоит из трёх ферментов: декарбоксилазы с тиаминпирофосфатом в качестве кофермента; дигидролипоилдегидрогеназы, содержащей ФАД; дигидролипоилтрансацетилазы, представляющей собой сердцевинный фрагмент в мультиферментном комплексе, включающий остатки липоевой кислоты. Продуктами окислительного декарбоксилирования пировиноградной кислоты являются ацетил-КоА, восстановленные динуклеотиды НАД Н и СО2:
СН3
|
С=О + HS–KoA + НАД+ CH3–C~S–KoA + НАД Н+ + Н+ + СО2
| ||
СООН О
пировиноград- ацетил-КоА
ная кислота
НАД Н включается в различные восстановительные реакции, катализируемые дегидрогеназами, или, как мы увидим далее, становится донором электронов и протонов для системы окислительного фосфорилирования, локализованной в мембранах митохондрий. Ацетил-КоА, как и пировиноградная кислота – важный промежуточный продукт обмена веществ организмов. Он используется для синтеза жирных кислот, углеводов и многих аминокислот и также образуется при их распаде.
В
СН–СООН
СН2–СООН (1)
|| +
СН3–СS–КоА
+ Н2О |
С(ОН)–СООН
|| С(ОН)–СООН + НS–КоА
О
|
енольная
форма СН2–СООН
щавелевоуксусной
ацетил-КоА лимонная
кислоты
кислота
СН–СООН
СН2–СООН (1)
|| +
СН3–С~S–КоА
+ Н2О ¾® |
С(ОН)–СООН
|| С(ОН)–СООН + НS–КоА
О
|
енольная
форма СН2–СООН
щавелевоуксусной
ацетил-КоА лимонная
кислоты
кислота
Фермент цитратсинтазу аллостерически ингибирует повышенная кон-
центрация АТФ. Поэтому при высокой обеспеченности клетки энергией,
когда повышается концентрация АТФ, вследствие ингибирования цитратсинтазы в реакции цикла Кребса будет меньше включаться ацетил-КоА и больше использоваться на биосинтетические процессы.
В
СН2–СООН СН2–СООН
(2)
| |
С(ОН)–СООН
С–СООН +
Н2О
| ||
СН2–СООН СН–СООН
лимонная
кислота цис-аконитовая
кислота
В последующей реакции цис-аконитовая кислота под действием того же фермента присоединяет молекулу воды, превращаясь в изолимонную кислоту:
СН2–СООН СН2–СООН
(3)
| |
С–СООН + Н2О
СН–СООН
|| |
СН–СООН СН(ОН)–СООН
цис-аконитовая
изолимонная
кислота
кислота
Изолимонная кислота окисляется в щавелевоянтарную кислоту под действием НАД- или НАДФ-специфичного фермента изоцитратдегидрогеназы (1.1.1.41). Образовавшаяся щавелевоянтарная кислота самопроизвольно декарбоксилируется, превращаясь в -кетоглутаровую кислоту:
СН2–СООН
СН2–СООН СН2–СООН
(4)
| НАД(Ф)+
| |
СН–СООН
СН–СООН СН2
+ СО2 + НАД(Ф)
Н + Н+
| |
|
СН(ОН)–СООН
СО–СООН СО–СООН
изолимонная
щавелевоянтарная -кетоглутаровая
кислота
кислота кислота
Фермент изоцитратдегидрогеназа ингибируется высокой концентрацией НАД Н и аллостерически активируется лимонной кислотой. Это – опережающая активация, когда определённый метаболит (в данном случае лимонная кислота) активирует ферменты, катализирующие его последующие превращения.
П
СН2–СООН
СН2–СООН
(5)
| |
СН2 +
НS–КоА + НАД+
СН2–СS–КоА
+ СО2+ НАД Н
+ Н+
|
||
СО–СООН
О -кетоглутаровая
сукцинил-КоА
кислота
В
СН2СООН
СН2СООН
(6)
| + Н3РО4
+ АДФ | +
НSКоА
+ АТФ
СН2СSКоА
СН2СООН
||
О
янтарная кислота
сукцинил-КоА
К
СН2СООН
HOOC H
(7)
| \ /
CH2COOH
+ ФАД
C = C + ФАД
Н2
/ \
H
COOH
янтарная кислота
фумаровая кислота
В
НООС Н
(8)
\ /
СН2–СООН
С = С + Н2О
|
/ \
СН(ОН)–СООН
Н СООН
фумаровая кислота
яблочная кислота
В дальнейшем яблочная кислота окисляется в щавелевоуксусную кислоту с участием НАД-специфичного фермента малатдегидрогеназы (1.1.1.37):
СН2СООН
СН2СООН
(9)
| + НАД+
| +
НАД Н + Н+
СН(ОН)СООН
СОСООН
яблочная
кислота щавелевоуксусная
кислота
К
СН2СООН
СНСООН
(10)
|
||
СОСООН
С(ОН)СООН
кетоформа
енольная форма
щавелевоуксусной
щавелевоуксусной
кислоты
кислоты
После этого енольная форма щавелевоуксусной кислоты может взаи-
имодействовать с новой молекулой ацетилкофермента А, и рассмотренный
нами цикл реакций будет повторяться снова.
Если исключить промежуточные продукты, образующиеся в реакциях окислительного дикарбоксилирования пировиноградной кислоты и цикла Кребса, и записать только вещества, входящие в этот цикл и выходящие из него при условии полного прохождения всех указанных выше реакций, то можно получить следующее суммарное уравнение:
СН3ССООН + 2Н2О + 3НАД+ + НАД(Ф)+ + ФАД + Н3РО4 + АДФ
||
О
3СО2 + 3НАД Н + НАД(Ф) Н + ФАД Н2 + 4Н+ + АТФ
Из этого уравнения следует, что пировиноградная кислота в ходе происходящих превращений окисляется с образованием трёх молекул СО2 и пяти молекул восстановленных динуклеотидов НАД Н, НАДФ Н и ФАД Н2. Источником кислорода для реакций окисления служат молекулы воды, две из них показаны в левой части уравнения и одна высвобождается при взаимодействии Н3РО4 и АДФ. Молекулы воды также являются донорами электронов и протонов для синтеза восстановленных динуклеотидов.
Как видим, молекулы кислорода не принимают прямого участия в реакциях цикла Кребса, хотя указанные реакции и активируются кислородом. Непосредственное участие кислорода в реакциях дыхания происходит на стадии окисления восстановленных динуклеотидов, образующихся при окислительном декарбоксилировании пировиноградной кислоты и в реакциях цикла Кребса, с участием ферментных комплексов, локализованных во внутренних мембранах митохондрий. Эти процессы будут рассмотрены далее.
Кроме восстановленных динуклеотидов в цикле Кребса синтезируется также АТФ из неорганического фосфата и АДФ путём реализации механизма субстратного фосфорилирования при фосфоролизе сукцинил-КоА.
В реакциях окислительного декарбоксилирования пировиноградной кислоты и цикла Кребса образуются не только важные биоэнергетические продукты, но и промежуточные метаболиты, с участием которых осуществляется связь обмена углеводов с обменом липидов, аминокислот, белков и других органических веществ в организме. Такими метаболитами являются ацетил-КоА и сукцинил-КоА, -кетоглутаровая, щавелевоуксусная, яблочная, лимонная, изолимонная, цис-аконитовая, фумаровая кислоты. Они могут включаться в синтез липидов, азотистых веществ, фенольных и терпеноидных соединений.
Поскольку в реальных физиологических условиях из цикла Кребса постоянно потребляются на различные биосинтетические процессы те или иные промежуточные метаболиты, циклический ход регенерации щавелевоуксусной кислоты полностью не завершается и для обеспечения хода реакций цикла постоянно поддерживается необходимая концентрация щавелевоуксусной кислоты в матриксе митахондрий путём её дополнительного синтеза.
У
СН2
СН2СООН
|| |
СОⓅ
+ СО2 + Н2О
СО + Н3РО4
| |
СООН СООН
фосфоенолпиро-
щавелевоуксусная виноградная
кислота кислота
Таким образом, цикл Кребса является связующим звеном в обмене различных групп органических веществ и конечным этапом их окисления. В ходе этих реакций высвобождается значительное количество энергии окисляющихся субстратов и связывается главным образом в виде восстановленных форм динуклеотидов НАД Н и ФАД Н2, энергия которых используется для синтеза АТФ.
3.1.2.3. Окисление биоэнергетических продуктов цикла Кребса
У аэробных организмов восстановленные формы динуклеотидов НАД Н и ФАД Н2 подвергаются окислению молекулярным кислородом на заключительной стадии процесса дыхания. Их окисление катализируют ферментные комплексы, входящие в состав внутренней мембраны митохондрий, которую в настоящее время называют электронтранспортной цепью митохондрий (ЭТЦ). По современным представлениям она включает следующие компоненты:
2ē,2Н+ 2ē,2Н+
НАД Н + Н+ ФМН
ФАД Н₂
2ē,2Н+
↓ 2ē 2ē 2ē 2ē 2ē 2ē
КоQ цит. b цит. с1 цит. с цит. а цит. а3 1/2О2 Н2О
↑
2Н+
Как видно из приведенной схемы, электроны и протоны от ФАД Н2 и НАД Н передаются на кофермент Q, который, превращаясь в восста-новленную форму, становится активным донором электронов для последовательности переносчиков, состоящей из цитохромов. Протоны высвобождаются в физиологическую среду и далее взаимодействуют с ионизированными атомами кислорода, образуя молекулы воды: 2Н+ + О2- Н2О. Ионизация кислорода происходит в результате переноса на него электронов от цитохромной системы под действием фермента цитохромоксидазы, имеющего в своем составе цитохромы а и а3.
Кофермент Q, или убихинон, как и пластохинон, относится к липидорастворимым производным хинона, содержащим в хиноидной группировке метоксильные группы и ненасыщенный изопреноидный радикал, включающий от шести до десяти изопреновых группировок. У млекопитающих и растений структура убихинона включает десять изопреновых группировок. Кофермент Q способен присоединять два электрона и два протона и превращаться в восстановленную форму:
О ОН
‖ |
С С
⁄ ╲ ∥ ╲
Н3СО–С С–СН3 СН3 Н3СО–С С–СН3 СН3
‖ ‖ | | ‖ |
Н3СО–С С–(СН2–СН=С–СН2)10Н Н3СО–С С–(СН2–СН=С–СН2)10Н
╲ ⁄ \\ ⁄
С С
‖ |
О ОН
окисленный восстановленный
убихинон убихинон
Окисленную форму убихинона принято записывать в виде символа КоQ или Q, восстановленную – КоQ Н2.
Большинство ферментов электронтранспортной цепи митохондрий связаны c их внутренней мембраной, плотность которой выше, чем у внеш-ней мембраны, и она содержит в своем составе больше белков и меньше фосфолипидов. В отличие от легкопроницаемой внешней мембраны внутренняя мембрана митохондрии непроницаема для многих соединений (за исключением нейтральных молекул с молекулярной массой менее 150).
Путём фрагментирования физическими и химическими методами внутренней мембраны метохондрий исследователям-биохимикам удалось выделить четыре ферментных комплекса, которые катализируют перенос электронов и протонов на определённых участках электронтранспортной цепи митохондрий. Перенос электронов и протонов между этими связанными с мембранами ферментными комплексами осуществляют подвижные переносчики – убихинон и цитохром c. Ферментные комплексы I, III и IV пронизывают внутреннюю митохондриальную мембрану и способны осуществлять перенос через мембрану протонов, создавая таким образом трансмембранный электрохимический потенциал.
Ферментный комплекс I осуществляет перенос электронов и протонов от НАД Н, образующихся в цикле Кребса, на кофермент Q. Передача двух электронов и двух протонов происходит со стороны внутреннего матрикса митохондрии на флавинмононуклеотид (ФМН), входящий в состав ферментного комплекса I (рис. 3.4). Затем электроны передаются с участием FeS-белков от ФМН Н2 на димер убихинона 2Q, а протоны высвобождаются на внешней стороне митохондриальной мембраны.
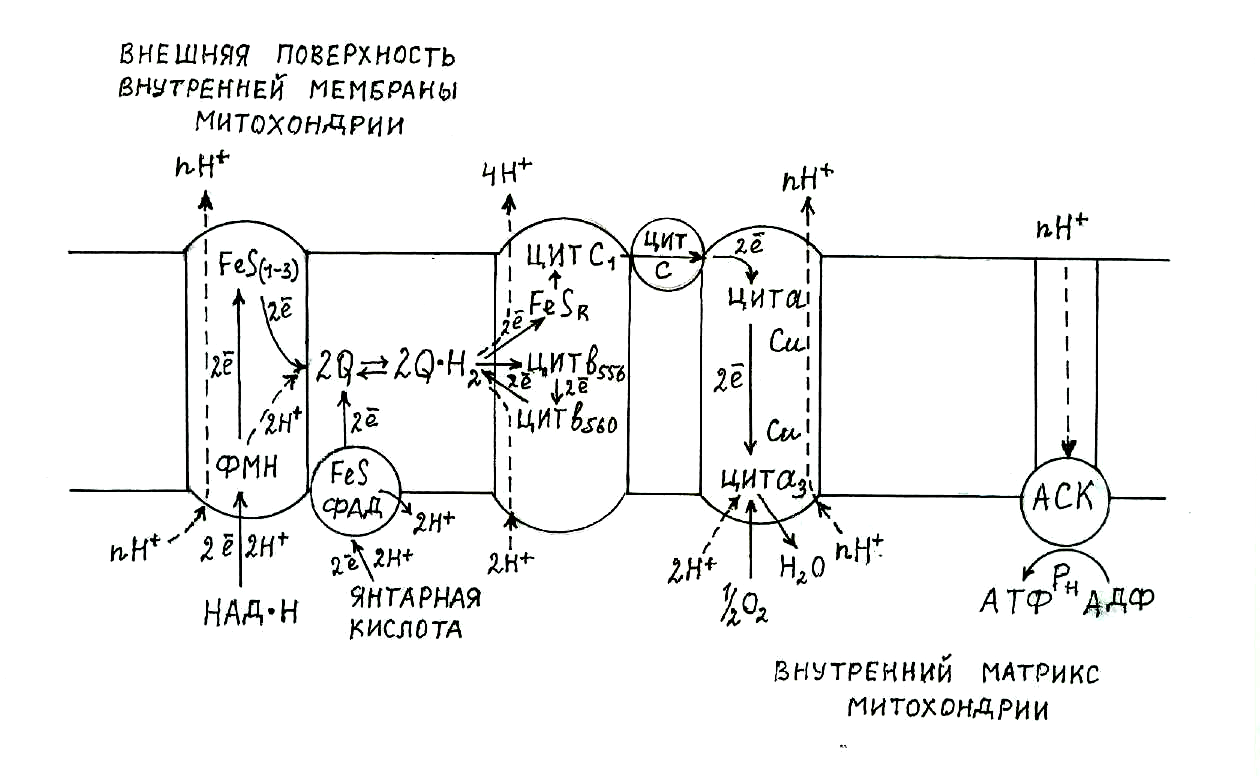
Рис. 3.4. Схема переноса электронов и протонов по системе переносчиков, локализованных во внутренней мембране митохондрий
FeS(1–3) – железосерные белки ферментного комплекса I; ФМН – акцептор электронов и протонов от НАД × Н в составе ферментного комплекса I; ФАД – акцептор электронов и протонов от янтарной кислоты в составе ферментного комплекса II; FeS – железосерные белки ферментного комплекса II; FeSR – железосерный белок Риске в составе ферментного комплекса III; цит. в556, цит. в560, цит. c1 – цитохромы в составе ферментного комплекса III; цит. а, цит. а3 – цитохромы в составе ферментного комплекса IV; 2Q D 2Q × Н2 – липидорастворимый переносчик электронов и протонов (убихинон); цит. c – водорастворимый переносчик электронов (цитохром с); АСК – АТФ-синтетазный комплекс.
Окисленный убихинон, приняв электроны от FeS-белка, присоединяет два протона из внутреннего матрикса и превращается в восстановленную форму 2Q Н, которая диффундирует через липидную фазу митохондриальной мембраны к ферментному комплексу III. В составе ферментного комплекса III имеются цитохромы с₁, в556 и в560, а также железосерный белок Риске (FeSR). Этот ферментный комплекс переносит электроны от восстановленного убихинона на цитохром с и одновременно выполняет функцию Н+-помпы, т.е. осуществляет трансмембранный перенос протонов.
При взаимодействии с ферментным комплексом III восстановленная форма убихинона 2Q Н акцептирует два электрона от цитохрома в560 и в таком состоянии становится способной присоединить два протона из внутреннего матрикса митохондрии, превращаясь в восстановленную форму 2Q Н2. Полностью восстановленный кофермент Q передает два электрона цитохрому в556 и два электрона железосерному белку FeSR, который далее передает их цитохрому с₁. Цитохром в556, приняв два электрона от восстановленного кофермента Q, переводит далее в восстановленное состояние цитохром в560, который снова может быть донором электронов для восстановления подвижного переносчика электронов и протонов – убихинона.
В процессе передачи электронов от восстановленного убихинона 2Q Н2 на цитохром с с участием ферментного комплекса III происходит высвобождение четырёх протонов с внешней стороны внутренней мембраны митохондрии, что приводит к созданию определённой величины транс-мембранного электрохимического потенциала. Таким образом, с участием цитохромов в560 и в556 оказывается возможным при переносе каждой пары экектронов и протонов от ферментного комплекса I на цитохром с присоединение из внутреннего матрикса и перенос через мембрану двух дополнительных протонов. После передачи электронов и протонов на ферментный комплекс III восстановленный убихинон превращается в окисленную форму и может снова диффундировать через липидную фазу митохондриальной мембраны к ферментному комплексу I (или II) и акцептировать новую пару электронов и протонов и далее осуществлять их перенос на ферментный комплекс III и т. д.
Ферментный комплекс II катализирует окисление янтарной кислоты с участием кофермента ФАД и передает электроны окисленному убихинону. Передачу электронов от ФАД Н2 на убихинон выполняют железо-серные группировки FeS(1–3). Поскольку ферментный комплекс II не пересекает внутреннюю мембрану митохондрии, высвобождающиеся при окис-лении ФАД Н2 протоны остаются во внутреннем матриксе митохондрии и поэтому не используются для создания трансмембранного электрохимического потенциала. Однако при переносе каждой пары электронов от ФАД Н2 на цитохром с ферментный комплекс III осуществляет трансмембранный перенос двух протонов.
Функцию переноса электронов от ферментного комплекса III к ферментному комплексу IV выполняет водорастворимый белок цитрохром с, который способен перемещаться на внешней поверхности внутренней митохондриальной мембраны в жидкой физиологической среде, заполняющей пространство между внешней и внутренней мембранами митохондрии. Цитохром с акцептирует электроны от цитохрома с₁, находящегося в составе ферментного комплекса III, и перемещаясь в жидкой дисперсионной среде на внешней поверхности внутренней митохондриальной мембраны, передает их цитохрому а в составе ферментного комплекса IV, который кроме гемовой группировки содержит ещё атом меди, участвующий в переносе электронов. Восстановленный цитохром а передаёт электроны цитохрому a₃, в составе которого наряду с гемом активную роль в транспорте электронов выполняет атом меди. Восстановленный цитохром a₃, связывая кислород, ионизирует его атомы, отдавая им переносимые по цепи переносчиков электроны. Ионизированные атомы кислорода, взаимодействуя с протонами внутреннего митохондриального матрикса, образуют молекулы воды: О2- + 2Н+ Н2О.
Ферментный комплекс IV при переносе электронов от цитохрома с на кислород выполняет вместе с тем электрохимическую работу по переносу протонов из внутреннего митохондриального матрикса на внешнюю поверхность внутренней мембраны митохондрии.
В растительных клетках (в отличие от животных) с участием ферментов митохондрий происходит также окисление НАД Н, поступающих из цитоплазмы. В этом процессе участвуют флавиновые дегидрогеназы, локализованные как во внешней, так и во внутренней мембране митохондрии. Первые из них передают электроны от НАД Н, поступающих из цитоплазмы, на цитохром с, а вторые – окисленному убихинону. Восстановленные динуклеотиды НАДФ Н не способны передавать электроны и про-тоны в электронтранспортную цепь митохондрий, а передают их на окисленные динуклеотиды НАД (НАД+) в результате так называемой трансгидрогеназной реакции.
