
- •3. Обмен углеводов, липидов и азотистых веществ
- •3.1. Обмен углеводов
- •3.1.1. Фотосинтез
- •3.1.1.1. Световая стадия фотосинтеза
- •3.1.1.2. Темновая стадия фотосинтеза
- •3.1.1.3. Фотодыхание
- •3.1.1.4. Ассимиляция со2 у с4-растений
- •3.1.1.5. Эффективность использования энергии при фотосинтезе
- •3.1.1.6. Конечные продукты фотосинтеза
- •3.1.2. Дыхание
- •3.1.2.1. Гликолиз
- •3.1.2.2. Цикл ди- и трикарбоновых кислот
- •3. 1.2.4. Окислительное фосфорилирование
- •3.1.2.5. Энергетический выход реакций дыхания
- •3. 1.2.6. Пентозофосфатный цикл
- •3.1.3. Взаимопревращения моносахаридов
- •3.1.4. Синтез и превращения олигосахаридов
- •3.1.5. Синтез и распад полисахаридов
3.1.5. Синтез и распад полисахаридов
Синтез полисахаридов катализируют ферменты гликозилтрансферазы, которые осуществляют перенос остатков соответствующих моносахаридов, связанных с нуклеозиддифосфатными группировками, на акцептор, представляющий собой олигосахарид, который включает 2–4 соединённых О-гликозидными связями моносахаридных остатка. При этом могут синтезироваться полимеры, имеющие линейную (цепочечную) структуру или разветвлённые молекулы, состоящие как из одинаковых, так и из разных моносахаридных остатков. Многие гликозилтрансферазы представлены белками, которые связаны в определённых участках с внутриклеточными мембранами.
Синтез крахмала. Крахмал в растительных тканях представлен двумя полисахаридами – амилозой и амилопектином. Синтез амилозы начинается с активирования a-глюкозы путём фосфорилирования и образования аденозиндифосфатглюкозы (АДФ-глюкозы) под действием фермента АДФГ-пирофосфорилазы:
гексокиназа
глюкоза + АТФ ¾¾¾® глюкозо-6-фосфат + АДФ
фосфоглюко-
глюкозо-6-фосфат ¾¾¾® глюкозо-1-фосфат
мутаза
АДФГ-пиро-
глюкозо-1-фосфат + АТФ ¾¾¾® АДФ-глюкоза + Н4Р2О7
фосфорилаза
На следующем этапе с участием АДФ-глюкозы под действием фермента глюкозилтрансферазы синтезируется олигосахарид, состоящий из 2–4 остатков глюкозы, соединённых a(1®4)-связями. Фермент глюкозилтрансферазу очень часто называют D-ферментом. Образующийся под действием D-фермента олигосахарид далее служит акцептором для присоединения глюкозных остатков от АДФ-глюкозы при синтезе полимера.
Образование цепочечных структур молекул амилозы катализирует фермент АДФГ-крахмалглюкозилтрансфераза (2.4.1.21). Реакция протекает по следующей схеме:
(глюкоза)n + АДФ-глюкоза ¾® (глюкоза)n+1 + АДФ
первичный акцептор промежуточный продукт
полимеризации
В этой реакции с помощью указанного фермента остаток глюкозы от АДФ-глюкозы переносится на первичный акцептор, в результате чего его глюкозная цепь удлиняется на один остаток. Затем полученный продукт становится акцептором следующего остатка глюкозы и так продолжается присоединение глюкозных остатков от АДФ-глюкозы на соответствующий промежуточный акцептор, пока не закончится полный синтез молекулы амилозы.
В ходе синтеза амилозы образуется длинная цепь (до 300) глюкозных остатков, соединённых О-гликозидными a(1®4)-связями. При этом следует отметить, что остатки глюкозы в процессе синтеза крахмала всегда присоединяются к нередуцирующим концам полисахаридной цепи акцептора (т.е. со стороны НО-группы четвёртого углеродного атома глюкозы).
Синтез в молекулах амилопектина a(1®6)-связяей, за счёт которых образуются разветвлённые молекулы, осуществляется с участием так назы-ваемого Q-фермента, получившего по современной номенклатуре ферментов название a-глюкантрансферазы (2.4.1.18). Этот фермент способен катализировать перенос определённого участка полиглюкозной цепи на НО-группу шестого углеродного атома одного из глюкозных остатков прилегающей и параллельно расположенной полисахаридной цепи. Расстояние между ответвлениями в цепи зависит от природы фермента.
Донором глюкозных остатков для синтеза крахмала может также служить УДФ-глюкоза, но при этом скорость реакции очень сильно замедляется. Однако в клетках животных организмов основным источником глюкозных остатков для построения молекул гликогена (аналога крахмала) служит УДФ-глюкоза.
Распад крахмала. Распад молекул крахмала может происходить путём гидролиза или фосфоролитических реакций. Гидролитическое расщепление a(1®4)-связей в молекулах крахмала катализируют амилазы: a-амилаза (3.2.1.1), b-амилаза (3.2.1.2), глюкоамилаза (3.2.1.3).
a-Амилазы действуют на a(1®4)-связи между точками ветвления и способны расщеплять молекулы амилопектина на более мелкие фрагменты, представляющие собой низкомолекулярные полисахариды – декстрины. Для проявления каталитической активности a-амилаз необходимо при-сутствие в реакционной среде хлорид-ионов, которые служат активаторами фермента. Без участия a-амилаз невозможно полное гидролитическое расщепление молекул амилопектина.
Под действием b-амилаз происходит гидролитическое расщепление a(1®4)-связей на концах полисахаридных цепей целых молекул или декстринов с образованием b-мальтозы. Действие этих ферментов прекращается при достижении точек ветвления молекул амилопектина, в которых глюкозные остатки соединены a(1®6)-связями.
Глюкоамилазы, как и b-амилазы, катализируют гидролиз a(1®4)-связей на концах полисахаридных цепей, но в результате действия этих ферментов образуются молекулы глюкозы.
Гидролитическое расщепление a(1®6)-связей в точках ветвления молекул амилопектина катализируют R-ферменты, которые называют амилопектин-1,6-глюкозидазами (3.2.1.9)
Под действием всего набора амилолитических ферментов крахмал гидролизуется с образованием мальтозы и глюкозы. Однако на мальтозу также действуют ферменты, относящиеся к гидролазам, a-глюкозидазы (3.2.1.20), которые расщепляют молекулы мальтозы с образованием глюкозы. Схематически действие гидролитических ферментов на молекулу крах-мала показано на рисунке 3.5. Препараты, содержащие амилолитические ферменты, используются в производстве хлеба, пива, пищевого спирта, а также в качестве кормовых добавок в животноводстве для улучшения переваривания крахмала, содержащегося в кормах.
Фосфоролитическое расщепление молекул крахмала катализируют ферменты a-глюканфосфорилазы (2.4.1.1). Под действием этих ферментов осуществляется перенос глюкозных остатков от молекул крахмала на ортофосфорную кислоту, при этом в качестве основного продукта реакции образуется глюкозо-1-фосфат, который далее может быть использован для синтеза УДФ-глюкозы или включаться в реакции анаэробной стадии дыхания. Фосфорилазы действуют на крахмал совместно с амилазами. Вначале крупные молекулы крахмала в виде амилопектина гидролизуются α-амилазами с образованием декстринов, на которые уже далее действуют другие амилазы и α-глюканфосфорилазы. Реакции фосфоролиза крахмала проходят по следующей схеме:
(глюкоза)n + Н3РО4 ¾® глюкозо-1-фосфат + (глюкоза)n-1
крахмал
О собенно
высокая активность амилаз и
a-глюканфосфорилаз
наблюдается при прорастании семян,
клубней и луковиц, когда в них происходит
интенсивный распад полисахаридов
крахмала и увеличивается концентрация
декстринов, мальтозы и глюкозы,
используемых для формирования тканей
проростков.
собенно
высокая активность амилаз и
a-глюканфосфорилаз
наблюдается при прорастании семян,
клубней и луковиц, когда в них происходит
интенсивный распад полисахаридов
крахмала и увеличивается концентрация
декстринов, мальтозы и глюкозы,
используемых для формирования тканей
проростков.
Рис. 3.5. Действие гидролитических ферментов на молекулу крахмала
В процессе распада крахмал не только может превращаться в мальтозу и глюкозу, но также и в сахарозу. Наиболее активно такие превращения происходят в листьях растений с фотосинтетическим крахмалом. На первом этапе указанных превращений под действием соответствующего трансгликозилирующего фермента остатки глюкозы от крахмала переносятся на УДФ, в результате образуется УДФ-глюкоза:
(глюкоза)n + УДФ ¾® УДФ-глюкоза + (глюкоза)n-1
крахмал декстрин
Затем под действием фермента сахарозо-УДФ-глюкозилтрансферазы остаток глюкозы от УДФ-глюкозы переносится на фруктозу с образованием сахарозы:
УДФ-глюкоза + фруктоза D сахароза + УДФ
Совершенно очевидно, что в результате обращения указанных выше двух реакций возможно также превращение сахарозы в крахмал.
Синтез и распад полифруктозидов. В растениях обнаружены ферменты, катализирующие превращения сахарозы в полифруктозиды и свободную глюкозу. У некоторых растительных видов (мятликовые, лилейные, астровые, колокольчиковые) образовавшиеся при фотосинтезе углеводы превращаются в фруктозиды, которые затем поступают в созревающие семена или другие запасающие органы. Синтез фруктозидов происходит в вакуолях растительных клеток из сахарозы, поступающей по флоэме.
При биосинтезе полифруктозида инулинового типа остаток фруктозы от одной молекулы сахарозы присоединяются к фруктозному остатку другой молекулы сахарозы β(1→2)-связью под действием фермента фруктозилтрансферазы. В результате этой реакции образуется трисахарид, включающий один остаток глюкозы и два остатка остатка фруктозы, кроме того, высвобождается молекула глюкозы:
глюкоза-О-фруктоза + глюкоза-О-фруктоза ¾®
сахароза сахароза
¾® глюкоза-О-фруктоза-О-фруктоза + глюкоза;
трисахарид
глюкоза-О-фруктоза-О-фруктоза + глюкоза-О-фруктоза-О-фруктоза ¾®
¾® глюкоза-О-фруктоза-О-фруктоза-О-фруктоза + глюкоза-О-фруктоза
тетрасахарид сахароза
К синтезированному трисахариду под действием фермента 1-фрукто-зилтрансферазы осуществляется перенос остатка фруктозы от другой молекулы трисахарида с образованием новой b(1®2)-связи и высвобождением молекулы сахарозы. В дальнейшем под действием того же фермента на молекулу образовавшегося тетрасахарида вновь происходит перенос остат-ка фруктозы от исходного трисахарида. Удлинение полифруктозной цепи по указанному механизму будет продолжаться до тех пор, пока полностью не закончится синтез молекулы полифруктозида. В составе молекул полифруктозидов инулинового типа может содержаться до 50 фруктозных остатков.
Синтез полифруктозидов леванового типа осуществляется под действием фермента 6-фруктозилтрансферазы, катализирующего образование О-гликозидных связей в результате последовательного присоединения остатков фруктозы к шестому углеродному атому фруктозных остатков вначале сахарозы, а затем образующихся олиго- и полифруктозидов. При этом между остатками фруктозы в составе синтезируемых полифруктозидов возникают β(6→2)-связи и в полисахаридной цепи может содержаться до 200 фруктозных остатков.
В ходе синтеза полифруктозидов грамининового типа происходит присоединение фруктозных остатков как к остатку фруктозы в молекуле сахарозы, так и глюкозы. К глюкозе фруктозный остаток переносится с участием фермента 6-глюкозофруктозилтрансферазы от исходного трисахарида и присоединяется к шестому углеродному атому глюкозы β(6→2)-связью, а последующие фруктозные остатки присоединяются β(6→2)-свя-зями, как и при синтезе полифруктозидов инулинового типа. Синтез второй фруктозной цепи, которая присоединяется к остатку фруктозы сахарозной молекулы, осуществляется по такому же механизму, как и образование полифруктозидов инулинового типа. В молекулах полифруктозидов грамининового типа содержится 5–10 фруктозных остатков.
Распад молекул инулина происходит гидролитическим путём под действием фермента инулазы (3.2.1.7) с образованием свободной фруктозы и сахарозы. Другие полифруктозиды гидролизуются соответствующими гликозидазами, которые отщепляют остатки фруктозы от концов полифруктозидной цепи.
Синтез и распад целлюлозы. Молекулы целлюлозы построены из остатков b-D-глюкозы, соединённых b(1®4)-связями. В опытах in vitro с использованием бесклеточных ферментных экстрактов, выделенных из растений, показано, что синтез целлюлозы может осуществляться из УДФ-глюкозы или ГДФ-глюкозы (гуанозиндифосфатглюкозы), а также фрагментов целлюлозы (целлодекстринов), выполняющих роль акцепторов остатков b-глюкозы.
Содержащийся в составе этих экстрактов фермент целлюлозосинтетаза (2.7.7.34) катализирует синтез молекул целлюлозы по схеме:
[b-глюкоза]n + ГДФ-b-глюкоза [b-глюкоза]n+1 + ГДФ
Молекулы фермента образуют связанный с мембраной плазмалеммы полиферментный комплекс, который катализирует одновременный синтез многих молекул целлюлозы, формирующих микрофибриллу, в которой по-лимерные цепи из остатков β-глюкозы соединены водородными связями.
Молекулы целлюлозы расщепляются в основном путём гидролиза под действием фермента целлюлазы (3.2.1.4) с образованием целлобиозы. Особенно высокой целлюлазной активностью отличаются клетки многих почвенных микроорганизмов, а также клетки бактерий пищеварительной системы жвачных животных. Имеются также сведения о том, что и в листьях растений при их старении происходит процесс распада целлюлозы и превращения её в растворимые формы, которые затем подвергаются оттоку в созревающие семена или клубни (у картофеля).
Продукт гидролиза целлюлозы – целлобиоза подвергается гидролитическому расщеплению с участием фермента b-глюкозидазы (3.2.1.21) до свободной b-глюкозы.
Синтез и распад гемицеллюлоз. В биосинтезе гемицеллюлоз также принимают участие ферменты, катализирующие перенос остатков моносахаридов от их нуклиозиддифосфатпроизводных на соответствующий олигосахарид, служащий первичным акцептором при образовании полисахарида. В качестве донора остатков ксилозы для синтеза ксиланов используется УДФ-ксилоза. Донором остатков арабинозы при образовании молекул арабанов служит УДФ-арабиноза. Для синтеза маннанов активированной формой моносахаридных остатков для включения в состав полисахаридной цепи является ГДФ-манноза, для синтеза галактанов – ГДФ-галактоза. Синтез гемицеллюлоз происходит в аппарате Гольджи, а затем осуществляется их транспорт к клеточной стенке.
Распад гемицеллюлоз происходит в основном гидролитическим путём под действием ферментов гемицеллюлаз. Такие ферменты найдены в клетках бактерий и плесневых грибов, а также в прорастающих семенах растений. Активирование гемоцеллюлаз наблюдается в листьях растений в процессе их старения, при этом образующиеся в результате гидролиза гемицеллюлоз растворимые формы углеводов поступают в созревающие семена или клубни (у картофеля). Отмечается распад гемицеллюлоз и при созревании плодов у некоторых плодовых культур.
Синтез и распад пектиновых веществ. Пектины синтезируются из УДФ-галактуроновой кислоты, которая образуется при окислении УДФ-глюкозы или УДФ-галактозы, а также в результате активирования свободной галактуроновой кислоты путём фосфорилирования и взаимодействия с УТФ:
галактуроновая + АТФ ¾® 1-фосфогалактуроновая + АДФ
кислота кислота
1-фосфогалактуроновая + УТФ ¾® УДФ-галактуроновая + Н4Р2О7
кислота кислота
В ходе образования пектинов остатки -D-галактуроновой кислоты под действием специфических трансфераз переносятся от УДФ-галакту-роновой кислоты на соответствующий акцептор. Одновременно происходят реакции метилирования карбоксильных групп под действием фермента метилтрансферазы, катализирующего перенос метильных радикалов от S-аденозилметионина на полигалактуроновую кислоту:
п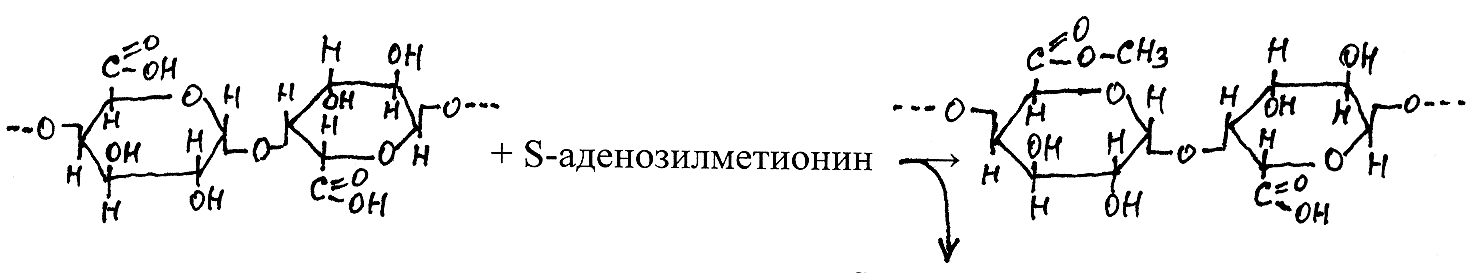 олигалактуроновая
S-аденозил-
пектин
олигалактуроновая
S-аденозил-
пектин
кислота гомоцистеин
При взаимодействии пектина с галактанами и арабанами осуществляется синтез сложноэфирных связей протопектина с участием карбоксильных групп, содержащихся в молекулах пектина. Эти реакции также катализируют специфические трансферазы, осуществляющие синтез протопектина в клеточных стенках растений или в формирующихся плодах.
Распад протопекина происходит гидролитическим путём под действием ферментов протопектиназ, катализирующих гидролиз сложноэфирных связей, соединяющих полимерные цепи пектина с галактанами и арабанами. Процессы гидролиза протопекинов очень активно протекают в растениях при созревании плодов и старении листьев.
Под действием фермента пектазы (3.1.1.11), катализирующего гидролиз сложноэфирных связей метоксильных групп, пектины превращаются в полигалактуроновую (пектиновую) кислоту и метиловый спирт. Полигалактуроновая кислота в отличие от пектина не обладает способностью образовывать желе, но очень легко взаимодействует с катионами металлов, образуя нерастворимые соли. На этом основано ее защитное действие в пищеварительной системе человека и животных по связыванию и выведению из организма катионов тяжелых металлов.
Пектиновая кислота подвергается гидролизу с участием фермента полигалактуроназы (3.2.1.15), или пектиназы, действующей на О-глико-зидные связи, соединяющие остатки -D-галактуроновой кислоты. Комплекс ферментов, гидролизующих пектиновые вещества, особенно активен в препаратах, получаемых из плесневых грибов. В связи с этим указанные препараты применяются для осветления плодовых соков и вин, содержащих растворимый пектин, который обусловливает их возможную непрозрачность.
Вопросы для самоконтроля
1. Как были открыты и изучены световые и темновые реакции фотосинтеза? 2. Какие функции выполняют молекулы хлорофилла в процессе фотосинтеза? 3. Каково участие каротиноидных пигментов в фотохимических реакциях? 4. Как под действием света инициируется перенос электронов и протонов по системе переносчиков, локализованных в тилакоидных мембранах хлоропластов? 5. Каковы механизмы нециклического и циклического транспорта электронов? 6. Какие механизмы реализуются в процессе синтеза восстановленных динуклеотидов НАДФ × Н и молекул АТФ с участием хлоропластного АТФ-синтетазного комплекса? 7. В какой последовательности происходит синтез гексозы из СО2 и Н2О в ходе реакций цикла Кальвина? 8. При каких условиях усиливаются реакции фотодыхания и как они влияют на эффективность процесса фотосинтеза? 9. Как происходит ассимиляция СО2 у С4-растений? 10. Какова эффективность использования энергии при фотосинтезе? 11. По каким механизмам происходит образование неуглеводных продуктов фотосинтеза? 12. Как влияют условия окружающей среды на выход продуктов фотосинтеза? 13. Как были открыты реакции биологического окисления, называемого дыханием? 14. По какому механизму и в какой последовательности осуществляются реакции гликолиза? 15. Какие химические и биоэнергетические продукты образуются в ходе гликолиза, а также из продуктов этого процесса? 16. Каковы механизмы превращения пировинградной кислоты в продукты реакций цикла Кребса? 17. Какие химические и биоэнергетические продукты образуются в реакциях цикла Кребса? 18. Как происходит окисление восстановленных динуклеотидов, образующихся в цикле Кребса, с помощью ферментных комплексов митохондриальных мембран? 19. Каков механизм окислительного фосфорилирования? 20. С какой эффективностью используется энергия дыхания для синтеза АТФ? 21. Как влияют факторы окружающей среды на интенсивность реакций дыхания в растительных клетках? 22. Какие биохимические реакции происходят в пентозофосфатном цикле и какова его биологическая роль? 23. Как происходит синтез из моносахаридов спиртов? 24. По какому пути осуществляется обращение реакций гликолиза и какое это имеет значение для организмов? 25. Какие известны взаимные превращения гексоз (глюкозы, фруктозы, маннозы и галактозы)? 26. Каковы механизмы образования в растительных организмах рибозы, ксилозы, арабинозы, эритрозы, глицеринового альдегида и диоксиацетона? 27. Как осуществляются синтез и превращения сахарозы и других олигосахаридов? 28. Какие биохимические реакции лежат в основе синтеза крахмала, полифруктозидов, целлюлозы, гемицеллюлоз, пектиновых веществ? 29. С участием каких ферментов происходит распад крахмала и других полисахаридов?
