
- •Практическое занятие № 3. Механизм репликации днк
- •Типы репликации кольцевых днк
- •I. Репликация днк e. Coli
- •Сравнительная характеристика днк-полимераз e. Coli
- •Элонгация
- •Терминация
- •II. Репликация днк эукариот
- •Репликация днк: праймер
- •Точки начала репликации
- •Точки начала репликации Saccharomyces cerevisiae
- •Сборка предрепликационного комплекса
- •Механизм синтеза эукариотической днк
Механизм синтеза эукариотической днк
Выше указывалось, что для инициации репликации ДНК, каждая точка начала репликации связывает комплекс [ORC·Cdc6p·Cdt1] и множество гексамерных комплексов Mcm. (Описание основных ферментов и белковых факторов, участвующих в репликации эукариотической ДНК приведено в табл. 4.2). Вполне понятно, что для начала репликации спаренные цепи материнской двойной спирали должны быть разделены. Это позволит ДНК-полимеразе связаться с ДНК и приступить к синтезу дочерних цепей.
Таблица 4.2
Ферменты и белковые факторы, необходимые для репликации ДНК в экстрактах эукариотических клеток
Активность |
Белок* (размер†) |
Узнавание точки начала репликации Вирус SV40 и исходные бесклеточные экстракты Эукариоты |
Большой Т антиген вируса SV40 (82 kD)
ORC (комплекс узнавания точки начала репликации) (120,72, 62, 56, 53, 50 kD) |
Активация точки начала репликации |
Протеин фосфатаза 2А (34, 32 kD) |
Разделение цепей ДНК (геликаза) |
Большой Т антиген вируса SV40 Mcm-белки |
Стабилизация одиночных цепей ДНК комплекс полимераза/праймаза |
RP-A (субъединицы: 70 [ssДНК связывание], р32, р11) ДНК-полимераза α (cубъедицы: р180 [полимераза], р70 [стимулирует сборку праймосомы], р58 [стабилизация и активация р48], р48 [праймаза]; отсутствие самокоррекции. |
Репликативные полимеразы |
ДНК-полимераза δ (р125 [полимераза], р48 + другие ДНК-полимераза ε (205, 70 kD обладает 3/→5/-экзонуклеазной корректирующей активностью. |
Вспомогательные факторы |
PCNA (36 kD); кольцеобразная «муфта», которая скользит вдоль ДНК; удерживает ДНК-полимеразы δ и ε на матричной цепи ДНК; включается в процесс координации регуляции клеточного цикла, репликации и репарации |
Вспомогательный белок для PCNA |
PFC (145, 40, 38, 37, 36.5 kD) связывается с участком праймер:матричная цепь; присоединение фактора PCNA; необходим для переключения (связывания) полимеразы |
Заключительные факторы удаление РНК-праймеров лигирование фрагментов ДНК удаление напряжения от суперспи-рализации разделение дочерних ДНК |
Fen1 5/→3/-экзонуклеаза (46 kD) + РНКаза H (49, 39 kD) ДНК-лигаза I (102 kD) ДНК-топоизомераза I (100 kD)
ДНК-топоизомераза II (175 kD) |
*Идентичность (тождественность) некоторых компонентов включаемых в реакции, приведенные в таблице, были впервые составлены, используя модель репликации ДНК in vitro. Эти системы базировались на процессе репликации ДНК в экстрактах клеток инфицированных вирусом SV40. Данный вирус обладает небольшим кольцевым геномом с определенной точкой начала репликации. Основная причина, почему вирус SV40 является настолько подходящей модельной системой для изучения репликации ДНК, заключается в том, что вирус использует только один вирусный белок – большой Т антиген – для его собственной репликации. Все остальные ферменты и белковые факторы репликации предоставляются клеткой-хозяином.
† Если не указано отдельно, размеры субъединиц приведены для белков человека.
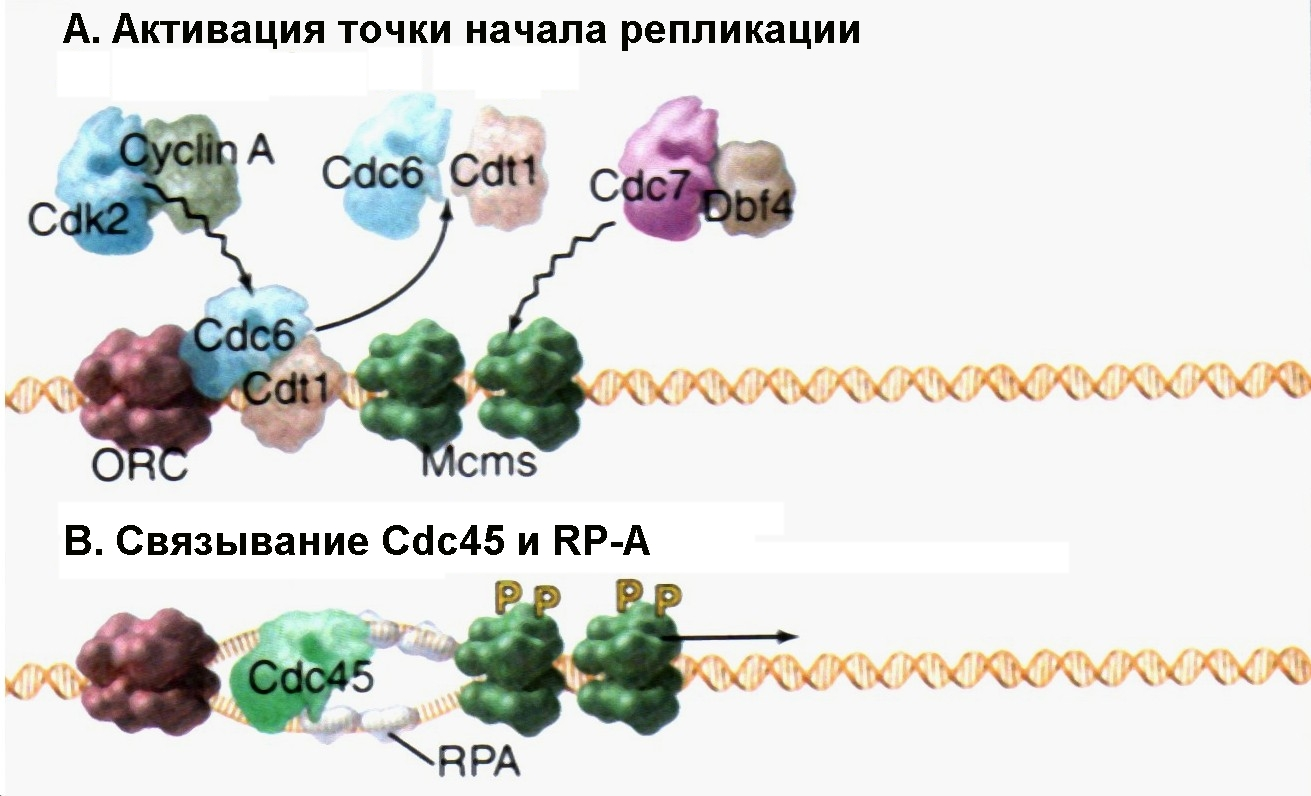
Рис. 4.17А-В |
Инициация репликации посредством фосфорилирования белка Cdc6p под действием киназы Cdk2-циклин А и фосфорилирования Mcm-геликазы киназой Cdc7p-Dbf4p (Pollard T.D., Earnshaw W.C., Cell Biology, Saunders, 2002). |
Репликация ДНК начинается с фосфорилирования Cdc6p и белков комплекса Mcm (см. рис. 4.17А). Роль фосфорилирования комплекса Mcm (с участием киназы Cdc7p-Dbf4p) еще до конца не установлена. Фосфорилирование же белка Cdc6p киназой Cdk2-циклин А (как указывалось выше) служит причиной того, что этот белок утрачивает способность взаимодействовать с белками Mcm, помогая тем самым начать репликацию. Фосфорилированные Cdc6p и Cdt1 покидают ДНК и движутся в цитоплазму (третий механизм регуляции «лицензирования»), где их судьба различна у разных организмов.
Например, в клетках млекопитающих изолированный в цитоплазме Cdc6p достаточно стабилен и используется повторно для связывания с точками начала репликации. У дрожжей цитоплазматический Cdc6p подвергается полному разрушению.
Исследования репликации ДНК у эукариот позволили установить, что следующий этап заключается в активации Mcm-геликазы (путем ее фосфорилирования) – фермента, который, используя энергию гидролиза АТР, разделяет спаренные цепи двойной спирали ДНК.
Высвобождение Cdc6p сопровождается связыванием c ДНК в точке начала репликации белка Cdc45p и ssb-белков эукариот – RP-A (рис. 4.17В). Полагают, что взаимодействие Cdc45p с комплексом Mcm способствует последующему связыванию белков RP-A с одноцепочечными участками ДНК. В настоящее время кажется вполне вероятным, что этот ассоциат тем или иным способом дополнительно активирует Mcm-геликазу. На следующей стадии белки Cdc45p и RP-A привлекают в точку начала репликации ДНК-полимеразу (рис. 4.17С). По мере того, как геликаза начинает разделять цепи ДНК, двигаясь в двух противоположных направлениях от точки начала репликации, белки RP-A стабилизируют разделенные цепи так, что исчезает потенциальная возможность спаривания оснований в пределах одной и той же одиночной цепи.
![]()
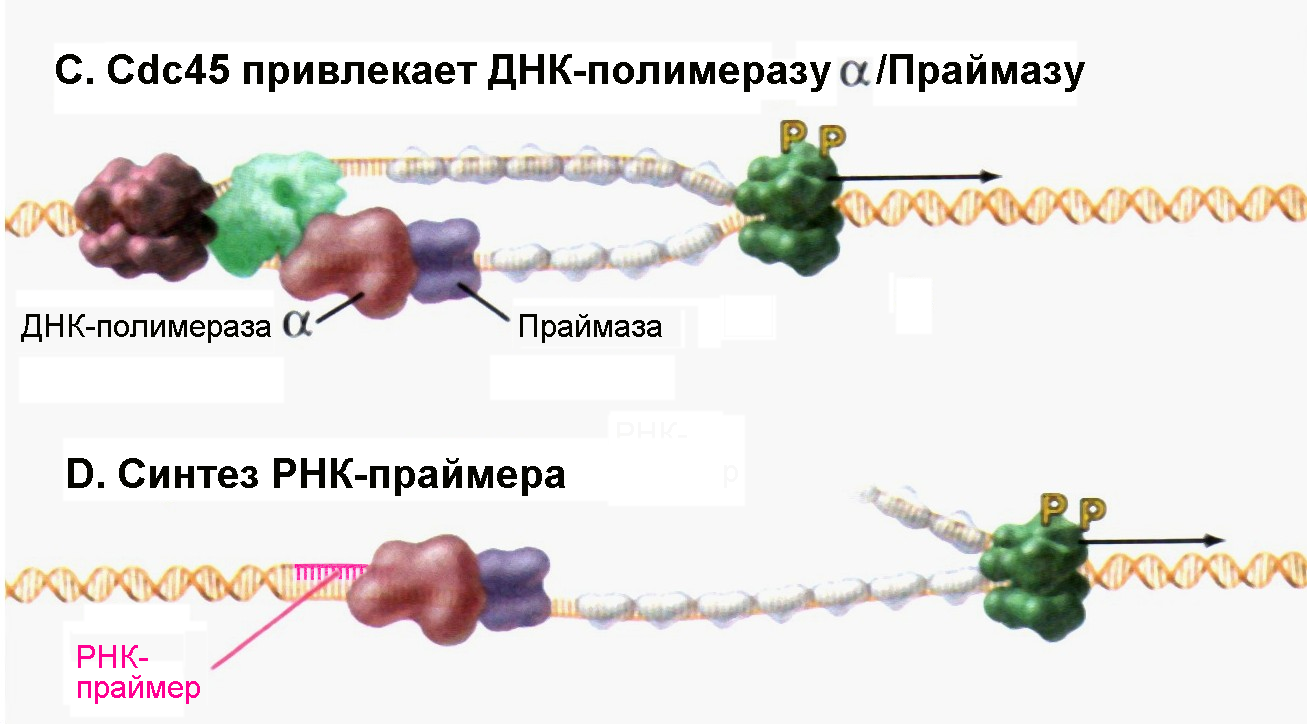
Рис. 4.17С-D |
Формирование комплекса ДНК-полимеразы α с праймазой обеспечивает начало синтеза РНК-праймера (Pollard T.D., Earnshaw W.C., Cell Biology, Saunders, 2002). |
Разделенные цепи двойной спирали ДНК готовы на этом этапе к процессу удвоения, но синтез цепей ДНК всегда включает присоединение приходящих нуклеозидтрифосфатов к свободной 3/-ОН-группе на конце предсуществующего полинуклеотида. Каким образом в отсутствие предсуществующей цепи ДНК со свободным 3/-ОН-концом ДНК-полимераза может осуществить начало синтеза? Эта проблема успешно разрешается благодаря участию ДНК-зависимой РНК-полимеразы, называемой праймазой, которая подобно другим РНК-полимеразам может инициировать синтез олигонуклеотида de novo, не нуждаясь при этом в наличии готового 3/-ОН-конца. У эукариот синтез цепей ДНК в любом случае начинается с участием всех субъединиц ДНК-полимеразы α и праймазы, которые в целом известны как комплекс ДНК-полимераза α/Праймаза. Праймаза синтезирует комплементарный материнской цепи фрагмент РНК размером около 10 нуклеотидов, к которому ДНК-полимераза α присоединяет 20-30 дезоксинуклеотидов, так называемой инициаторной ДНК (iДНК) (см. рис. 4.17D и Е). Эти инициаторные реакции синтеза ДНК являются потенциально опасными для этой информационной молекулы, поскольку ДНК-полимераза α не обладает какой-либо корректирующей активностью. Любые ошибочно присоединенные основания неизбежно вызовут появление мутации. Из сказанного выше следует, что все события, характерные для инициации репликации полного генома, потенциально могут приводить к появлению ошибок в структуре ДНК. Поэтому и РНК-праймер, и большая часть или даже вся iДНК, синтезированные с участием комплекса Polα/Primase, впоследствии замещаются «правильными» дезоксинуклеотидами.
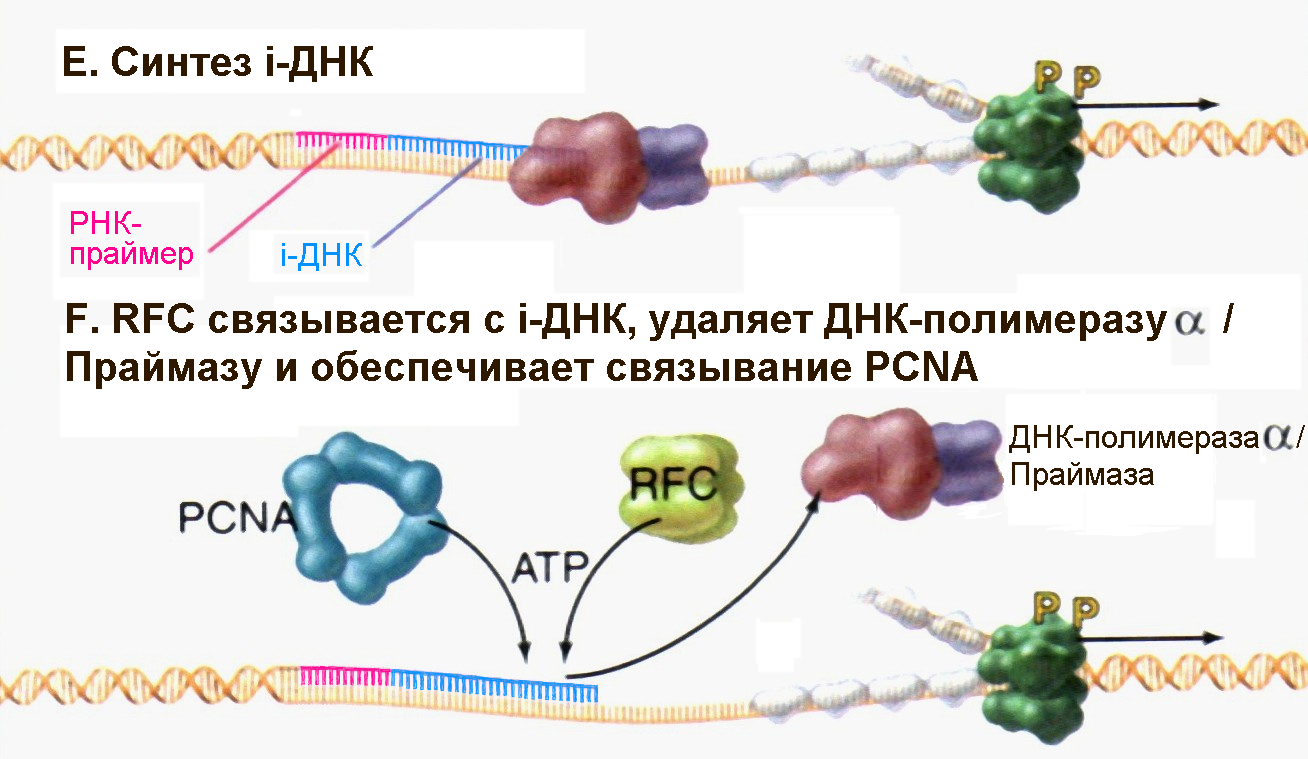
Рис. 4.17E-F |
После присоединения к РНК-праймеру 20-30 дезоксинуклеотидов, так называемой инициаторной ДНК (iДНК) под действием ДНК-полимеразы α белок RFC способствует отделению комплекса ДНК-полимераза α /Праймаза и связыванию тримерного белка PCNA (Pollard T.D., Earnshaw W.C., Cell Biology, Saunders, 2002). |
После того, как комплекс ДНК-полимераза α/Праймаза выполнил свою функцию, в репликацию включаются два других важных фактора. В частности, пентамерный белковый комплекс называемый RFC (replication factor C) связывается с 3/-концом инициаторной ДНК. Фактор RFC, используя энергию гидролиза АТР, обеспечивает присоединение к ДНК тримерного белка PCNA (рис. 4.17F и 4.17G). Тример PCNA имеет муфтообразную форму и после того как ДНК встраивается в его центральный канал, PCNA топологически защелкивается на материнской цепи ДНК. Связывание фактора RFC и защелкивание PCNA приводит к вытеснению комплекса ДНК-полимераза α/Праймаза и затем PCNA обеспечивает связывание ДНК-полимеразы δ (возможно и ДНК-полимеразы ε) с ДНК в области присутствия 3/-концевой ОН-группы инициаторной ДНК. Двигаясь вместе с тримером PCNA, который используется как подобие скользящей «платформы», ДНК-полимераза δ приступает к синтезу непрерывной дочерней цепи ДНК (рис. 4.17Н). На отстающей цепи ДНК-полимераза ε синтезирует фрагмент из примерно 250 нуклеотидов до тех пор, пока не натолкнутся на следующий фрагмент Оказаки. В настоящее время считают, что Cdc45p является тем остóвным фактором, который удерживает вместе гексамерную Mcm-геликазу и репликативные ДНК-полимеразы по мере движения репликативной вилки.
Как ДНК-полимераза δ, так и ДНК-полимераза ε обладают корректирующей экзонуклеазной активностью. Это позволяет им контролировать правильность присоединения нуклеотидов в новосинтезированной цепи ДНК и исправлять любые ошибки, которые они могут допустить в ходе реакции полимеризации. Данная способность ДНК-полимераз δ и ε к самокоррекции объясняет ту поразительную точность, с которой проходит репликация ДНК (обычно частота ошибок не превышает 1 на 109 пар оснований в реплицированной молекуле).
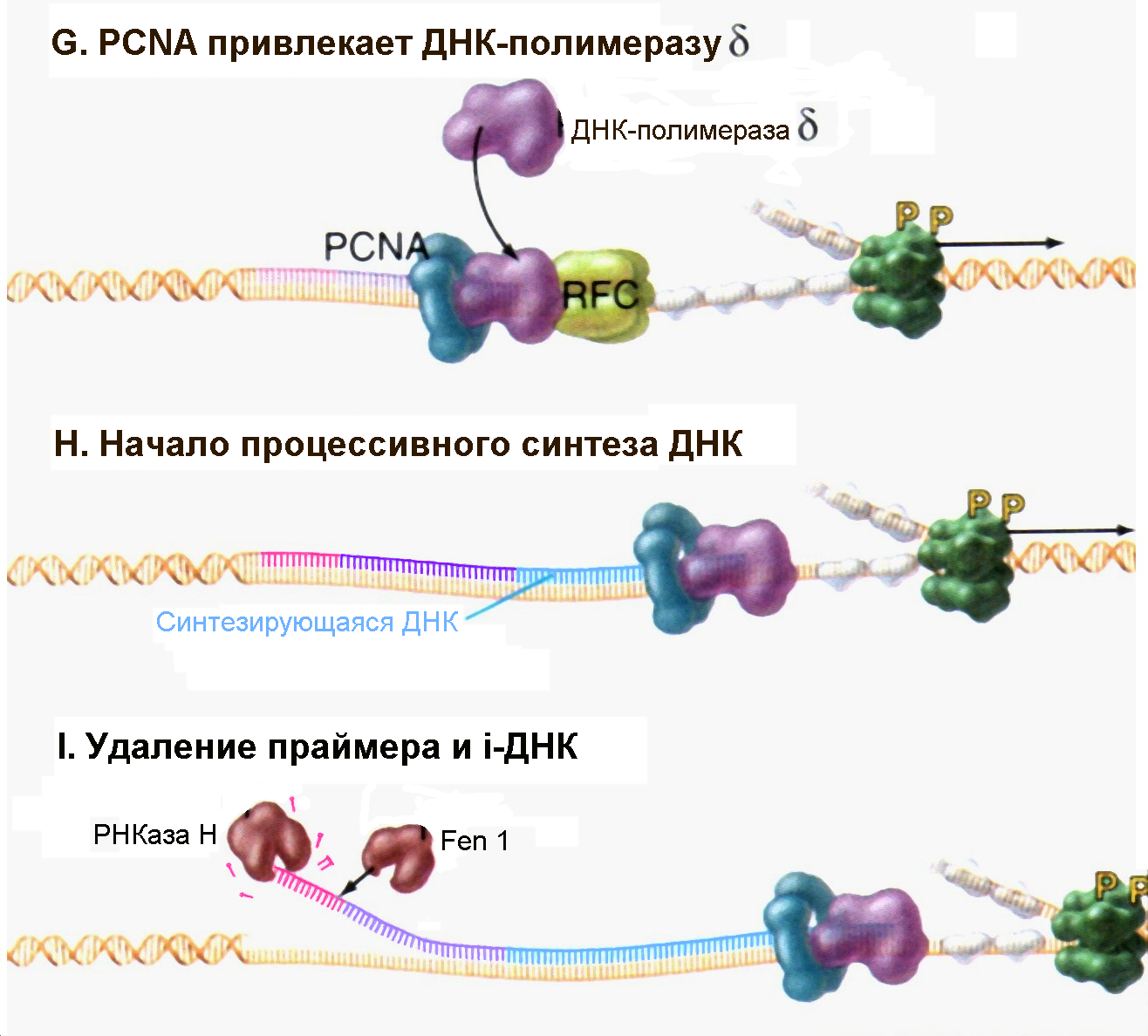
Рис. 4.17G-I |
После присоединения к РНК-праймеру 20-30 дезоксинуклеотидов, так называемой инициаторной ДНК (iДНК) под действием ДНК-полимеразы α белок RFC способствует отделению комплекса ДНК-полимераза α /Праймаза и связыванию тримерного белка PCNA (Pollard T.D., Earnshaw W.C., Cell Biology, Saunders, 2002). |
На заключительных стадиях репликации ДНК происходит удаление РНК-праймеров (а также инициаторной ДНК) и лигирование соседних фрагментов новосинтезированной ДНК. Удаление праймера может быть выполнено двумя способами (рис. 4.17I). С одной стороны, специфичная к РНК экзонуклеаза, называемая РНКазой Н (Rnase H), может выщеплять рибонуклеотиды праймера с его 5/-конца. Однако этот фермент не в состоянии удалить последний рибонуклеотид, который соединен с инициаторной ДНК. Его удаление требует присутствия другой нуклеазы, называемой Fen1. Белок Fen1 (являющийся экзонуклеазой) способен удалить весь праймер, но для этого требуется участие геликазы. В этом случае геликаза должна разделить цепочку праймера (а также инициаторной ДНК) и материнскую ДНК, создавая при этом как бы «ус». Затем Fen1 удаляет ненужные нуклеотиды, входящие в состав отделенного «уса» путем их отщепления в одну стадию по месту соединения с «правильной» ДНК. У дрожжей такая вспомогательная геликаза охарактеризована и названа белком Dna2.
После удаления инициаторной РНК (ДНК) комплекс Polδ/PCNA продолжает синтезировать дочернюю цепь ДНК до тех пор, пока не натолкнется на 5/-конец сформированный Fen1. После этого ДНК-лигаза I соединяет вместе две цепи ДНК.
