
- •Практическое занятие № 3. Механизм репликации днк
- •Типы репликации кольцевых днк
- •I. Репликация днк e. Coli
- •Сравнительная характеристика днк-полимераз e. Coli
- •Элонгация
- •Терминация
- •II. Репликация днк эукариот
- •Репликация днк: праймер
- •Точки начала репликации
- •Точки начала репликации Saccharomyces cerevisiae
- •Сборка предрепликационного комплекса
- •Механизм синтеза эукариотической днк
Практическое занятие № 3. Механизм репликации днк
Доказательство полуконсервативного способа репликации ДНК. Эксперимент Месельсона и Сталя. Репликативная вилка. Одно- и двунаправленная репликация.
Синтез ДНК начинается с расхождения цепей, каждая из которых служит матрицей для синтеза дочерней цепи. Продуктами репликации являются две дочерние молекулы ДНК, каждая из которых состоит из одной родительской и одной дочерней цепи. Такой способ репликации был постулирован Уотсоном и Криком и получил название полуконсервативного. До экспериментального подтверждения предположения о полуконсервативном способе репликации предлагались три альтернативных варианта удвоения ДНК: полуконсервативный, консервативный и мозаичный (или дисперсный). Существуют ли в природе консервативный или мозаичный способы репликации ДНК до сих пор неизвестно.
В 1958 году Месельсон и Сталь [1] с помощью новейшего на тот момент метода равновесной седиментации в градиенте плотности доказали, что молекулы ДНК удваиваются полуконсервативным способом. Для этого E. coli выращивали в течение многих поколений в среде, содержащей в качестве единственного источника азота 15NH4Cl. В результате такой процедуры весь азот 14N, содержащийся в исходной ДНК замещался на «тяжелый» 15N. Молекулы 14N-ДНК и 15N-ДНК различаются по массе всего на 1%. Однако этой разницы вполне достаточно для разделения таких молекул ДНК при центрифугировании в градиенте плотности хлористого цезия. Формирование линейного градиента плотности в центрифужной пробирке осуществляется при длительном центрифугировании пробирок, содержащих возрастающие сверху до низу концентрации хлористого цезия. В результате создается устойчивый градиент плотности от 1,66 до 1,76 г/см3. Под действием центробежной силы молекулы ДНК переходят в ту область градиента, в которой плотность раствора равна их собственной плавучей плотности. Высокополимерные молекулы ДНК образуют четко выраженную полосу, которую легко обнаружить по поглощению в ультрафиолете.
После полного замещения 14N в молекулах ДНК на «тяжелый» 15N, бактериальные клетки переносили в среду, содержащую 14NH4Cl. В результате одного цикла репликации ДНК дает одну полосу, детектируемую описанным выше способом. Плотность этой полосы в точности соответствовала среднеарифметическому значению плотностей 14N-ДНК и 15N-ДНК. Отсутствие полосы, характерной для чистой 15N-ДНК свидетельствовало о том, что целостность родительской (в данном случае - 15N-ДНК) ДНК в ходе одного акта репликации нарушается. С другой стороны, отсутствие полосы, характерной для чистой 14N-ДНК доказывало, что часть атомов во всех дочерних молекулах ДНК (гибриды, состоящие из 14N-ДНК и 15N-ДНК) происходит от родительской (15N-ДНК) ДНК. Соотношение количества 14N и 15N в дочерних ДНК составляло величину, равную 1, что вытекает из значения плотности гибридной ДНК, которое является среднеарифметической величиной плотностей 14N- ДНК и 15N-ДНК. После второго акта репликации были получены две полосы ДНК, одна из которых соответствовала гибридной ДНК, а вторая – чистой 14N-ДНК.
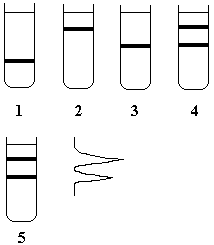
Рис. 4.1 |
Схема, иллюстрирующая эксперимент, доказывающий полуконсервативный способ репликации ДНК. 1 – «тяжелая» ДНК-15N, 2 – «легкая» ДНК-14N, 3 – гибридная ДНК, содержащая одну тяжелую и одну легкую цепи (результат одного акта репликации ДНК), 4 – «легкая» ДНК-14N (вверху) и гибридная ДНК (внизу) – результат второго акта репликации, 5 – сканирование зон ДНК в ультрафиолете. |
Следует, однако, отметить, что далеко не сразу и далеко не всеми исследователями была принята идея универсальности механизма полуконсервативной репликации ДНК. Изучение ДНК фага Х174 привело Р. Синсхаймера к выводу, что эта ДНК представляет собой одноцепочечную молекулу. Данный вывод однозначно вытекал из результатов целой серии, полученных им экспериментальных фактов:
соотношение количества оснований в ДНК фага Х174 не соответствовало правилу [A] = [T] и [G] = [C];
вязкость раствора ДНК фага Х174 была существенно ниже, чем вязкость раствора ДНК Escherichia coli при одинаковых концентрациях;
сравнение гидродинамических параметров поведения ДНК при центрифугировании показало, что ДНК фага Х174 соответствует полимеру, находящемуся в конформации случайного клубка, тогда как двухцепочечная ДНК Escherichia coli ведет себя как очень «жесткая палочка»;
аминогруппы оснований, входящих в состав ДНК фага Х174 обладают высокой реакционной способностью и легко взаимодействуют с муравьиным альдегидом, тогда как основания, находящиеся в составе двойной спирали практически не доступны для взаимодействия с этим реагентом.
Таким образом, обнаружение именно этой одноцепочечной ДНК породило сомнение в универсальности механизма полуконсервативной репликации ДНК. Однако, через незначительный промежуток времени было показано, что ДНК фага Х174 находится в одноцепочечной форме только на протяжении определенной части жизненного цикла вируса. Р. Синсхаймер сумел обнаружить в ходе дополнительных экспериментов, что инфицированные клетки Escherichia coli содержат двухцепочечную форму ДНК фага Х174, названную репликативной формой, поскольку она служит основой для синтеза ДНК фагового потомства. Вирусы, содержащие одноцепочечную РНК, также реплицируются через промежуточное образование двухцепочечных репликативных форм. Механизмы этих процессов будут подробнее рассмотрены в разделе, посвященном молекулярным механизмам функционирования вирусов и бактериофагов. Важно то, что эти механизмы подтверждают всеобщность схемы репликации, предложенной Уотсоном и Криком всего лишь на основании, созданной ими модели двойной спирали ДНК.
Рассмотрим молекулу ДНК, вступающую в репликацию. Репликация начинается с определенной точки, которая получила название точки начала репликации и представляет собой определенную последовательность, состоящую из 200-400 пар оснований. Исследования, проведенные в начале 1960-х годов на реплицирующихся хромосомах, в которые в качестве метки вводили радиоактивный 3H-тимидин, выявили особую четко ограниченную область репликации, перемещающуюся вдоль родительской ДНК. Эта активная область из-за своей Y-образной формы получила название репликативной вилки. Репликативная вилка движется последовательно вдоль ДНК от стартовой точки - точки начала репликации.
Репликация может осуществляться либо в одном, либо в двух направлениях от стартовой точки. При однонаправленной репликации вдоль ДНК движется одна репликативная вилка. При двунаправленной репликации от точки начала в противоположных направлениях движутся две репликативные вилки.
С помощью электронной микроскопии реплицирующейся ДНК удалось установить, что область, которая уже реплицирована, имеет вид глазка внутри нереплицированной ДНК. Этот глазок выглядит одинаково как в случае одной, так и в случае двух репликативных вилок.
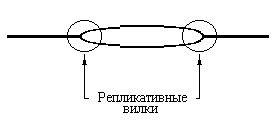
Рис. 4.2 |
Репликационный глазок присутствует при однонаправленной и при двунаправленной репликации. |
В любом случае, продолжающаяся репликация расширяет глазок до тех пор, пока он не включит в себя весь репликон.
Содержит ли реплицирующийся глазок одну или две репликативные вилки можно определить двумя способами. Выбор метода зависит от того, является ли ДНК определенной молекулой или неопределенной частью клеточного генома.
В случае определенной линейной молекулы ДНК используют электронную микроскопию, с помощью которой определяют расстояние от каждого конца глазка до конца молекулы ДНК. Если сравнить во времени положение концов глазка от конца молекулы ДНК и окажется, что только один из концов будет подвижным, а другой фиксированным, то репликация происходит посредством одной репликативной вилки (рис. 4.3).
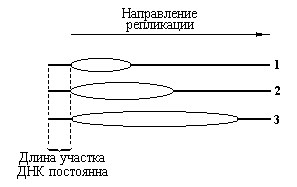
Рис. 4.3 |
Схема, иллюстрирующая процесс репликации ДНК посредством одной репликативной вилки. 1, 2 и 3 – различные стадии расширения глазка во времени. |
Если репликация двунаправленная, перемещаться будут оба конца глазка. Для определения количества репликативных вилок в кольцевых молекулах ДНК, их сначала переводят в линейную форму посредством расщепления с помощью какой-либо рестриктазы, а затем исследуют с помощью электронной микроскопии, оценивая расстояния от концов глазка до концов молекулы ДНК, как уже описано выше.
Для того, чтобы пометить движение репликативных вилок в неопределенных областях больших геномов, используют радиоактивные метки. Радиоавтография таких препаратов показывает, что однонаправленная репликация приводит к появлению метки только в одном конце глазка.

Рис. 4.4 |
Однонаправленная репликация ДНК. Тонкой линией показана немеченная ДНК, невидимая на радиоавтограмме. Жирной линией показаны участки ДНК, содержащие метку. |
Двунаправленная репликация приводит к появлению метки с обеих сторон данной структуры.
Рис. 4.5 |
Двунаправленная репликация ДНК. Тонкой линией показана немеченная ДНК, невидимая на радиоавтограмме. Жирной линией показаны участки ДНК, содержащие метку. |
