
- •Глава XVII развитие теории квантов. Атом резерфорда – бора
- •Развитие теории квантов а. Эйнштейном
- •Открытие атомного ядра
- •Теория атома Нильса Бора
- •Опыты Франка и Герца
- •Развитие квантовой теории атома
- •Открытие характеристического рентгеновского излучения
- •Успехи и трудности теории Бора - Зоммерфельда
- •Принцип соответствия
- •Открытие спина электрона
- •Опыты Штерна и Герлаха
- •Принцип Паули
- •Глава XVIII создание квантовой механики
- •Гипотеза де Бройля
- •Возникновение квантовой статистики
- •Матричная механика Гейзенберга
- •Введение в квантовую механику линейных операторов
- •Волновая механика Шредингера
- •Статистическая интерпретация волновой функции
- •Открытие дифракции электронов
- •Развитие интерпретации квантовой механики
- •Дискуссия Бора с Эйнштейном
- •Глава XIX развитие ядерной физики и физики элементарных частиц в первой половине XX столетия
- •Открытие изотопов
- •Открытие протона
- •Гипотеза протонно-электронного строения ядер
- •Гипотеза нейтрино
- •Открытие нейтрона
- •Протонно-нейтронная модель атомного ядра
- •Открытие сильных взаимодействий
- •Создание первых ускорителей
- •Первые эксперименты по нуклон-нуклонному рассеянию
- •Гипотеза зарядовой независимости ядерных сил
- •Зарождение квантовой теории электромагнитного поля
- •Открытие релятивистского волнового уравнения для электрона
- •Открытие позитрона
- •Теория -распада Ферми
- •Мезонная теория ядерных сил
- •Открытие мезонов
- •Дальнейшее развитие ядерной физики
- •Развитие модельных представлений о строении ядер
- •Развитие представлений об источниках энергии излучения звезд
- •Открытие деления ядер
- •Осуществление цепной реакции деления ядер
- •Открытие мезонов
- •Разработка оболочечной и обобщенной моделей ядра
- •Развитие квантовой электродинамики
- •Открытие к-мезонов и гиперонов
- •Физики и физико-химики лауреаты Нобелевской премии
В
Теория атома Нильса Бора
начале того же 1913 года датский физик
Нильс Бор разработал основные положения
теории атома водорода, составившие
первую, самую существенную часть его
работы «О строении атомов и молекул».
Опираясь на развитые Резерфордом
представления о планетарном строении
атома, Бор предпринял попытку теоретического
обоснования устойчивости атома и
закономерностей спектров излучения.
Существенным моментом боровской теории
был отказ от ряда принципов классической
физики.
Убежденным сторонником планетарной модели атома Бор стал в 1912 году во время стажировки в Манчестере у Резерфорда. Много лет спустя в мемориальной лекции памяти Резерфорда Бор вспоминал: «В раннюю пору моего пребывания в Манчестере, весной 1912 года, я пришел к убеждению, что строение электронного роя в резерфордовском атоме управляется квантом действия – постоянной Планка h». Догадка Бора сводилась к предчувствию, что есть глубокая связь между существованием наименьшей величины для размеров электронных орбит в атоме и существованием наименьшей величины для физического действия. Однако успех пришел не сразу.
Событие, которое стало для Бора решающим толчком, произошло в начале февраля 1913 года в Копенгагене. По совету своего университетского сокурсника, спектроскописта Ханса Хансена, Бор ознакомился со спектральными формулами Бальмера, Ридберга и Ритца. Формула Бальмера потрясла его своей элементарностью. Из одной величины – переменной – вычиталась другая – постоянная для данной серии. Формула Бальмера для частот сразу же стала в глазах Бора формулой для квантов энергии, излучаемых водородом. Уменьшаемая величина в формуле Бальмера соответствует энергии атома до испускания кванта, вычитаемая – энергии атома после испускания. Разность – квант.
После этой догадки становился очевидным смысл комбинационного принципа Ритца: кванты света могут рождаться при переходах электронов с любой более высокой орбиты на любую нижележащую. Но тогда, согласно спектральным формулам, возможные значения энергии электрона в атоме получались дискретными, и в ряду разрешенных уровней энергии должен был существовать уровень с наименьшей, отличной от нуля энергией. То есть радиус первой, ближайшей к ядру, орбиты задавал размер атома в устойчивом основном состоянии.
Характерная особенность созданной Бором теории состояла в том, что каждое из основных ее положений было недоказуемо, но все вместе они создавали убедительную картину. Боровская теория опиралась на два постулата:
-
Атомы могут длительное время пребывать только в определенных стационарных состояниях, в которых они не излучают и не поглощают энергию. В этих состояниях атомы обладают энергиями, образующими дискретный ряд значений
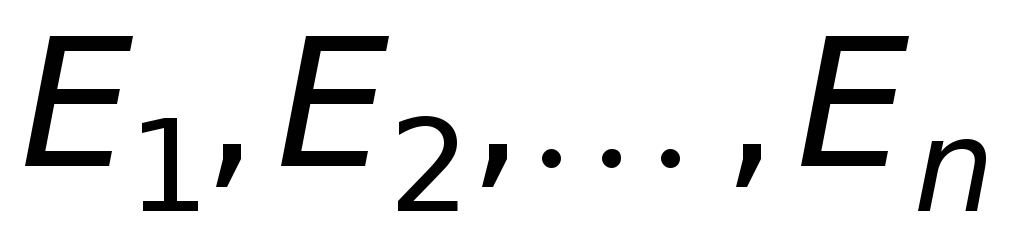 .
Всякое изменение энергии в результате
ее поглощения или излучения может
происходить только скачком из одного
состояния
.
Всякое изменение энергии в результате
ее поглощения или излучения может
происходить только скачком из одного
состояния
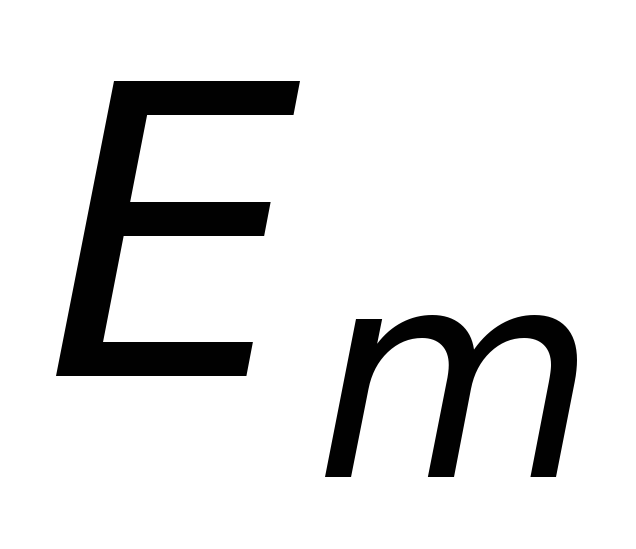 в другое
в другое
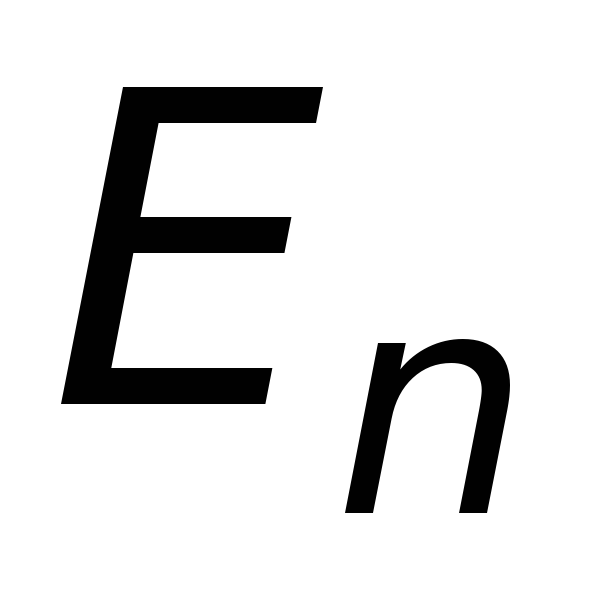 .
. -
Излучение, испускаемое или поглощаемое при переходе из состояния
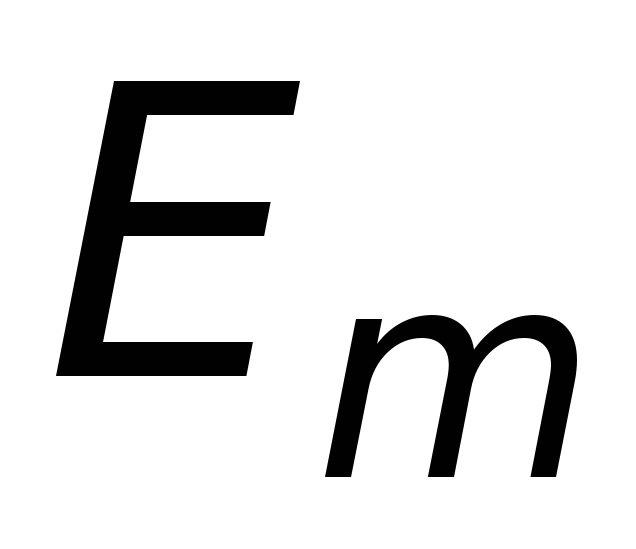 в состояние
в состояние
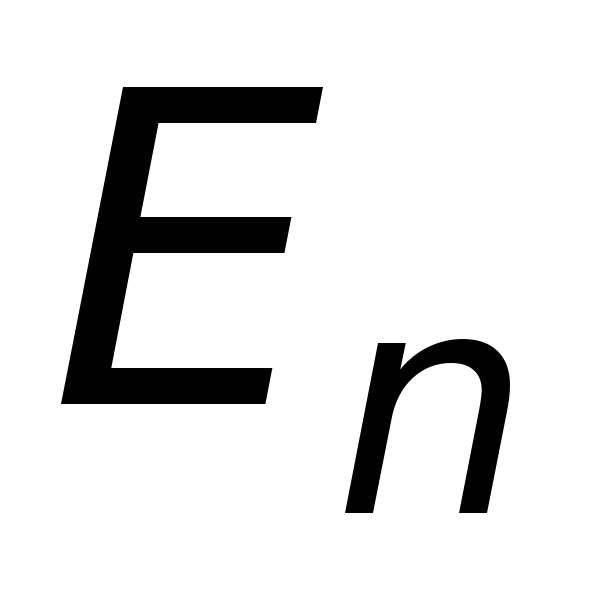 ,
монохроматично; его частота определяется
соотношением
,
монохроматично; его частота определяется
соотношением
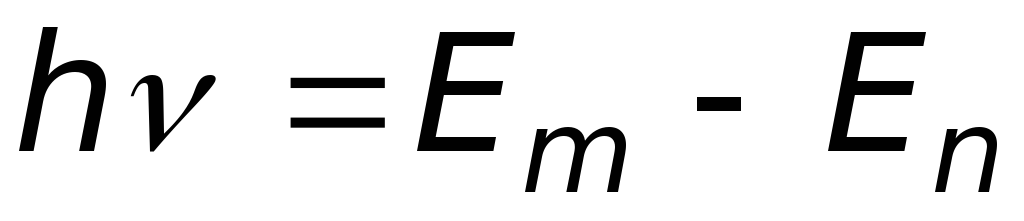 .
.
Оба постулата резко противоречили максвелловской электродинамике. По первому постулату атомы не излучают, несмотря на ускоренное движение электронов, по второму – частоты испускаемого излучения не имеют ничего общего с частотами периодического движения электронов.
Однако
возникал вопрос, какие же орбиты электрона
в атоме являются стационарными? Для
разрешения этого вопроса Бор выдвинул
гипотезу, что стационарными являются
орбиты, энергия электрона на которых
по модулю равна
![]() ,
где
– частота обращения электрона по орбите,
h
– постоянная Планка, n
– целое число. Как писал позже сам Бор,
эта гипотеза возникла у него по аналогии
с гипотезой Планка о том, что энергия
осциллятора может принимать лишь
дискретные значения
,
где
– частота обращения электрона по орбите,
h
– постоянная Планка, n
– целое число. Как писал позже сам Бор,
эта гипотеза возникла у него по аналогии
с гипотезой Планка о том, что энергия
осциллятора может принимать лишь
дискретные значения
![]() .
У осциллятора средние значения
кинетической и потенциальной энергии
совпадают:
.
У осциллятора средние значения
кинетической и потенциальной энергии
совпадают:
![]()
![]() ,
поэтому, согласно гипотезе Планка,
,
поэтому, согласно гипотезе Планка,
![]() .
При движении электрона в атоме водорода
кулоновская сила взаимодействия с ядром
играет роль центростремительной:
.
При движении электрона в атоме водорода
кулоновская сила взаимодействия с ядром
играет роль центростремительной:
![]() ,
откуда следует:
,
откуда следует:
![]() .
Потенциальная энергия электрона
.
Потенциальная энергия электрона
![]() ,
следовательно, для полной энергии
получается
,
следовательно, для полной энергии
получается
![]() .
Таким образом, полная энергия электрона
в атоме водорода по модулю совпадает с
кинетической энергией. Поэтому Бор и
предположил, что возможные значения
энергии электрона в атоме водорода
совпадают со средними значениями
кинетической энергии осциллятора.
.
Таким образом, полная энергия электрона
в атоме водорода по модулю совпадает с
кинетической энергией. Поэтому Бор и
предположил, что возможные значения
энергии электрона в атоме водорода
совпадают со средними значениями
кинетической энергии осциллятора.
Кинетическая
энергия T
электрона, обращающегося по круговой
орбите вокруг ядра, связана с моментом
импульса M
соотношением
![]() ,
поэтому Бор переформулирует условие
квантования в виде
,
поэтому Бор переформулирует условие
квантования в виде
![]() .
(17.2)
.
(17.2)
Приняв за основу это условие квантования, Бор смог вычислить разрешенные значения энергии электрона в атоме водорода
![]() (17.3)
(17.3)
и радиусы стационарных орбит
![]() .
(17.4)
.
(17.4)
Отсюда следовала формула для частот линий в спектре атома водорода:
![]() .
(17.5)
.
(17.5)
Эта формула, переписанная для спектроскопических волновых чисел, имела вид:
![]() ,
(17.6)
,
(17.6)
где
![]() – постоянная Ридберга для атома водорода.
В дальнейшем Бор уточнил свою теорию,
рассмотрев движение ядра и электрона
вокруг общего центра масс. При этом для
постоянной Ридберга получилось:
– постоянная Ридберга для атома водорода.
В дальнейшем Бор уточнил свою теорию,
рассмотрев движение ядра и электрона
вокруг общего центра масс. При этом для
постоянной Ридберга получилось:
![]() ,
,
где
![]() –
масса ядра.
Вычисленное значение постоянной Ридберга
практически совпало с эмпирически
найденным из точнейших спектроскопических
измерений.
–
масса ядра.
Вычисленное значение постоянной Ридберга
практически совпало с эмпирически
найденным из точнейших спектроскопических
измерений.
«Мы
видим, – писал Бор, – что это соотношение
объясняет закономерность, связывающую
линии спектра водорода. Если взять
![]() и варьировать m,
получим обычную серию Бальмера. Если
взять
и варьировать m,
получим обычную серию Бальмера. Если
взять
![]() ,
получим в инфракрасной области серию,
которую наблюдал Пашен и еще ранее
предсказал Ритц. При
,
получим в инфракрасной области серию,
которую наблюдал Пашен и еще ранее
предсказал Ритц. При
![]() и
и
![]() …
получим в крайней ультрафиолетовой и,
соответственно, крайней инфракрасной
областях серии, которые еще не наблюдались,
но существование которых можно
предположить».
…
получим в крайней ультрафиолетовой и,
соответственно, крайней инфракрасной
областях серии, которые еще не наблюдались,
но существование которых можно
предположить».
Действительно,
серия в ультрафиолетовой области,
отвечающая
![]() ,
была обнаружена Лайманом в 1916 году,
серия в инфракрасной области,
соответствующая
,
была обнаружена Лайманом в 1916 году,
серия в инфракрасной области,
соответствующая
![]() ,
найдена Брэкетом в 1922 году, а серия,
отвечающая
,
найдена Брэкетом в 1922 году, а серия,
отвечающая
![]() ,
– Пфундом в 1924 году.
,
– Пфундом в 1924 году.
Перед тем, как отправить статью в печать, Бор послал ее Резерфорду. Резерфорд в ответном письме от 20 марта 1913 года отметил, что взгляды Бора «на механизм рождения водородного спектра очень остроумны и отлично разработаны». Но Резерфорд отметил и уязвимое место теории Бора: « … сочетание идей Планка со старой механикой делает весьма затруднительным физическое понимание основы такого механизма».
