
- •Правила техники безопасности. Знакомство с техникой выполнения лабораторных работ. Основные свойства важнейших классов неорганических веществ.
- •Лабораторная работа № 1 Основные классы неорганических соединений
- •Порядок выполнения работы
- •Лабораторная работа №2 Химическая кинетика .Химическое равновесие.
- •Лабораторная работа №3 Электролитическая диссоциация
- •Лабораторная работа №4 Способы выражения концентрации растворов
- •Формулы перехода от одних выражений концентраций растворов к другим
- •100 Г раствора - 1 г NaCl
- •201,315 Г раствора - х г NaCl
- •1. Что такое раствор? Какими способами можно выразить содержание растворенного вещества в растворе?
- •Лабораторная работа №5 Приготовление растворов заданной концентрации
- •Лабораторная работа №6 Окислительно-восстановительные реакции
- •Лабораторная работа №7
- •Пример 6.
- •Пример7.
- •Лакмус содержит так называемую азометиновую кислоту, недиссоциированные молекулы которой красного цвета, а анионы – синего цвета.
Лабораторная работа №7
Гидролиз
Содержание работы
Целью работы является исследование процесса гидролиза солей и установление факторов, влияющих на гидролиз.
При растворении некоторых солей в воде нарушается равновесие диссоциации воды. Это является результатом обменных реакций растворенного вещества с растворителем, приводящих к образованию труднорастворимых, газообразных и малодиссоциирующих соединений. Такое обменное взаимодействие растворенного вещества с водой называется гидролизом.
В зависимости от природы растворенного вещества, его гидролиз может происходить по-разному. Так если соль образована сильной кислотой и основанием равной силы, то она полностью распадается в воде на свои составные части, а ее катионы и анионы, сталкиваясь с ионами Н+ и ОН- , практически ими не связываются. Происходит это по тому, что получающиеся в результате такого столкновения сильные кислота и основание, вновь моментально распадаются на ионы. Поэтому равновесие электролитической диссоциации воды не смещается, концентрация ионов водорода и гидроксида остается постоянной, равной 10-7моль/литр.
Гидролизу подвергаются все остальные соли:
· образованные катионом сольного основания и анионом слабой кислоты – происходит гидролиз по аниону;
· образованные катионом слабого основания и анионом сильной кислоты – происходит гидролиз по катиону;
· образованные катионом слабого основания и анионом слабой кислоты – происходит гидролиз и по катиону и по аниону.
Процесс гидролиза количественно характеризуется степенью гидролиза (h) и константой гидролиза (Кг). Степенью гидролиза называется отношение числа молекул, подвергшихся гидролизу (Сгидр.), к общему числу растворенных молекул (Собщ.):
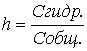
Степень гидролиза зависит от следующих факторов:
1. природы соли;
2. ее концентрации;
3. температуры раствора.
Разбавление раствора равноценно увеличению концентрации одного из реагирующих веществ (воды) и приводит к усилению гидролиза. Гидролиз концентрированных растворов происходит слабее. Процесс гидролиза эндотермичен, по этому с повышением температуры протекает полнее. Следовательно при гидролизе соблюдается принцип Ле-Шателье.
Константой гидролиза (Кг) называется - отношение произведения концентрации продуктов гидролиза к концентрации негидролизованной соли (определяется обычно по таблицам).
Величина Кг, в отличие от степени гидролиза, не зависит от концентрации раствора, поэтому является более удобной характеристикой процесса. Обе величины связаны между собой отношением аналогичным закону разбавления:
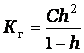
где С – исходная концентрация соли в растворе, (моль/литр).
Если степень гидролиза мала (h << 1), то Кг = h2*С,
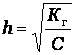
Пример 5.
Составьте молекулярное и ионно-молекулярное уравнение гидролиза солей: а) NaCN , б) К2СО3
Решение:
а) Цианид натрия NaСN – соль слабой одноосновной кислоты HCN и сильного основания NaOH. При растворении в воде молекулыNaCN полностью диссоциируют на катионы Na+ и анионы CN . Катионы Na+ не могут связывать ионы ОН- воды , так как NaOH – сильный электролит . Анионы же CN-связывают ионы Н+ воды , образуя молекулы слабого электролита HCN . Соль гидролизуется , как говорят , по аниону. Ионно-молекулярное уравнение гидролиза:
CN- + H2O ⇄ HCN + OH-
или в молекулярной форме:
NaCN + H2O ⇄ HCN + NaOH
В результате гидролиза в растворе появляется некоторый избыток ионов ОН-, поэтому раствор NaCN имеет щелочную реакцию (рН > 7).
б) Карбонат калия K2CO3 – соль слабой многоосновной кислоты и сильного основания. В этом случае анионы соли СО32-, связывая водородные ионы воды, образуют анионы кислой соли НСО3-, а не молекулы Н2СО3. В обычных условиях гидролиз идет по первой ступени, соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза:
СО32- + НОН ⇄НСО3- + ОН-
или в молекулярной форме:
К2СО3 + Н2О ⇄ НСО3 + КОН
В растворе появляется избыток ионов ОН- ,поэтому раствор К2СО3 имеет щелочную реакцию рН>7.
