
- •Правила техники безопасности. Знакомство с техникой выполнения лабораторных работ. Основные свойства важнейших классов неорганических веществ.
- •Лабораторная работа № 1 Основные классы неорганических соединений
- •Порядок выполнения работы
- •Лабораторная работа №2 Химическая кинетика .Химическое равновесие.
- •Лабораторная работа №3 Электролитическая диссоциация
- •Лабораторная работа №4 Способы выражения концентрации растворов
- •Формулы перехода от одних выражений концентраций растворов к другим
- •100 Г раствора - 1 г NaCl
- •201,315 Г раствора - х г NaCl
- •1. Что такое раствор? Какими способами можно выразить содержание растворенного вещества в растворе?
- •Лабораторная работа №5 Приготовление растворов заданной концентрации
- •Лабораторная работа №6 Окислительно-восстановительные реакции
- •Лабораторная работа №7
- •Пример 6.
- •Пример7.
- •Лакмус содержит так называемую азометиновую кислоту, недиссоциированные молекулы которой красного цвета, а анионы – синего цвета.
Лабораторная работа №3 Электролитическая диссоциация
Содержание работы
Целью работы является экспериментальное изучение процесса электролитической диссоциации, наблюдение электропроводности растворов некоторых электролитов и установление факторов,нарушающих равновесие в растворах электролитов.
Электролитическая диссоциация - процесс распада электролита на ионы - катионы и анионы - при растворении в воде или других растворителях.
Электролиты -_это вещества,растворы и расплавы которых проводят электрический ток.
Электролиты, диссоциирующие в растворах не полностью, называются слабыми электролитами. В их растворах устанавливается равновесие между недиссоциированными молекулами и продуктами их диссоциации - ионами.
N H4OH NH4++
OH-
H4OH NH4++
OH-
Константа равновесия связана с концентрациями соответствующих частиц соотношением :

Константа диссоциации не зависит от концентрации раствора.
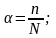
Степень диссоциации электролита - это доля его молекул, подвергнувшихся диссоциации, т.е. отношение числа молекул, распавшихся на ионы, к общему числу молекул электролита в растворе.
Понятие степени диссоциации неприменимо к сильным электролитам, т.к. они в водных растворах диссоциированы практически полностью. Закон разбавления Оствальда связывает константу и степень диссоциации в соотношение:
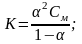
где См - молярная концентрация
Для растворов, в которых диссоциация электролита мала и величиной α. в знаменателе можно пренебречь, уравнение закона Оствальда упрощается:
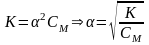 т.е.
при разбавлении раствора степень
диссоциации вырастает. Равновесие в
растворах электролитов является
динамическим и изменение условий влечет
за собой нарушение равновесия.
т.е.
при разбавлении раствора степень
диссоциации вырастает. Равновесие в
растворах электролитов является
динамическим и изменение условий влечет
за собой нарушение равновесия.
На сдвиг равновесия влияет изменение концентрации одного из ионов, находя- щихся в растворе. При увеличении концентрации этих ионов они могут связываться с ионами противоположного знака, и следовательно, приводить к уменьшению степени диссоциации этого электролита. Наоборот, уменьшение концентрации одного из ионов вызывает диссоциацию нового количества молекул. Другими словами, диссоциация электролита уменьшается от введения в раствор одноименных ионов.
Порядок выполнения работы
Об относительной силе электролита можно судить по электропроводности его раствора или по химической активности в реакциях.
Задание 1. Изучение влияния концентрации природы электролита, характера растворителя на степень диссоциации.
Опыт 1.Сравнение электропроводности растворов некоторых электролитов.
Угольные электроды, укрепленные на деревянной дощечке, опустить в стакан вместимостью 50 мл и включить их в цепь последовательно с электрической лампочкой. Вставить вилку в штепсель. В стакан с электродами налить 20-30 мл дистиллированной воды. Загорается ли лампочка? Проводит ли вода электрический ток?
1. Внести в стакан с водой 4-5 микрошпателей измельченного сахара. Является ли проводником раствор сахара? Перенести электроды в стакан с дистиллированной водой и промыть их.
В сухой стакан насыпать поваренную соль так, чтобы она покрыла дно стакана. Опустить в соль электроды. Проводит ли ток сухая соль? Прилить 20 мл дистиллированной воды. Что наблюдается? Промыть электроды дистиллированной водой. Объяснить, почему сухая соль и дистиллированная вода, взятые в отдельности, тока не проводят, а раствор соли является проводником тока.
В четыре стакана налить по 20 мл 0,1 н растворов последовательно: НСl, NаОН, СН3СООН и NH4OН. Испытать электропроводность этих растворов с помощью электродов и лампочки. По степени накала лампочки сделать вывод о силе этих растворов.
Слить вместе растворы СНзСООН и NH3 Испытать электропроводность полученного раствора. Объяснить разницу в степени накала лампочки в этом случае и при прохождении тока через растворы уксусной кислоты и аммиака, взятые отдельно.
Опыт 2. Характер диссоциации гидроксидов.
В 5 пробирок внести по 4-5 капель 0,5 н растворов:
в 1 – MgCl2
во 2 – АlCl3
в 3- Na2SiO3
в 4- NiSO4
в 5- ZnSO4
В 1, 2, 4, 5 пробирки прибавить по несколько капель (до начала образования осадков) 0.5 н раствора щелочи. В 3-ю пробирку внести 2н- раствора НС1. Разделить содержимое каждой пробирки на 2 части; к первой половине прилить 4-5 капель 0,5 н раствора НСl, ко второй - 6-8 капель 0,5 н раствора щелочи. Определить химический характер гидроксидов (в обеих ли пробирках сохранился осадок)? Кислотными, основными, или амфотерными свойствами они обладают? Каковы их химические свойства? Записать в виде таблицы данные, полученные в холе этого опыта.
Таблица
2.1 |
Химические свойства |
Формула гидроксида |
Схема диссоциации (без ступеней) |
|
|
|
|
Сколько электронов находится на внешнем энергетическом уровне ионов
Al+3 Si+4
В прямой или обратной зависимости находится усиление кислотных свойств гидроксидов от степени окисления?
Сделать общий вывод о влиянии радиуса, заряда и внешней электронной оболочки на характер диссоциации.
Задание 2. Сравнение химической активности кислот.
Опыт 3.Взаимодействие соляной и уксусной кислот с мрамором.
В одну пробирку внести 3-4 капли 2н раствора уксусной кислоты, в другую столько же 2н раствора соляной кислоты. Два одинаковых по величине кусочков мрамора бросить по одному в каждую пробирку. Какой газ выделяется? В какой пробирке газ идет более энергично? Написать молекулярные и ионные уравнения реакции. От концентрации каких ионов зависит скорость выделения газа? В растворе какой кислоты концентрация этих ионов больше? Сделать вывод об относительной силе исследованных кислот.
Опыт 4.Взаимодействие соляной и уксусной кислот с цинком .
В одну пробирку до 1/3 ее объема налить 2 н раствор соляной кислоты, в другую - столько же 2н раствора уксусной кислоты. В каждую пробирку бросить по одному кусочку цинка. В каком случае и какой газ выделяется более энергично? Написать ионные уравнения реакций. Объяснить различие в скоростях реакций.
Задание 3. Равновесие в растворах слабых электролитов.
Опыт 5.Влияние соли слабой кислоты на диссоциацию этой кислоты .
В 2 пробирки налить по 5-7 капель 0,1нраствора уксусной кислоты и I каплю раствора метилового оранжевого. В одну из пробирок внести 3-4 микрошпателя ацетата натрия и хорошо перемешать. Сравнить интенсивность окраски в обеих пробирках и объяснить ее изменение. Как изменяются степень диссоциации уксусной кислоты и концентрация ионов Н+? Объяснить, как смещается равновесие диссоциации кислоты при добавлении к ней ацетата натрия. Написать уравнение диссоциации уксусной кислоты и выражение концентрации диссоциации.
Опыт 6. Влияние соли слабого основания на диссоциацию этого основания.
В 2 пробирки налить 5-7 капель 0,1 н раствора аммиака и 1 каплю раствора фенолфталеина. В одну из пробирок внести 3-4 микрошпателя хлорида аммония и хорошо перемешать. Сравнить окраску полученного раствора с окраской контрольного раствора. Написать уравнение диссоциации и константы диссоциации раствора аммиака. Объяснить изменение окраски раствора при введении хлорида аммония. Дать общий вывод о смещении равновесия в растворах слабых электролитов.
Контрольные вопросы и задачи:
1. Электролиты. Сильные и слабые электролиты.
2. Электролитическая диссоциация. Основные положения теории Аррениуса.
3. Степень и константа диссоциации.
4. Факторы, влияющие на степень диссоциации.
5. Равновесие в растворах электролитов.
6. Влияние одноименных ионов на диссоциацию слабых электролитов.
7. Степень диссоциации СНзСООН в 0,1 М растворе равна 1,32 • 1СН. Найти константу диссоциации кислоты и значение рК (показатель константы диссоциации).
8. Константа диссоциации HCN равна 7.9 • 10-10 Найти степень диссоциации HCN в 0,001 М растворе.
10. Вычислить концентрацию ионов водорода в 0,1 М растворе НСlO
( К=5·10-8).
11. Во сколько раз уменьшится концентрация ионов водорода в 0,2 М растворе НСООН (К=0,8·10-4), если к одному л этого раствора добавить 0,1 моль соли НСО- ОNа? Считать, что соль диссоциирована полностью.
Написать ионное уравнение реакции. Мg(ОН)2 + 2НС1 = МgС12 + Н2О
Написать уравнения ступенчатой диссоциации фосфорной кислоты в водном растворе. Вычислите константу диссоциации Н3РО4 (первая ступень), если степень диссоциации ее в 0,1 н растворе равна 36 %.
