
- •Правила техники безопасности. Знакомство с техникой выполнения лабораторных работ. Основные свойства важнейших классов неорганических веществ.
- •Лабораторная работа № 1 Основные классы неорганических соединений
- •Порядок выполнения работы
- •Лабораторная работа №2 Химическая кинетика .Химическое равновесие.
- •Лабораторная работа №3 Электролитическая диссоциация
- •Лабораторная работа №4 Способы выражения концентрации растворов
- •Формулы перехода от одних выражений концентраций растворов к другим
- •100 Г раствора - 1 г NaCl
- •201,315 Г раствора - х г NaCl
- •1. Что такое раствор? Какими способами можно выразить содержание растворенного вещества в растворе?
- •Лабораторная работа №5 Приготовление растворов заданной концентрации
- •Лабораторная работа №6 Окислительно-восстановительные реакции
- •Лабораторная работа №7
- •Пример 6.
- •Пример7.
- •Лакмус содержит так называемую азометиновую кислоту, недиссоциированные молекулы которой красного цвета, а анионы – синего цвета.
Лабораторная работа №6 Окислительно-восстановительные реакции
Целью работы является приобретение практических навыков :1) в написании окислительно - восстановительных реакций в различных средах электронно - ионным методом, 2) в определении эквивалента окислителя и восстановителя; 3) в определении направления окислительно - восстановительных реакций; 4) экспериментальное исследование ОВ свойств простых и сложных веществ в различных средах.
Согласно
электронной теории, окисление – потеря
электронов
 -2е
-2е
 восстановление – присоединение
электронов 2
восстановление – присоединение
электронов 2 +4e
4Cl
атомом, ионом или молекулой. Окислением
является атомно-молекулярные частицы,
принимающие электроны, восстановителем
– атомно-молекулярные частицы, отдающие
электроны. Окисление и восстановление
– взаимосвязанные процессы: если одна
частица окисляется, то другая
восстанавливается. ОВР подразделяется
на 3 типа:
+4e
4Cl
атомом, ионом или молекулой. Окислением
является атомно-молекулярные частицы,
принимающие электроны, восстановителем
– атомно-молекулярные частицы, отдающие
электроны. Окисление и восстановление
– взаимосвязанные процессы: если одна
частица окисляется, то другая
восстанавливается. ОВР подразделяется
на 3 типа:
межмолекулярные, в которых изменяются окислительные числа атомов и разных частиц:
2
2
2HCl+ +
+
внутримолекулярные, в которых происходят изменение окислительных чисел разных атомов, входящих в состав одной и той же частицы:

диспропорционирования (самоокисление – самовосстановление), которые протекают с одновременным повышением и понижением окислительного числа атомов одного и того же элемента
4 l
l
Для составления уравнений ОВР необходимо провести подбор коэффициентов. Для этого используются 2 метода: метод электронного баланса или электронно-ионный метод. Эти методы основаны на правилах сохранения числа атомов каждого элемента в реакции и сохранения заряда. Из правила сохранения заряда следует, что число электронов отданных восстановителем, равно числу электронов, принятых окислителем. При составлении уравнений ОВР, протекающих в водных растворах, целесообразнее использовать электронно-ионный метод. При этом следует соблюдать определенную последовательность рассуждений.
Записывают схему реакции и определяют функцию каждого реагента:
 O
O
Здесь
 -окислитель,
-окислитель,
 -восстановитель,
-восстановитель,
 -среда реакции.
-среда реакции.
Записывают левую часть уравнения в ионном виде, т.е. указывают только те ионы сильных электронов и молекулы слабых электролитов, которые принимают участие в данной ОВР.
 =
=
Составляют электронно-ионные уравнения полуреакций восстановления и окисления и подбирают коэффициенты:
 5
5
 1
1
Записывают полное ионное уравнение с учетом правила сохранения заряда
5 +4
+4
Затем записывают молекулярное уравнение это реакции
10
(в данном случае коэффициенты пришлось удвоить, т.к.в формульной единице продукта сульфата железа (ΙΙΙ) содержится 2 атома железа).
В
зависимости от среды характер протекания
реакции между одними и теми же реагентами
будут меняться.
Например,
 в разных средах будет восстанавливаться
по разному: в кислой среде-до
в разных средах будет восстанавливаться
по разному: в кислой среде-до
 -до
-до
 -до (
-до ( .
Это объясняется тем, что в кислой среде
.
Это объясняется тем, что в кислой среде
 - ионы проникают в анионы
- ионы проникают в анионы
 ,
вызывая ослабления связи между
,
вызывая ослабления связи между
Марганцем
и кислородом и облегчают действие
восстановления. В нейтральной среде
деформация аниона
 меньше,
т.к. поляризующее действие молекул воды
меньше, чем ионов
меньше,
т.к. поляризующее действие молекул воды
меньше, чем ионов
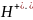 Гидроксид – ионы наоборот, упрочняют
связь Mn-O. Поэтому в кислой среде
связываются ионом
все атомы кислорода аниона
,
в нейтральной – только половина этих
атомов, в сильнощелочной - эти ионы не
могут связать ни одного атома кислорода.
Гидроксид – ионы наоборот, упрочняют
связь Mn-O. Поэтому в кислой среде
связываются ионом
все атомы кислорода аниона
,
в нейтральной – только половина этих
атомов, в сильнощелочной - эти ионы не
могут связать ни одного атома кислорода.
В окислительно - восстановительных реакциях электроны непосредственно переходят от восстановителя к окислителю. Если же процессы окисления и восстановления пространственно разделить, а электроны направить по металлическому проводнику, то такая система будет представлять собой гальванический элемент – такое устройство, в котором химическая энергия реакции превращается в энергию электрического тока в гальваническом элементе является разность электродных потенциалов. Электродный потенциал- величина постоянная при дано температуре. Потенциал отдельного электрода нельзя определить, его измеряют относительно другого электрода, чаще всего стандартного водородного электрода, величину которого принимают за нуль (при всех значениях температуры).
Располагая
металлы в порядке возрастания их
стандартных электродных потенциалов ,
получают электрохимический ряд напряжения
металлов. Ряд напряжений применим только
к водным растворам.
,
получают электрохимический ряд напряжения
металлов. Ряд напряжений применим только
к водным растворам.
Ряд напряжений характеризует химическую активность металлов:
Чем левее в ряду напряжений стоит металл, тем он химически активе, обладает большей восстановительной способностью, легче окисляется и труднее восстанавливается из своих ионов.
Каждый металл ряда напряжения вытесняет (восстанавливает) все следующие за ним металлы из растворов их солей.
Все металлы, стоящие в ряду напряжений до водорода (имеющие более отрицательный стандартный потенциал) вытесняет газообразный водород из растворов, содержащих ионы водорода. Чем дальше расположены друг от друга в ряду напряжений металлы, тем большую э.д.с. будут давать построенные их них гальванические элементы. Э.Д.С. любого гальванического элемента можно вычислить по разности стандартных электронных потенциалов.
Характерным свойством металлов является то, что они подвергаются коррозии – разрушению металла в результате химического и электрохимического взаимодействия с окружающей средой.
При электрохимической коррозии поток электронов направлен от более активному к менее активному металлу и более активный металл корродирует. Скорость коррозии тем больше, чем дальше отстоят друг от друга в ряду напряжений металлы, из которых образовалась гальваническая пара. На скорость коррозии влияет и электролит.
Порядок выполнения работы.
Задание 1. Окислительные и восстановительные свойства атомов р-элементов в промежуточных степенях окисления
Опыт 1. Соединения серы (IV) в ОВР.
В
первую пробирку раствора дихромата
калия
 и во вторую с сульфидом калия
и во вторую с сульфидом калия
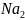 S
внести по несколько капель 2 н раствора
серной кислоты и по 2-3 капли микрошпателя
сульфита натрия
S
внести по несколько капель 2 н раствора
серной кислоты и по 2-3 капли микрошпателя
сульфита натрия
 .
Отметить наблюдаемые явления. Определить
окислитель и восстановитель в каждой
реакций. Составить уравнения проведенных
реакций.
.
Отметить наблюдаемые явления. Определить
окислитель и восстановитель в каждой
реакций. Составить уравнения проведенных
реакций.
Опыт 2. Реакция диспропорционирования сульфита натрия.
В две пробирки поместить по 2-3 кристаллика сульфита натрия. Одну оставить в качестве контрольной. Вторую закрепить в штативе и нагревать в течении 5-6 минут. Дать остыть. В обе пробирки внести по 5-6 капель дистиллированной воды, размешать стеклянной палочкой до растворения солей, находящихся в пробирках. Добавить в каждую пробирку по 2-3 капли раствора сульфата меди (ΙΙ). Отметить наблюдаемые явления. Написать уравнения реакции разложения сульфита натрия, учитывая, что вторым продуктом прокаливания является сульфат натрия. Как изменялась степень окисления серы в данной реакции? Для каких степеней окисления серы возможны реакции диспропорционирования?
Задание 2. Изучение окислительно-восстановительных свойств в различных средах
Опыт
3. В
три пробирки внести по 3-4 капли раствора
перманганата калия
 .
В одну пробирку добавить 2-3 капли 2 н
раствора серной кислоты, во вторую –
столько же воды, в третью – такое же
количество раствора щелочи. Во все три
пробирки внести по 2 микрошпателя
кристаллов нитрита калия и перемешать
растворы до полного растворения
кристаллов. Через 3-4 минуты отметить
изменение окраски растворов во всех
трех случаях.
.
В одну пробирку добавить 2-3 капли 2 н
раствора серной кислоты, во вторую –
столько же воды, в третью – такое же
количество раствора щелочи. Во все три
пробирки внести по 2 микрошпателя
кристаллов нитрита калия и перемешать
растворы до полного растворения
кристаллов. Через 3-4 минуты отметить
изменение окраски растворов во всех
трех случаях.
Написать уравнение реакции восстановления нитритом калия в кислой, нейтральной и щелочной средах. Сколько окислительных эквивалентов содержится в 1 моль в каждом из этих случаев?
Задание 3. Определение направления протекание ОВР
Опыт 4. Внести в пробирку по 2-3 капли сульфата хрома (ΙΙΙ) и сульфата калия и добавить к ним 1-2 капли иодной воды. Происходит ли окисление хрома (ΙΙΙ) иодом, которое должно сопровождаться обесцвечиванием иода?
В другую пробирку внести по несколько капель раствора бихромата калия и серной кислоты, затем добавить 3-4 капли иодида калия. Почему раствор окрасился в коричневый цвет? Составить уравнение полуреакций окисления и восстановления для протекающей ОВР. Рассмотреть данную реакцию как процесс, протекающей при работе гальванического элемента. Выписать значения соответствующих электродных потенциалов и вычислить э.д.с. Отметить значение э.д.с. для данного процесса, определить окислитель и восстановитель. Пользуясь электродными потенциалами, решить вопрос, возможна ли при стандартных условиях реакция
+
Задание 4. Образование гальванических пар при химических процессах.
Опыт 5. Внести в пробирку 5-6 капель 2 н серной кислоты и кусочек чистого цинка (без примесей). Наблюдается ли вытеснение водорода из серной кислоты? Коснуться медной проволокой кусочка цинка в пробирке. Какова интенсивность выделения водорода и на каком из металлов он выделяется? Отнять медную проволоку от цинка и убедиться, что интенсивность выделения водорода снова изменяется. Указать направление перехода электронов в паре цинк-медь. Какой металл будет иметь отрицательный заряд и являться катодом для ионов водорода, имеющихся в растворе?
Опыт 6. В две пробирки внести по 5-6 капель 2 н раствора серной кислоты. В одну из пробирок прибавить каплю раствора сульфата меди и в обе пробирки опустить по кусочку чистого цинка. Наблюдать различную интенсивность выделения водорода в пробирках. Что появилось на поверхности цинка в присутствии сульфата меди? Какова роль соли меди, в присутствии которой водород выделяется интенсивнее?
Опыт 7. Коррозия оцинкованного и луженого железа
В
две пробирки налить ½ их объема
дистиллированной воды и добавить по
2-3 капли раствора 2 н серной кислоты
гексацианоферрата (ΙΙΙ) калия
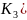 ]
(Последний является чувствительным
реактивом на ионы
]
(Последний является чувствительным
реактивом на ионы
 ,
с которыми дает синее окрашивание).
Растворы перемешать стеклянной палочкой.
Две железные проволочки очистить
наждачной бумагой. Одной проволокой
прочно обмотать кусочек цинка, другой
– кусочек олова и опустить их оба
приготовленные растворы. Наблюдать
синее окрашивание в одной из пробирок.
(в какой?) Объяснить появление ионов
,
с которыми дает синее окрашивание).
Растворы перемешать стеклянной палочкой.
Две железные проволочки очистить
наждачной бумагой. Одной проволокой
прочно обмотать кусочек цинка, другой
– кусочек олова и опустить их оба
приготовленные растворы. Наблюдать
синее окрашивание в одной из пробирок.
(в какой?) Объяснить появление ионов
 в растворе. Дать схему перехода электронов
при коррозии оцинкованного и луженого
железа и указать, в каком случае при
местном разрушении защитного покрытия
будет происходить ржавление железа под
остающимся неизменным защитным слоем.
в растворе. Дать схему перехода электронов
при коррозии оцинкованного и луженого
железа и указать, в каком случае при
местном разрушении защитного покрытия
будет происходить ржавление железа под
остающимся неизменным защитным слоем.
Контрольные вопросы и задачи:
Сущность ОВР
Виды ОВР
Основные окислители и восстановители
Методы нахождения коэффициентов для ОВР: а) метод электронного баланса; б) метод полуреакций (ионно-электронный метод).
Найти окислитель и восстановитель и составить ОВР для процессов используя метод полуреакции:
 …
…
 +
+ …
…
S+ …
…
NaI+Na

На основе стандартных электродных потенциалов определить, можно ли действием галогена на Fe (ΙΙ) перевести его в Fe (
