
- •Правила техники безопасности. Знакомство с техникой выполнения лабораторных работ. Основные свойства важнейших классов неорганических веществ.
- •Лабораторная работа № 1 Основные классы неорганических соединений
- •Порядок выполнения работы
- •Лабораторная работа №2 Химическая кинетика .Химическое равновесие.
- •Лабораторная работа №3 Электролитическая диссоциация
- •Лабораторная работа №4 Способы выражения концентрации растворов
- •Формулы перехода от одних выражений концентраций растворов к другим
- •100 Г раствора - 1 г NaCl
- •201,315 Г раствора - х г NaCl
- •1. Что такое раствор? Какими способами можно выразить содержание растворенного вещества в растворе?
- •Лабораторная работа №5 Приготовление растворов заданной концентрации
- •Лабораторная работа №6 Окислительно-восстановительные реакции
- •Лабораторная работа №7
- •Пример 6.
- •Пример7.
- •Лакмус содержит так называемую азометиновую кислоту, недиссоциированные молекулы которой красного цвета, а анионы – синего цвета.
100 Г раствора - 1 г NaCl
201,315 Г раствора - х г NaCl
х =![]() г NaCl
г NaCl
Таким образом, была взята навеска NaCl массой 2,0131 г
Рассчитывают, сколько миллилитров исходного раствора и воды следует взять для приготовления 250 мл 5% раствора. Воду отмерить цилиндром и вылить в мерную колбу объемом 250мл. Исходный раствор поваренной соли отмеряют цилиндром на 100 мл и вливают в колбу с водой. Раствор в колбе перемешивают. Цилиндр ополаскивают небольшим объемом раствора из колбы, который затем присоединяют к общей массе раствора в колбе. Проверить плотность и концентрацию полученного раствора. Рассчитать
относительную ошибку δотн (%):
![]()
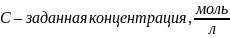
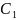 – полученная
концентрация,
– полученная
концентрация,
Сделайте расчет молярной концентрации молярной концентрации эквивалентов и титра, приготовленного раствора. Результаты запишите в таблицу 2
Таблица 2.
Опытные данные
Заданная массовая доля, (%) |
Плотность,ρ, кг/м3 |
Рассчитанные массы компонентов, г |
Плотность экспериментальная, ρ, кг/м3
|
Экспериментальные концентрации |
δотн |
|
||||||
NaCl
|
H2O
|
|
||||||||||
с, % |
с, М |
сэк, н |
T, г/мл |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
||
Контрольные вопросы и задачи:
1. Что такое раствор? Какими способами можно выразить содержание растворенного вещества в растворе?
2. Дайте определение величин, характеризующих состав раствора, которые имеют наибольшее применение.
3. В 300 г воды растворили 30 г хлорида натрия. Определите массовую долю соли в полученном растворе.
4. Определите молярную концентрацию ра с твора хлорида аммония, содержащего 40 г соли в 500 мл раствора.
5. Какая масса фосфорной кислоты содержится в ра с творе объемом, равным 0,3 л, если его молярная концентрация эквивалента равна 0,5 моль/л?
6. После упаривания раствора гидроксида натрия с массовой долей 10 % (р = 1,115 г/мл) и объемом, равным 6 л, масса раствора стала равной 1420 г. Вычислите массовую долю щелочи в полученном растворе.
7. В 250 мл раствора содержится 7,5 г сульфата алюминия. Чему равна молярная концентрация и молярная концентрация эквивалента данного раствора?
Лабораторная работа №5 Приготовление растворов заданной концентрации
Содержание работы
Целью работы является совершенствование навыков приготовления растворов заданной концентрации различными методами.
Растворы можно приготовить, используя различные методы: непосредственно вводя рассчитанное количество вещества в растворитель, или путем разбавления более концентрированных растворов до требуемого значения концентрации.
Приблизительные растворы. При приготовлении приблизительных растворов количества веществ, которые должны быть взяты для этого, вычисляют с небольшой точностью. Атомные веса элементов для упрощения расчетов допускается брать округленными иногда до целых единиц. Так, для грубого подсчета атомный вес железа можно принять равным 56 , вместо точного —55,847; для серы — 32 вместо точного 32,064 и т. д. Вещества для приготовления приблизительных растворов взвешивают на технохимических или технических весах. Принципиально расчеты при приготовлении растворов совершенно одинаковы для всех веществ. Количество приготовляемого раствора выражают или в единицах массы (г, кг), или в единицах объема (мл, л), причем для каждого из этих случаев вычисление количества растворяемого вещества проводят по-разному.
Пример2. Пусть нужно приготовить 2 кг 10%-ного раствора Na2SO4, исходя из Na2SO4 *10H2O.
Молекулярный вес Na2SO4 равен 142,041, a Na2SO4*10H2O 322,195, или округленно 322,20.
Расчет ведут вначале па безводную соль:
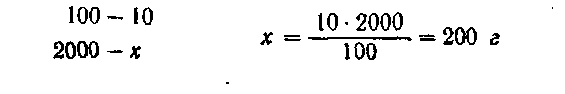
Следовательно, нужно взять 200 г безводной соли. Количество десятиводной соли находят из расчета:
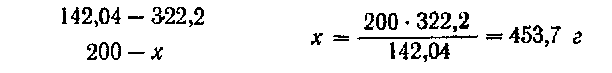
Воды в этом, случае нужно взять: 2000 — 453,7 =1546,3 г.
Так как раствор не всегда готовят с пересчетом на безводную соль, то на этикетке, которую обязательно следует наклеивать на сосуд с раствором, нужно указать, из какой соли приготовлен раствор, например 10%-ный раствор Na2SO4 или 25%-ный Na2SO4*10H2O.
Часто случается, что приготовленный ранее раствор нужно разбавить, т. е. уменьшить его концентрацию; растворы разбавляют или по объему, или по массе.
Пример3. Нужно разбавить 20%-ный раствор сернокислого аммония так, чтобы получить 2 л 5%-иого раствора. Расчет ведем следующим путем. По справочнику узнаем, что плотность 5%-ного раствора (NH4)2SO4 равна 1,0287 г/см3. Следовательно, 2 л его должны весить 1,0287*2000 = 2057,4 г. В этом количестве количестве должно находиться сернокислого аммония:
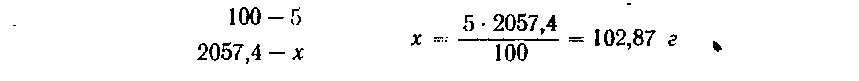
Теперь можно подсчитать, сколько нужно взять 20%-ного рас* твора, чтобы получить 2 л 5%-ного раствора.
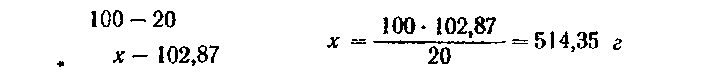
Полученную массу раствора можно пересчитать на объем его. Для этого массу раствора делят на его плотность (плотность 20%-ного раствора равна 1.1149 г/см3), т. е.
![]()
Учитывая, что при отмеривании могут произойти потери, нужно взять 462 мл и довести их до 2 л, т. е. добавить к ним 2000—462 = = 1538 мл воды.
Если же разбавление проводить по массе, расчет упрощается. Но вообще разбавление проводят из расчета на объем, так как жидкости, особенно в больших количествах, легче отмерить по объему, чем взвесить.
Нужно помнить, что при всякой работе как с растворением, так и с разбавлением никогда не следует выливать сразу всю воду в сосуд. Водой ополаскивают несколько раз ту посуду, в которой проводилось взвешивание или отмеривание нужного вещества, и каждый раз добавляют эту воду в сосуд для раствора.
Когда не требуется особенной точности, при разбавлении растворов или смешивании их для получения растворов другой концентрации можно пользоваться следующим простым и быстрым способом.
Возьмем разобранный уже случай разбавления 20%-ного раствора сернокислого аммония до 5%-ного. Пишем вначале так:

где 20 — концентрация взятого раствора, 0 — вода и 5'—-требуемая концентрация. Теперь из 20 вычитаем 5 и полученное значение пишем в правом нижнем углу, вычитая же нуль из 5, пишем цифру в правом верхнем углу. Тогда схема примет такой вид:
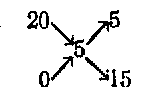
Это значит, что нужно взять 5 объемов 20%-ного раствора и 15 объемов воды. Конечно, такой расчет не отличается точностью.
Если смешивать два раствора одного и того же вещества, то схема сохраняется та же, изменяются только числовые значения. Пусть смешением 35%-ного раствора и 15%-ного нужно приготовить 25%-ный раствор. Тогда схема примет такой вид:
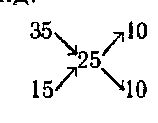
т. е. нужно взять по 10 объемов обоих растворов.
Пример43. Приготовить 0,5 л 20% раствора H2SO4, исходя из концентрированного раствора, плотность которого 1,84 г/см3.
По таблице находим, что плотности 1,84 г/см3 соответствует кислота с содержанием 96% H2SO4, а 20% раствору соответствует кислота с плотностью 1,14 г/см3.
Вычислим количества исходной кислоты и воды, требующиеся для получения заданного объема раствора.
Масса
его составляет 500![]() 1,14
= 570 г, а содержание в нем H2SO4 равно
1,14
= 570 г, а содержание в нем H2SO4 равно
![]() г.
г.
Вычислим, в каком объеме исходной 96% кислоты содержится 114 г H2SO4:
1
мл исходной кислоты содержит ![]() г H2SO4
г H2SO4
![]() х мл
исходной кислоты содержит 114
г H2SO4
х мл
исходной кислоты содержит 114
г H2SO4
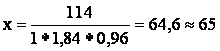 мл
мл
Таким образом, для приготовления 500мл 20% раствора H2SO4 необходимо взять 64,6 мл 96% раствора.
Количество воды определяется как разность весов полученного исходного раствора, а именно
Порядок выполнения работы
Задание 1 .Приготовление раствора кислоты с заданной молярной
концентрацией или молярной концентрацией эквивалента.
Получите у преподавателя задание. По плотности исходного раствора (p1) из таблицы 1 в лабораторной работе №4 определите массовую долю кислоты (ω) в исходном более концентрированном растворе кислоты.
Рассчитайте объем исходного раствора который нужно взять
С ( Х) [или молярной концентрацией эквивалента - C ( l / z * X )] объе
мом, равным V2. Вычислите молярную концентрацию эквивалента
(или молярную концентрацию), моляльность, титр раствора кисло
ты, который вам необходимо приготовить. Все данные внесите в
таблицу 1. Правильность расчета проверьте у преподавателя.
Таблица 1.
Вещест-во |
Исходный раствор |
Заданный |
раствор |
|
|
||
|
Плот-ность |
Массовая доля раствора |
Обьем раствора |
Обьем раствора |
Моляр-ная концентрация |
Молярная концентра-ция эквивалента |
Титр |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Отмерьте мерным цилиндром или мерной пробиркой вычисленный объем Vi, исходного, более концентрированного раствора. Перелейте его в мерную колбу вместимостью 50 мл или 100 мл, соответствующую объему V2. Ополосните мерный цилиндр 1-2 раза дистиллированной водой, каждый раз, сливая воду в мерную колбу. Затем долейте в колбу дистиллированной воды до метки (последние 0,5 - 1 мл воды прибавляйте по каплям из пипетки или промывал ки). Колбу плотно закройте пробкой и перемешайте полученный раствор, переворачивая колбу несколько раз.
Опыт 2. Приготовление раствора заданной концентрации смешиванием растворов более высокой и более низкой концентрации.
Раствор можно готовить, непосредственно вводя рассчитанное количество вещества в растворитель, или путем разбавления более концентрированных растворов до требуемого значения концентрации.
Приготовить 250 мл 10 % раствора хлорида натрия, имея в своем распоряжении 15 % и 5 % раствор NaCl.
Учитывая плотности приготовляемого и исходных растворов рассчитать объемы 15 % и 5 % раствора (см. пример 2). Отмерить вычисленные объемы исходных растворов, слить в колбу на 250 мл, закрыть колбу пробкой и тщательно перемешать раствор, перевернув колбу несколько раз вверх дном. Отлить часть раствора в цилиндр, измерить ареометром плотность приготовленного раствора и по табл.1 найти его концентрацию (в %). Установить расхождение практически полученной концентрации с заданной. Рассчитать относительную ошибку δотн.
Опыт 3. Приготовление водного раствора хлорида натрия .Определение массовой доли и расчет навески.
Получить навеску соли хлорида натрия у преподавателя. При помощи воронки перенести данную навеску в мерную колбу емкостью 250 мл. Промывалкой обмыть внутреннюю часть воронки небольшим количеством воды. Растворить соль в воде. Затем, добавляя воду небольшими порциями, довести уровень воды в колбе до метки, закрыть колбу пробкой и тщательно перемешать, переворачивая вверх дном. Замерить плотность полученного раствора ареометром. Для этого раствор перелить в мерный цилиндр. Уровень жидкости должен быть ниже края цилиндра на 3-4 см. Осторожно опустите ареометр в раствор. Ареометр не должен касаться стенок цилиндра. Отсчет плотности по уровню жидкости производите сверху вниз. По таблице 1 найдите и запишите массовую долю (в %) раствора, отвечающую этой плотности. Рассчитать количество хлорида натрия взятого для приготовления 250 мл раствора.
Контрольные вопросы и задачи:
1. Чему равна моляльность раствора, приготовленного из глюкозы (С6 Н12 O6 ) массой 9 г и воды объемом, равным 500 мл?
2. Рассчитайте титр раствора соляной кислоты: а) с молярной концентрацией, равной 0,05 моль/л; б) с массовой долей 2 % и плотностью, равной 1,008 г/мл.
3. Сколько мл раствора серной кислоты с массовой долей, равной 94 % (р = 1,84 г/мл), потребуется для приготовления 3 л раствора этой же кислоты с массовой долей, равной 40 %, и плотностью 1,31 г/мл?
4. Какой объем раствора соляной кислоты с массовой долей, равной 20 % (р = 1,10 г/мл), потребуется для приготовления 800 мл раствора этой кислоты с молярной концентрацией 0,5 моль/л?
5. Дан раствор фосфорной кислоты с массовой долей 40 % (р = 1,25 г/мл). Определите молярную концентрацию, молярную концентрацию эквивалента, моляльность и титр данного раствора кислоты.
6. Смешали 300 г раствора серной кислоты с массовой долей, равной 40 %, и 250 мл 10 % раствора этой же кислоты (р = 1,07 г/мл). Определите массовую долю кислоты в полученном ра с творе.
7. Вычислите, какая масса гидроксида калия потребуется для нейтрализации 0,5 л раствора азотной кислоты с массовой долей 40 % ( р = 1,25 г/мл)?
8. На нейтрализацию раствора щелочи объемом, равным 60 мл израсходовано 35 мл раствора серной кислоты с молярной концентрацией эквивалента 0,5 моль/л. Вычислите молярную концентрацию эквивалента щелочи.
