
- •Введение
- •4.3. Титриметрический метод анализа
- •4.3.1. Классификация методов титриметрического анализа
- •4.3.2. Стандартизация раствора титранта
- •4.3.3. Кривые титрования
- •4.3.3. Индикаторы титриметриметрических методов анализа
- •4.3.4. Принцип эквивалентности
- •4.3.5. Расчет результата прямого титрования при разных способах выражения концентрации раствора
- •4.3.6. Расчет результата в методе обратного титрования
- •4.4 Кислотно-основное титрование.
- •4.4.1.Общая характеристика метода
- •4.4.2 Индикаторы в методе кислотно-основного титрования
- •4.4.3. Кривые титрования
- •4.4.4 Кривая титрования сильной кислоты сильным основанием ( и наоборот)
- •Расчет кривой титрования 10,0 мл 0,1 м hCl раствором 0,1 м NaOh
- •Титрование сильного основания сильной кислотой
- •Расчет кривой титрования 10,0 мл 0,1 м сh3cooh раствором 0,1 м NaOh
- •4.4.5. Техника выполнения работ в титриметрических методах анализа
- •3. Стандартизация раствора хлороводородной кислоты по тетраборату натрия.
- •4. Определение содержания щёлочи в растворе
- •Контрольные вопросы :
- •Задачи для самостоятельного решения
- •5. Окислительно-восстановительное титрование .
- •5.1.Классификация методов окислительно-восстановительного титрования
- •5.2. Индикаторы окислительно-восстановительного титрования
- •5.3.Перманганатометрия
- •1. Приготовление раствора титранта кМnO4
- •2. Приготовление раствора первичного стандарта
- •3. Стандартизация раствора титранта кМnO4
- •4. Вычисления
- •5) Определение железа (II)
- •6. Физико - химические методы анализа.
- •Определение концентрации ионов меди в растворе
- •4. Определение меди в исследуемом растворе
- •1. Основные понятия аналитической химии
- •2. Методы качественного анализа
- •3. Классификация катионов в качественном кислотно-основном
- •4. Методы количественного анализа
- •4.3. Титриметрический метод анализа
- •4.4 Кислотно-основное титрование.
- •5. Окислительно-восстановительное титрование .
- •6. Физико - химические методы анализа.
- •4.3. Титриметрический метод анализа
- •4.3.1. Классификация методов титриметрического анализа
- •4.3.2. Стандартизация раствора титранта
- •4.3.3. Кривые титрования
- •4.3.3. Индикаторы титриметриметрических методов анализа
- •4.3.4. Принцип эквивалентности
- •4.3.5. Расчет результата прямого титрования при разных способах выражения концентрации раствора
- •4.3.6. Расчет результата в методе обратного титрования
- •4.4 Кислотно-основное титрование.
- •4.4.1.Общая характеристика метода
- •4.4.2 Индикаторы в методе кислотно-основного титрования
- •4.4.3. Кривые титрования
- •4.4.4 Кривая титрования сильной кислоты сильным основанием ( и наоборот)
- •Расчет кривой титрования 10,0 мл 0,1 м hCl раствором 0,1 м NaOh
- •Титрование сильного основания сильной кислотой
- •Расчет кривой титрования 10,0 мл 0,1 м сh3cooh раствором 0,1 м NaOh
- •4.4.5. Техника выполнения работ в титриметрических методах анализа
- •3. Стандартизация раствора хлороводородной кислоты по тетраборату натрия.
- •4. Определение содержания щёлочи в растворе
- •Контрольные вопросы :
- •Задачи для самостоятельного решения
- •5. Окислительно-восстановительное титрование .
- •5.1.Классификация методов окислительно-восстановительного титрования
- •5.2. Индикаторы окислительно-восстановительного титрования
- •5.3.Перманганатометрия
- •1. Приготовление раствора титранта кМnO4
- •2. Приготовление раствора первичного стандарта
- •3. Стандартизация раствора титранта кМnO4
- •4. Вычисления
- •5) Определение железа (II)
- •6. Физико - химические методы анализа.
- •Определение концентрации ионов меди в растворе
- •4. Определение меди в исследуемом растворе
- •1. Основные понятия аналитической химии
- •2. Методы качественного анализа
- •3. Классификация катионов в качественном кислотно-основном
- •4. Методы количественного анализа
- •4.3. Титриметрический метод анализа
- •4.4 Кислотно-основное титрование.
- •5. Окислительно-восстановительное титрование .
- •6. Физико - химические методы анализа.
5. Окислительно-восстановительное титрование .
Методы редоксометрии основаны на реакциях окисления-восстановления. Разработано очень много методов. Их классифицируют в соответствии с применяемым стандартным (рабочим, титрантом) раствором.
5.1.Классификация методов окислительно-восстановительного титрования
Наиболее часто применяются следующие методы:
Перманганатометрия
- метод, который основан на окислительной
способности рабочего раствора перманганата
калия KМn .
Титрование ведется без индикатора.
Применяется для определения только
восстановителей при прямом титровании.
.
Титрование ведется без индикатора.
Применяется для определения только
восстановителей при прямом титровании.
Иодометрия – метод, в котором рабочим титрованным раствором служит раствор свободного иода в КI. Метод позволяет определять как окислители, так и восстановители. Индикатором служит крахмал.
Дихроматометрия основана на использовании в качестве рабочего раствора дихромата калия K2Cr2O7. Метод может применяться как для прямых так и косвенных определений восстановителей.
Броматометрия основана на использовании в качестве титранта бромата калия KBrO3 при определении восстановителей.
Иодатометрия применяет в качестве рабочего раствора раствор иодата калия KIO3 при определении восстановителей.
Ванадатометрия дает возможность использовать окислительную способность ванадата аммоноя NH4VO3. Кроме перечисленных методов в лабораторной практике используются и такие методы как цериметрия (Ce4+), титанометрия и другие.
5.2. Индикаторы окислительно-восстановительного титрования
При анализе методами окислительно-восстановительного титрования используется прямое, обратное и заместительное титрование. Точка эквивалентности окислительно-восстановительного титрования фиксируется как с помощью индикаторов, так и безиндикаторным способом. Безиндикаторный способ применяется в тех случаях, когда окисленная и восстановленная формы титранта отличаются.
В точке эквивалентности, при введении 1 капли избытка раствора титранта изменит окраску раствора.
Безиндикаторным способом можно проводить определения перманганатометрическим методом, т.к. в точке эквивалентности от одной капли раствора перманганата калия титруемый раствор окращивается в бледнорозовый цвет.
При индикаторном способе фиксирования точки эквивалентности применяют специфические и редоксиндикаторы. К специфическим индикаторам относится крахмал в иодометрии, который в присутствии свободного иода окрашивается в интенсивно-синий цвет вследствие образования адсорбционного соединения синего цвета.
Редокс-индикаторы – это вещества, у которых окраска меняется при достижении определенного значения окислительно-восстановительного (редокспотенциала).
К редокс-индикаторам относится, например, дифениламин NH(C6H5)2. При действии на бесцветные растворы его окислителями он окрашивается в сине-фиолетовый цвет.
5.3.Перманганатометрия
Метод перманганатометрии основан на реакциях окисления восстановителей ионом перманганата. Окисление может проводиться как в кислой, так и в щелочной или нейтральной средах.
При окислении в кислой среде восстановление MnO4- до Mn2+ протекает следующим образом:
MnO4- + 8H+ + 5e = Mn2+ + 4H2O
При окислении в щелочной или нейтральной среде MnO4- восстанавливается до MnO2, выпадающего в осадок бурого цвета:
![]()
Стандартный окислительно-восстановительный потенциал пары MnO4-+ 8H+/ Mn2+ + 4H2O(+1,51 В) гораздо выше, чем Е пары MnO4- + 2H2O / MnO2 + 4OH- (+0,59 В). Следовательно, окислительная способность перманганата в кислой среде выше, чем в щелочной (нейтральной).
В то время как при титровании в кислой среде образуются бесцветные ионы Mn2+, в щелочной или нейтральной среде выпадает темно-бурый осадок, затрудняющий фиксирование точки эквивалентности по окраске небольшого избытка перманганата.
В качестве рабочего раствора в методе перманганатометрии применяют 0,02 н – 0,05 н растворы KMn Использование перманганата калия дает возможность фиксировать точку эквивалентности без применения индикатора, т. к. добавление лишь одной капли избытка стандартного раствора KMnO4 окрашивает титруемый раствор в розовый цвет.
Рабочий раствор KMnO4 нельзя готовить путем взятия точной навески и растворения ее в определенном объеме воды. Обычно берут приблизительную навеску KMnO4 и приготовленный раствор стандартизируют.
Для стандартизации раствора перманганата калия применяют H2C2O4 · 2H2O, (NH4)2C2O4 · H2O, Na2C2O4, As2O3, K4[Fe(CN)6], металлическое железо и некоторые другие вещества. Наиболее удобны как установочные вещества щавелевая кислота и ее соли, т. к. они могут быть легко очищены от примесей перекристаллизацией из водных растворов.
Методом перманганатометрии можно определять:
Восстановители (методом прямого титрования): низкозарядные ионы, способные давать соединения высших степеней окисления (Fe2+, Sn2+, Ti3++, Cr2+ и др.); отрицательно заряженные ионы неметаллов (S2-, I-, Br); комплексные анионы-восстановители (SCN - , CN -, SO3 2-, S2O32-, NO2-, C2O42- и др.).
Окислители (методом обратного титрования):NO3- , C2O82-, Cr2O72-, MnO2,PbO2 и др.
Вещества, не обладающие окислительно-восстановительными свойствами (методом косвенного титрования) : Ca2+-, Bi3+-, Zn2+-ионы и др.
Пример10. Определить молярную массу эквивалента окислителя и восстановителя в реакции
5HAsO2 + 2MnO4- + 6H+ + 2H2O = 5H3AsO4 + 2Mn2+
Решение. Запишем уравнения полуреакций, соответствующих превращениям окислителя
MnO4- + 8H+ + 5ē = Mn2+ + 4H2O (11.1)
и восстановителя:
HAsO2 + 2H2O = H3AsO4 + 2H+ + 2ē (11.2)
Как можно видеть из уравнения (11.1), перманганат-ион восстанавливается до Mn2+, принимая пять электронов. Следовательно, одному электрону соответствует частица 1/5 MnO4-, т.е. f’экв.(MnO4-) = 1/5. Молярная масса эквивалента окислителя равна

Аналогично из уравнения (11.2) следует, что одному электрону соответствует частица 1/2 HAsO2, т.е. f’экв (HAsO2) = 1/2. Молярная масса эквивалента восстановителя равна

Лабоаторная работа №8
Перманганатометрическое определение железа (II).
Содержание работы
Целью работы является определение содержания железа методом пеманганатометрического титрования,совершенствование умений проводения расчетов в количественном анализе.
В
сильнокислой среде KMnO4
является
сильным окислителем и применяется для
определения многих восстановителей.
Процесс идет по уравнению
Mn + 8Н+
+ 5
+ 8Н+
+ 5 = Мn2+
+ 4Н20;
= Мn2+
+ 4Н20;

Перманганатометрические определения нельзя проводить
в
солянокислой среде, так как
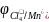 =
1,36 В и в системе будет протекать
конкурирующая реакция окисления Cl-
ионов раствором перманганата калия
=
1,36 В и в системе будет протекать
конкурирующая реакция окисления Cl-
ионов раствором перманганата калия
2 Mn + 2 Сl- + 8 Н+ = 2 Мn2+ + Сl2 + 4 Н20
и результаты анализа окажутся завышенными.
