
- •Введение
- •4.3. Титриметрический метод анализа
- •4.3.1. Классификация методов титриметрического анализа
- •4.3.2. Стандартизация раствора титранта
- •4.3.3. Кривые титрования
- •4.3.3. Индикаторы титриметриметрических методов анализа
- •4.3.4. Принцип эквивалентности
- •4.3.5. Расчет результата прямого титрования при разных способах выражения концентрации раствора
- •4.3.6. Расчет результата в методе обратного титрования
- •4.4 Кислотно-основное титрование.
- •4.4.1.Общая характеристика метода
- •4.4.2 Индикаторы в методе кислотно-основного титрования
- •4.4.3. Кривые титрования
- •4.4.4 Кривая титрования сильной кислоты сильным основанием ( и наоборот)
- •Расчет кривой титрования 10,0 мл 0,1 м hCl раствором 0,1 м NaOh
- •Титрование сильного основания сильной кислотой
- •Расчет кривой титрования 10,0 мл 0,1 м сh3cooh раствором 0,1 м NaOh
- •4.4.5. Техника выполнения работ в титриметрических методах анализа
- •3. Стандартизация раствора хлороводородной кислоты по тетраборату натрия.
- •4. Определение содержания щёлочи в растворе
- •Контрольные вопросы :
- •Задачи для самостоятельного решения
- •5. Окислительно-восстановительное титрование .
- •5.1.Классификация методов окислительно-восстановительного титрования
- •5.2. Индикаторы окислительно-восстановительного титрования
- •5.3.Перманганатометрия
- •1. Приготовление раствора титранта кМnO4
- •2. Приготовление раствора первичного стандарта
- •3. Стандартизация раствора титранта кМnO4
- •4. Вычисления
- •5) Определение железа (II)
- •6. Физико - химические методы анализа.
- •Определение концентрации ионов меди в растворе
- •4. Определение меди в исследуемом растворе
- •1. Основные понятия аналитической химии
- •2. Методы качественного анализа
- •3. Классификация катионов в качественном кислотно-основном
- •4. Методы количественного анализа
- •4.3. Титриметрический метод анализа
- •4.4 Кислотно-основное титрование.
- •5. Окислительно-восстановительное титрование .
- •6. Физико - химические методы анализа.
- •4.3. Титриметрический метод анализа
- •4.3.1. Классификация методов титриметрического анализа
- •4.3.2. Стандартизация раствора титранта
- •4.3.3. Кривые титрования
- •4.3.3. Индикаторы титриметриметрических методов анализа
- •4.3.4. Принцип эквивалентности
- •4.3.5. Расчет результата прямого титрования при разных способах выражения концентрации раствора
- •4.3.6. Расчет результата в методе обратного титрования
- •4.4 Кислотно-основное титрование.
- •4.4.1.Общая характеристика метода
- •4.4.2 Индикаторы в методе кислотно-основного титрования
- •4.4.3. Кривые титрования
- •4.4.4 Кривая титрования сильной кислоты сильным основанием ( и наоборот)
- •Расчет кривой титрования 10,0 мл 0,1 м hCl раствором 0,1 м NaOh
- •Титрование сильного основания сильной кислотой
- •Расчет кривой титрования 10,0 мл 0,1 м сh3cooh раствором 0,1 м NaOh
- •4.4.5. Техника выполнения работ в титриметрических методах анализа
- •3. Стандартизация раствора хлороводородной кислоты по тетраборату натрия.
- •4. Определение содержания щёлочи в растворе
- •Контрольные вопросы :
- •Задачи для самостоятельного решения
- •5. Окислительно-восстановительное титрование .
- •5.1.Классификация методов окислительно-восстановительного титрования
- •5.2. Индикаторы окислительно-восстановительного титрования
- •5.3.Перманганатометрия
- •1. Приготовление раствора титранта кМnO4
- •2. Приготовление раствора первичного стандарта
- •3. Стандартизация раствора титранта кМnO4
- •4. Вычисления
- •5) Определение железа (II)
- •6. Физико - химические методы анализа.
- •Определение концентрации ионов меди в растворе
- •4. Определение меди в исследуемом растворе
- •1. Основные понятия аналитической химии
- •2. Методы качественного анализа
- •3. Классификация катионов в качественном кислотно-основном
- •4. Методы количественного анализа
- •4.3. Титриметрический метод анализа
- •4.4 Кислотно-основное титрование.
- •5. Окислительно-восстановительное титрование .
- •6. Физико - химические методы анализа.
Задачи для самостоятельного решения
Какую навеску х. ч. соды Na2CO3 нужно взять, чтобы приготовить 0,5 л 0,15Н раствора?
Сколько миллилитров воды надо прибавить в 10 мл 10М HCl чтобы получить 0,50М раствор?
Сколько миллилитров соляной кислоты (g=1,19гсм3) требуется для приготовления 2,0 л 0,1М раствора?
Сколько миллилитров серной кислоты (g=1,835гсм3) необходимо для приготовления 3,0 л 0,2Н раствора?
Для приготовления 500мл раствора было взято 20 мл соляной кислоты (g=1,19гсм3). Вычислить молярную концентрацию раствора.
Сколько граммов щёлочи, содержащей 98% NaOH и 2% индифферентных примесей, необходимо для приготовления 200 мл 0,1М раствора?
Вычислить молярную концентрацию и титр раствора HCl, если на титрование 0,4217 г буры израсходовано 17,5 мл этой кислоты.
Какую навеску х.ч. безводного K2CO3 нужно взять, чтобы на её титрование израсходовать 20 мл 0,1М H2SO4?
Какую навеску щавелевой кислоты H2C2O4*2H2O нужно взять, чтобы на её титрование израсходовать 15 мл 0,1М NaOH?
Вычислить нормальность H2SO4, если в 10 мл её добавили избыток BaCl2. Масса полученного осадка после фильтрования, прокаливания оказалась 0,2762г.
Навеску 0,6000г H2C2O4*2H2O растворили в мерной колбе ёмкостью 100мл. на титрование 20 мл полученного раствора израсходовали 18,34мл NaOH и его титр по H2C2O4
Навеску 0,5341 г щёлочи, содержащей 92% NaOH и 8% индифферентных примесей, растворили в мерной колбе ёмкостью 100мл. Определить молярность и титр HCl, если на титрование 15 мл раствора NaOH израсходовали 19,5 мл кислоты.
До какого объёма нужно довести раствор, в котором содержится 1,530 г NaOH, чтобы на титрование 20 мл раствора израсходовать 14,7 мл HCl (ТHCl=0,003800гмл)?
Лабораторная работа №7
ОПРЕДЕЛЕНИЕ ПРОЦЕНТНОГО СОДЕРЖАНИЯ АММИАКА В СОЛЯХ АММОНИЯ МЕТОДОМ ОБРАТНОГО ТИТРОВАНИЯ
Содержание работы
Целью работы является определение содержания аммиака в солях аммония методом обратного титрования. Освоение принципов построения методики обратного титрования, приобретение навыков расчетов результатов обратного титрования.
Теоретическая часть
Обратное титрование (титрование по остатку) используется при малой скорости прямой реакции, при отсутствии подходящего индикатора, в случае возможного протекания побочных процессов и в тех случаях ,когда точное установление точки эквивалентности методом прямого титрования затруднительно.
Например,методом обратного титрования определяют содержание аммиака в солях аммония.
Дело в том, что растворы солей аммония, хотя и имеют в результате гидролиза кислую реакцию,выступают как очень слабые кислоты. Поэтому невозможно количественное определение их с достаточной степенью точности прямым титрованием какой-либо сильной щелочью (т.е. невозможно правильно установить точку эквивалентности ,так как изменение окраски индикатора происходит не от одной капли щелочи,а постепенно ).Поэтому в данном случае применим косвенный метод определения - титрование по остатку(обратное титрование).
В методе обратного титрования используются два титранта .
Первый титрант добавляется в о т м е р е н н о м и з б ы т к е,
определяемое вещество вступает с ним в реакцию в
э к в и в а л е н т н ы х к о л и ч е с т в а х ,затем о с т а т о ч н о е
к о л и ч е с т в о первого титранта оттитровывают вторым титрантом.
В данном случае в качестве первого титранта используется стандартизированный раствор гидроксида натрия, в качестве второго титранта - стандартизированный раствор хлороводородной кислоты.
К навеске анализируемой аммонийной соли прибавляют
отмеренный избыточный объем гидроксида натрия. При нагревании
аммонийная соль разлагается, а получающийся аммиак полностью
удаляется:
NH4Cl + NaOH = NH3↑ + NaCl + H2O
По окончании удаления аммиака непрореагировавший остаток
гидроксида натрия оттитровывают вторым титрантом -хлороводородной кислотой.
Таким образом, на разложение аммонийной соли идет только часть
первого титранта, а оставшаяся - затрачивается на реакцию со вторым
титрантом.
Порядок выполнения работы
1. В сухой стаканчик получить анализируемую аммонийную
соль, взвесить его на аналитических весах и результат взвешивания
записывть в рабочий журнал.
Перенести основную часть содержимого стаканчика в мерную колбу вместимостью 250 мл, обязательно используя воронку. Снова взвешивают стаканчик, записывают в журнал второе показание весов и по разности вычисляют величину навески соли m(NH4Cl).
Навеску в мерной колбе растворяют в дистиллированной воде,
тщательно обмывают воронку из промывалки, доводят объем в колбе до
метки водой и перемешивают.
2. Две аликвотные части полученного раствора отбирают пипеткой
вместимостью 25мл и переносят в термостойкие колбы вместимостью
500 мл. Добавляют в каждый стакан из бюретки по 50 мл раствора гидроксида натрия с точно известной концентрацией.
3. Содержимое колб нагревают на водяной бане до полного удаления
аммиака, которое проверяют внесением в выделяющиеся пары влажной
красной лакмусовой полоски.
4. Остудив раствор, добавляют в него 1 - 2 капли метилового
оранжевого и титруют вторым рабочим раствором - раствором
хлороводородной кислоты с известной концентрацией - до перехода
желтой окраски раствора в розовую.
Записывают показания шкалы бюретки в рабочий журнал . Средний результат вычисляют из сходящихся показаний шкалы бюретки.
5.Расчет результата анализа.
По усредненным данным показаний шкалы бюретки
рассчитывают объем хлороводородной кислоты V(HCl), пошедший на
титрование гидроксида натрия, оставшегося после разложения
аммонийной соли.
При этом необходимо учесть вместимость мерной
колбы Vк = 250 мл и вместимость пипетки Vп = 25 мл.
V(HCl) = (hср ⋅ Vк ) / Vп .
Учитывая известные концентрации обоих титрантов с(NaOH) и
с(HCl), а также заданный избыточный объем раствора гидроксида
натрия V(NaOH)=50 мл, рассчитывают массу аммиака m(NH3)
в анализируемом растворе
m(NH3) = [ c(NaOH) ⋅ V(NaOH) - c(HCl) ⋅ V(HCl) ] ⋅ M(NH3) / 1000
Для расчета массовой доли аммиака ω(NH3) в анализируемом
растворе учитывается навеска образца соли m(NH4Cl), рассчитанная по
результатам взвешивания
ω(NH3),% = [ m(NH3) / m(NH4Cl) ] ⋅ 100 .
Контрольные вопросы и задачи:
1.В чем сущность метода обратного титрования? Какова методика проведения анализа методом обратного титрования?
2. В каких случаях применяют метод обратного титрования ?
3. По каким формулам проводят расчет результата анализа в методе обратного титрования титрования .
4.
В 20 мл HCl [T=0,007860],было
пропущено некоторое количество
газообразного
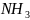 .
Избыток HCl
.
Избыток HCl
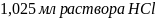 .
Определить количество
,поглощенного
раствором HCl .
.
Определить количество
,поглощенного
раствором HCl .
5.К
120 мл питьевой соды прибавлено 20,00 мл
раствора
 с титром по C𝑎O
0,002500. После кипячения и фильтрования
раствора от осадка
с титром по C𝑎O
0,002500. После кипячения и фильтрования
раствора от осадка избыток
избыток
 был
оттитрован 15,70 мл раствора HCl, 1 мл
которого эквивалентен 1,012 мл раствора
был
оттитрован 15,70 мл раствора HCl, 1 мл
которого эквивалентен 1,012 мл раствора
 Сколько
мл
Сколько
мл
Оксида кальция находится в 100 мл исследуемой воды ?
6.Навеску
сплава массой 0,1938 растворили в
хлороводородной кислоте и магний осадили
гидрофосфатом нтрия в среде аммонийного
буфера.Осадок растворили в 50,00 мл 0,1М
HCl ( К= 0,9981); на обратное титрование с
метиловым оранжевым израсходовали
18,00 мл раствора
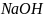 〔Т
〔Т
 =0,004000〕.Определить
массовую долю (%)Μg
в сплаве.
=0,004000〕.Определить
массовую долю (%)Μg
в сплаве.
7.Образец
содержит
и
инертное вещество.К навеске образца
массой 0,500г добавили 50,0 мл 0,100 М
HCl,прокипятили для удаления
 и
оттитровали избыток кислоты 0,100 М
раствором
и
оттитровали избыток кислоты 0,100 М
раствором
в образце?
