
- •Введение
- •4.3. Титриметрический метод анализа
- •4.3.1. Классификация методов титриметрического анализа
- •4.3.2. Стандартизация раствора титранта
- •4.3.3. Кривые титрования
- •4.3.3. Индикаторы титриметриметрических методов анализа
- •4.3.4. Принцип эквивалентности
- •4.3.5. Расчет результата прямого титрования при разных способах выражения концентрации раствора
- •4.3.6. Расчет результата в методе обратного титрования
- •4.4 Кислотно-основное титрование.
- •4.4.1.Общая характеристика метода
- •4.4.2 Индикаторы в методе кислотно-основного титрования
- •4.4.3. Кривые титрования
- •4.4.4 Кривая титрования сильной кислоты сильным основанием ( и наоборот)
- •Расчет кривой титрования 10,0 мл 0,1 м hCl раствором 0,1 м NaOh
- •Титрование сильного основания сильной кислотой
- •Расчет кривой титрования 10,0 мл 0,1 м сh3cooh раствором 0,1 м NaOh
- •4.4.5. Техника выполнения работ в титриметрических методах анализа
- •3. Стандартизация раствора хлороводородной кислоты по тетраборату натрия.
- •4. Определение содержания щёлочи в растворе
- •Контрольные вопросы :
- •Задачи для самостоятельного решения
- •5. Окислительно-восстановительное титрование .
- •5.1.Классификация методов окислительно-восстановительного титрования
- •5.2. Индикаторы окислительно-восстановительного титрования
- •5.3.Перманганатометрия
- •1. Приготовление раствора титранта кМnO4
- •2. Приготовление раствора первичного стандарта
- •3. Стандартизация раствора титранта кМnO4
- •4. Вычисления
- •5) Определение железа (II)
- •6. Физико - химические методы анализа.
- •Определение концентрации ионов меди в растворе
- •4. Определение меди в исследуемом растворе
- •1. Основные понятия аналитической химии
- •2. Методы качественного анализа
- •3. Классификация катионов в качественном кислотно-основном
- •4. Методы количественного анализа
- •4.3. Титриметрический метод анализа
- •4.4 Кислотно-основное титрование.
- •5. Окислительно-восстановительное титрование .
- •6. Физико - химические методы анализа.
- •4.3. Титриметрический метод анализа
- •4.3.1. Классификация методов титриметрического анализа
- •4.3.2. Стандартизация раствора титранта
- •4.3.3. Кривые титрования
- •4.3.3. Индикаторы титриметриметрических методов анализа
- •4.3.4. Принцип эквивалентности
- •4.3.5. Расчет результата прямого титрования при разных способах выражения концентрации раствора
- •4.3.6. Расчет результата в методе обратного титрования
- •4.4 Кислотно-основное титрование.
- •4.4.1.Общая характеристика метода
- •4.4.2 Индикаторы в методе кислотно-основного титрования
- •4.4.3. Кривые титрования
- •4.4.4 Кривая титрования сильной кислоты сильным основанием ( и наоборот)
- •Расчет кривой титрования 10,0 мл 0,1 м hCl раствором 0,1 м NaOh
- •Титрование сильного основания сильной кислотой
- •Расчет кривой титрования 10,0 мл 0,1 м сh3cooh раствором 0,1 м NaOh
- •4.4.5. Техника выполнения работ в титриметрических методах анализа
- •3. Стандартизация раствора хлороводородной кислоты по тетраборату натрия.
- •4. Определение содержания щёлочи в растворе
- •Контрольные вопросы :
- •Задачи для самостоятельного решения
- •5. Окислительно-восстановительное титрование .
- •5.1.Классификация методов окислительно-восстановительного титрования
- •5.2. Индикаторы окислительно-восстановительного титрования
- •5.3.Перманганатометрия
- •1. Приготовление раствора титранта кМnO4
- •2. Приготовление раствора первичного стандарта
- •3. Стандартизация раствора титранта кМnO4
- •4. Вычисления
- •5) Определение железа (II)
- •6. Физико - химические методы анализа.
- •Определение концентрации ионов меди в растворе
- •4. Определение меди в исследуемом растворе
- •1. Основные понятия аналитической химии
- •2. Методы качественного анализа
- •3. Классификация катионов в качественном кислотно-основном
- •4. Методы количественного анализа
- •4.3. Титриметрический метод анализа
- •4.4 Кислотно-основное титрование.
- •5. Окислительно-восстановительное титрование .
- •6. Физико - химические методы анализа.
4.4.5. Техника выполнения работ в титриметрических методах анализа
Титриметрический метод анализа основан на точном измерении обьемов растворов. Для этих целей используют различную мерную посуду (рис.3): мерные колбы для приготовления растворов , пипетки для отбора точного обьема раствора , бюретки для титрования . Точность измерения обьема жидкости с помощью типичной мерной посуды составляет 0,1-0,01 мл. Цилиндры и стаканы не являются мерной посудой , их используют только для приблизительного измерения обьемов жидкости до 15 мл.
.

Рис.3 Мерная посуда
Общие правила работы с мерной посудой .
1. Мерная посуда должна быть чистой. Признак чистоты посуды — равномерное смачивание стенок растворителем (водой). Если на стенках удерживаются отдельные капли , значит посуда грязная. Мерную посуду моют так называемыми моющими жидкостями:
-
хромпик (смесь 15 г измельченного
 с 500 мл концентрированной H2
SO4
(или раствором
H2
SO4
(1:5)],
с 500 мл концентрированной H2
SO4
(или раствором
H2
SO4
(1:5)],
- щелочной раствор KMnO4 (в 1 л 1 М раствора NaOH растворяют 15 г KMnO4 ) .
Сначала моют посуду водопроводной водой с ершиком, затем наливают немного моющей жидкости и, поворачивая сосуд, обмывают ею все стенки.
Моющую жидкость сливают в посуду, где она хранится, через 2—3- мин несколько раз ополаскивают водопроводной водой сосуд, если мыли его хромпиком — несколько раз ополаскивают дистиллированной водой и проверяют чистоту сосуда по смачиваемости.
Высушивать мерную посуду перед работой не следует. 2. Так как мерная посуда калибруется при стандартной температуре (20 °С), то и измерение объемов необходимо проводить при комнатной температуре. Измерять объем горячей или охлажденной жидкости нельзя, это приводит к существенным погрешностям. 3. Для выполнения точных аналитических работ калибровка мерной посуды должна быть проверена. Проверку осуществляют, определяя массу дистиллированной воды (т), заполняющей указанный на мерной колбе объем или вылитой из пипетки или бюретки. Для проверки объема мерной колбы взвешивают сухую мерную колбу,
затем наливают в нее до метки дистиллированную воду и снова взвешивают. Разность этих взвешиваний есть масса воды.
Для проверки объема пипетки взвешивают коническую колбу,набирают в
пипетку дистиллированную воду до метки, выливают ее в колбу и взвешивают колбу. Затем снова набирают в пипетку воду, выливают в ту же колбу и взвешивают ее. Так же взвешивают третью порцию воды. Разность последовательных взвешиваний дает массу воды в объеме пипетки. Находят среднюю массу воды.
Для проверки объема бюретки во взвешенную кони¬ческую колбу выливают из бюретки последовательно по 1—5 мл воды и взвешивают. Находят по разности массу воды. Объем рассчитывают по плотности воды, которую находят по справочным таблицам, предварительно измерив температуру воды: V=m/p.
Полученные данные записывают в таблицу и на их основании строят кривую поправок для любого объема бюретки.
Мерные колбы .
Мерные колбы служат для приготовления стандартных растворов и для разбавления исследуемых растворов до заданного обьема (рис.4).
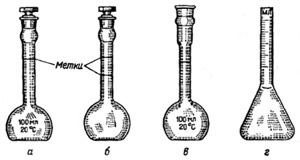
Рис.4 Мерные колбы
Это плоскодонные колбы с длинным узким горлом, на котором нанесена круговая метка.
Обьем указанный на стенке мерной колбы соответствует случаю , когда колба наполнена так,чтобы нижняя часть мениска касалась метки .
Доведение до метки осуществляют так , чтобы метка и глаза наблюдателя находились на одном уровне.Закрывают колбы стеклянными притертыми или резиновыми пробками.
Бюретки
Бюретки представляют собой длинные стеклянные трубки с краном или другим запорным устройством (рис.5). Это может быть надетая на конец бюретки резиновая трубка со стеклянным оттянутым наконечником, которая либо пережимается металлическим зажимом, либо в нее вставлен стеклянный шарик, служащий затвором.

Рис.5. Бюретки
При сдавливании резиновой трубки в месте расположения шарика (рис.5 ) сверху вниз по касательной резина оттягивается, образуется щель между шариком и внутренней стенкой резиновой трубки, через которую вытекает раствор из бюретки. Бюретки изготовляют различной вместимости: 50, 25, 10, 5, 1 мл и менее. Бюретки вместимостью 5 мл и менее называют микробюретками.
На наружной стенке бюретки нанесена шкала из больших делений, соответствующих целым миллилитрам, и малых, соответствующих десятым долям миллилитра
Так как бюретки предназначены для измерения объема вылитой из них жидкости , поэтому они калиброваны на выливание. Бюретки используют, главным образом, при титровании.
Подготовка бюретки к титрованию
Чистую бюретку, закрепленную в лапке лабораторного штатива, ополаскивают 2—3 раза раствором титранта, для чего через воронку наливают его каждый раз по 5—7 мл в бюретку и выливают через запорное устройство в коническую колбу или стакан.
Затем наливают в бюретку через воронку раствор титранта до уровня на 2—3 см выше отметки «0» и заполняют им носик бюретки. Для этого перегибают резиновую трубку, соединяющую бюретку с носиком так, чтобы его конец был направлен вверх, и надавливают кончиками большого и указательного пальцев на стеклянный шарик, находящийся внутри трубки. При этом раствор титранта, вытесняя воздух, заполняет носик бюретки; вытекающий из носика раствор собирают в колбу или стакан для слива. После этого вынимают из бюретки воронку (не забывать!) и выпускают через затвор по каплям титрант в посуду для слива до тех пор, пока нижний край мениска раствора не коснется нулевой отметки бюретки (глаза должны быть на уровне отметки (рис. 5 д.,е.) Титрование
Коническую колбу с аликвотной частью титруемого раствора подставляют под носик бюретки и приподнимают за горло так, чтобы конец носика находился в конической части колбы. Кончиками большого и указатель¬ного пальцев другой руки, надавливая на запорный сте¬клянный шарик, приливают раствор титранта в колбу, регулируя скорость приливания силой давления пальцев на шарик.
Прекращают приливать раствор титранта в момент, указанный в методике. Во время титрования раствор в колбе непрерывно перемешивают легким круговым движением колбы. Расход титранта отсчитывают по нижнему краю мениска титранта в бюретке, определяя на глаз сотые доли миллилитра. Результат титрования записывают в рабочий журнал обязательно указывая сотые доли мл, например 15,46 мл; 9,70 мл и т. п. Параллельно титруют 3—7 проб и находят средний расход титранта, при этом разность любых двух титрований не должна превышать 0,05 мл. Перед каждым титрованием, необходимо заполнять бюретку раствором титранта до нулевой отметки. Если титрант интенсивно окрашен (КМп04, КЬ), его уровень определяют по верхнему краю мениска.
Пипетки
Пипетки предназначены для точного отмеривания определенного объема жидкости и переноса ее из одного сосуда в другой (отбор аликвотных частей).
Эту операцию производят следующим образом
Для отбора аликвотной части погружают конец пипетки в жидкость, всасывают ее (резиновой грушей или специальным шприцем) до уровня немного выше метки и закрывают верхнее отверстие указательным пальцем.
Затем приподнимают пипетку над жидкостью и, ослабив нажим указательного пальца, медленно, по каплям, выпускают избыток жидкости до тех пор, пока нижний край мениска не коснется метки (глаза должны находиться на одном уровне с меткой), в этот момент плотно прижимают указательный палец и прекращают тем самым вытекание жидкости. Если на кончике пипетки остается капля, ее удаляют прикосновением конца пипетки к стенке сосуда (рис. 6 )

Рис. 6
Для выливания жидкости из пипетки опускают в соответствующий сосуд нижний конец пипетки, открывают верхнее отверстие и дают жидкости свободно вытечь, затем слегка касаются носиком пипетки дна или стенки сосуда, держат так пипетку приблизительно 10 с и вынимают ее из сосуда. В носике пипетки всегда остается жидкость. Операция отбора аликвотных частей жидкости должна быть отработана до уровня навыка, это гарантирует ее правильность и воспроизводимость.
Заполняют пипетку только с помощью специальных приспособлений (резиновых груш или специальных пластмассовых шприцев) .
Лабораторная работа № 6
МЕТОД НЕЙТРАЛИЗАЦИИ ,
ОПРЕДЕЛЕНИЕ ЩЕЛОЧИ В РАСТВОРЕ
Содержание работы
Целью работы является ознакомление с методом кислотно-основного титрования, освоение методики приготовления и стандартизации растворов
кислот и основных приемов расчетов, используемых в процессе
приготовления растворов кислот заданной концентрации. Приобретение навыков расчета результатов в методе прямого титрования.
Теоретическая часть
Наиболее удобным для установки титра хлороводородной кислоты считают буру Na2B4O7∙10H2O. Водный раствор его вследствие протолиза имеет щелочную реакцию:
Na2B4O7 + 7H2O = 2NaOH + 4H3BO3
поэтому его можно титровать кислотами:
2NaOH + 2HCl = 2NaCl + 2H2O
В ходе титрования равновесие протолиза тетрабората натрия смещается вправо и всё новые количества щёлочи поступают в раствор до тех пор, пока вся соль полностью не прореагирует.
Из суммарного уравнения:
Na2B4O7 + 2HCl +5H2O = 2NaCl + H3BO3
Видно, что в результате реакции накапливается слабая ортоборная кислота. Следовательно, рН раствора в точке эквивалентности будет несколько меньше 7:
рН=12рК - 12lg Cкисл.,
где рК - силовой показатель константы ионизации борной кислоты по первой ступени, равный 9,24.
Cкисл. - концентрация кислоты в точке эквивалентности. Её можно принять равной половине исходной концентрации буры, т.к. объём раствора в конце титрования обычно в 2 раза больше затраченного раствора буры. Если исходная концентрация раствора буры будет 0,1Н, то концентрация борной кислоты в эквивалентной точке будет равна 0,05Н.
Отсюда, рН в точке эквивалентности равен:
рН = 12´9,24 - 12lg5´10-2 = 4,62+0,35 = 5
Т.к. область скачка на кривой титрования для данного случая располагается от 6 до 4, то титрование можно проводить в присутствии индикаторов метилоранжа (рТ=4) или метилкрасного (рТ=5.5). С выбранным индикатором проводят титрование и на основании полученных данных вычисляют точную концентрацию соляной кислоты (получают титрованный раствор или рабочий раствор).
Пользуясь этим рабочим раствором, с помощью титрования можно определять весовые количества щёлочи в растворах.
Ход работы
Лабораторная работа складывается из нескольких операций:
Из навески готовят стандартный раствор тетрабората натрия (Na2B4O7∙10H2O0.
Получают приблизительно 0,1 М раствор хлороводородной кислоты.
3. Стандартизируют кислоту по тетраборату натрия (буре).
1. Приготовление 100мл стандартного 0,1Н раствора тетрабората натрия.
1. Вычислить приблизительную навеску буры Na2B4O7·10H2O (m1), необходимую для приготовления 100мл 0,1Н раствора по формуле:

Поскольку один моль тетрабората натрия Na2B4O7*10H2O в этой реакции взаимодействует с двумя молями ионов водорода, молярная масса эквивалента его равна 381,4:2=190,7гмоль. Для приготовления 100мл 0,1Н раствора требуется:
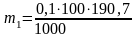
тетрабората натрия.
2. На аналитических весах взять навеску буры около 2 г. Для этого сначала на аналитических весах взвесить сухой стаканчик и его массу записать в лабораторный журнал, а затем в нём взвесить навеску буры: по разности масс стаканчика с бурой и пустого определить точную навеску буры-m2- (записать полученную массу в лабораторный журнал).
3. Перенести навеску из стаканчика количественно в мерную колбу на 100мл следующим образом: навеску буры растворить в стаканчике в небольшом количестве горячей воды и осторожно перелить в мерную колбу (не теряя при этом ни одной капли полученного раствора). Затем промыть стаканчик 4-5 раз небольшим количеством горячей воды, выливая каждую порцию в мерную колбу. Охладить полученный раствор до комнатной температуры, долить до метки дистиллированной водой. Закрыть колбу чистой пробкой и тщательно перемешать.
4. Рассчитать с точностью до пятой значащей цифры нормальность полученного раствора (Сб) буры по формуле:

2. Приготовление 250 мл 0,1М раствора HCl из концентрированной хлороводородной кислоты.
1. Ареометром измерить плотность концентрированной соляной кислоты (измерение производить под тягой).
2. Для полученной плотности по справочнику (Ю.Ю.Лурье: Справочник по аналитической химии) найти молярность (она же молярная концентрация эквивалента для HCl) концентрированный HCl (С1).
3.
По
формуле
 рассчитать V1
объём концентрированной соляной кислоты
(мл), необходимый для приготовления 250
мл 0,1М раствора HCl
(расчёт приближенный).
рассчитать V1
объём концентрированной соляной кислоты
(мл), необходимый для приготовления 250
мл 0,1М раствора HCl
(расчёт приближенный).
4. Налить в пробирку с делениями рассчитанный объём концентрированной соляной кислоты с небольшим избытком 0,1-0,3 мл.
5. В склянку с притёртой пробкой налить мензуркой 250 мл дистиллированной воды, вылить туда же отмеренный объём кислоты, закрыть склянку и перемешать.
