- •Міністерство освіти і науки україни
- •Харків - 2003
- •Загальні методичні вказівки до виконання контрольних робіт
- •1. Фізичні основи класичної механіки Методика розв’язування задач
- •1.1 Кінематика
- •1.2 Динаміка
- •Приклади розв’язування задач
- •Фізичний аналіз
- •Розв’язання
- •Фізичний аналіз
- •Розв’язання
- •Фізичний аналіз
- •Розв’язання
- •Фізичний аналіз
- •Розв’язання
- •Фізичний аналіз
- •Розв’язання
- •Контрольна робота №1
- •2. Молекулярна фізика та термодинаміка
- •Методика розв’язування задач
- •2.1 Молекулярна фізика
- •2.2 Термодинаміка
- •2.3 Явища переносу
- •Приклади розв’язання задач
- •Фізичний аналіз
- •Розв’язання
- •Фізичний аналіз
- •Розв’язання
- •Задача 3. Яка частина молекул водню при ˚c має швидкість в інтервалі від 2000 до 2100 м/с?
- •Фізичний аналіз
- •Розв’язання
- •Фізичний аналіз
- •Розв’язання
- •Фізичний аналіз
- •Розв’язання
- •Густину газу визначимо з рівняння стану ідеального газу
- •Фізичний аналіз
- •Розв’язання Визначимо зміну ентропії, що відбувається в системі, за формулою:
- •Фізичний аналіз
- •Розв’язання
- •Контрольна робота № 2
- •Додаток а
- •Основні рівняння і формули кінематики прямолінійного руху
- •Основні рівняння і формули кінематики обертального руху
- •Додаток б
- •Вимоги до оформлення контрольних робіт
- •Даньшева Світлана Олегівна Омеляненко Іван Федорович
- •Підготовлено та віддруковано рвв
Фізичний аналіз
Фізичну систему утворює ідеальний газ. Початковий та кінцевий стан системи відомі. Виходячи з цього, можна визначити зміну внутрішньої енергії ( ), тому що вона не залежить від виду процесу.
Враховуючи, що процеси, в яких бере участь газ, квазістатичні, параметри проміжного стану системи можна обчислити за допомогою газових законів, а потім визначити роботу, яку виконує система, і кількість теплоти за першим законом термодинаміки.
Розв’язання
Розглянутий
процес зображується на діаграмі
двома відрізками прямих – ізохорою –
![]() та ізобарою
та ізобарою
![]() ,
де
,
де
![]() - проміжний стан, який характеризується
параметрами
- проміжний стан, який характеризується
параметрами
![]() .
Користуючись рівнянням стану, легко
показати, що
.
Користуючись рівнянням стану, легко
показати, що
![]() ,
оскільки маса азоту залишається сталою,
то в точках 1 та
,
наприклад, матимемо:
,
оскільки маса азоту залишається сталою,
то в точках 1 та
,
наприклад, матимемо:
![]() ,
звідки
,
звідки
![]() .
Аналогічно
.
Аналогічно
![]() ,
звідки
,
звідки
![]() (див. умову).
(див. умову).
Визначимо зміну внутрішньої енергії.
Згідно з рівнянням внутрішньої енергії
![]() ,
,
де
![]() - число молів азоту.
- число молів азоту.
Оскільки згідно з рівнянням стану ідеального газу
![]() -
для стану 1,
-
для стану 1,
![]() -
для стану 2,
-
для стану 2,
то
![]() ,
,
тоді
![]() .
.
Після
обчислення за цією формулою одержимо
![]() Дж.
Дж.
2. Обчислимо кількість теплоти.
При ізохорному та ізобарному процесах кількості теплоти дорівнюють відповідно:
![]() ,
,
![]() .
.
Шукана
сумарна теплота процесу
![]() дорівнює:
дорівнює:
![]()
Оскільки
![]()
![]() ,
,
![]() ,
а
,
а
![]() ,
,
то:
![]() .
.
Після обчислення одержимо:
![]() (Дж).
(Дж).
Як бачимо, в результаті переходу азот віддає теплоту зовнішньому середовищу.
Шукана
робота
![]() ,
тому що при ізохорній зміні стану
,
тому що при ізохорній зміні стану
![]() .
Отже, згідно з рівнянням
.
Отже, згідно з рівнянням
![]() .
.
Після
обчислення одержимо:
![]() Дж.
Дж.
Робота від’ємна, як це й повинно бути при стиcкуванні газу.
Задача
5. На
якій висоті
густина повітря
![]() при температурі
при температурі
![]() С
зменшується порівняно з густиною
С
зменшується порівняно з густиною
![]() на рівні моря вдвічі? Температуру газу
вважати сталою.
на рівні моря вдвічі? Температуру газу
вважати сталою.
|
|
- ? |
Фізичний аналіз
Фізична система – повітря, що знаходиться у полі тяжіння Землі, тому розподіл молекул повітря підпорядковується закону Больцмана. При розв’язанні задачі повітря будемо вважати ідеальним газом.
Розв’язання
Для розв’язання задачі будемо використовувати барометричну формулу
![]() , (1)
, (1)
де
![]() - тиск газу на висоті
,
- тиск газу на висоті
,
![]() - тиск на висоті
- тиск на висоті
![]() .
.
Густину газу визначимо з рівняння стану ідеального газу
![]() , (2)
, (2)
![]() (3)
(3)
Підставляючи (2) і (3) в (1), одержимо:
![]() ,
тоді
,
тоді
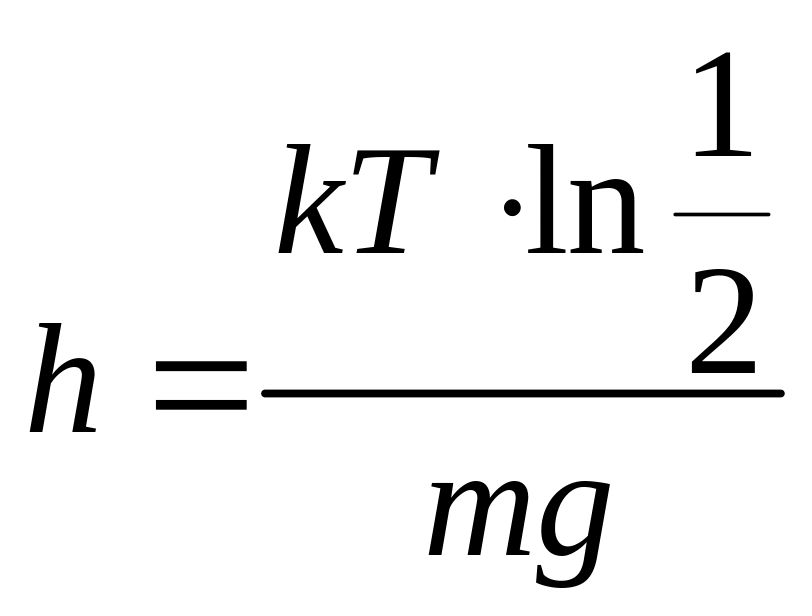 .
.
Після
обчислення за цією формулою одержимо:
![]() км.
км.
Задача
6.
Обчислити
зміну ентропії азоту масою
![]() кг,
що охолоджується від температури
кг,
що охолоджується від температури
![]() К
до
К
до
![]() К
при сталому об’ємі.
К
при сталому об’ємі.
кг К К
|
|
|
Фізичний аналіз
Фізична система – азот масою . Фізичний процес полягає у зміні ентропії газу, що відбувається при ізохорному процесі. Процес є квазістатичним та оборотним.
Розв’язання Визначимо зміну ентропії, що відбувається в системі, за формулою:
![]() ,
,
де
![]() - кількість теплоти, що її віддає система
при охолодженні.
- кількість теплоти, що її віддає система
при охолодженні.
Цю зміну кількості теплоти визначимо з I-го початку термодинаміки
.
Для
ізохорного процесу
![]() ,
тому
,
тому
![]() .
.
Тоді
 .
.
Кількість
ступенів вільності азоту
![]() .
.
Після
обчислення за цією формулою одержимо:
![]() Дж/К (знак “-” свідчить про те, що у
цьому процесі ентропія зменшується).
Дж/К (знак “-” свідчить про те, що у
цьому процесі ентропія зменшується).
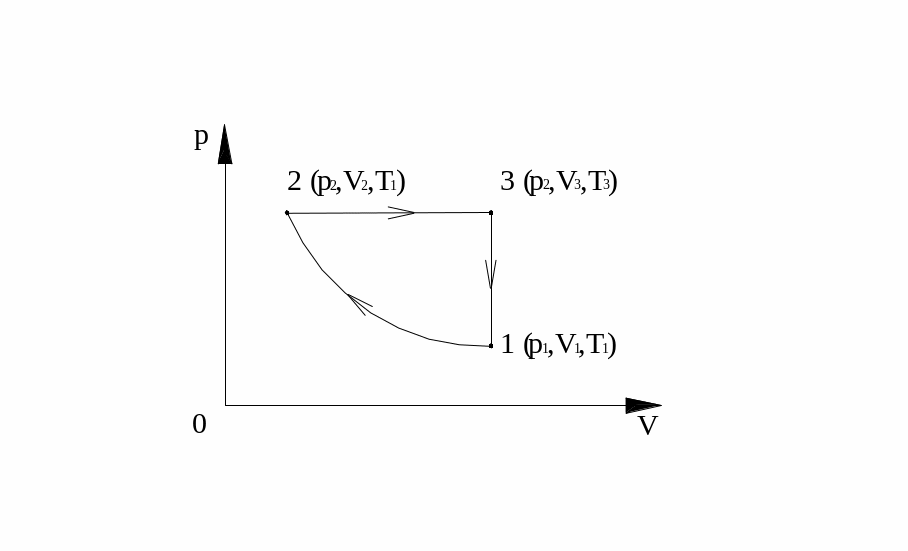
Приклад 7. Один моль ідеального газу здійснює цикл, який складається з ізотерми, ізобари та ізохори. Обчислити ККД циклу.
|
(2-3)
(3-1)
|
|
-? |